Хлорид
| |||
| Називи | |||
|---|---|---|---|
| Системски IUPAC назив
Хлорид[1] | |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| Бајлштајн | 3587171 | ||
| ChEBI | |||
| ChemSpider | |||
| Гмелин Референца | 14910 | ||
| KEGG[2] | |||
| |||
| |||
| Својства | |||
| Cl− | |||
| Моларна маса | 35,45 g·mol−1 | ||
| Конјугована киселина | Хлороводоник | ||
| Термохемија | |||
Стандардна моларна
ентропија (S |
153,36 J K−1 mol−1[5] | ||
Стандардна енталпија
стварања (ΔfH |
−167 kJ·mol−1[5] | ||
| Сродна једињења | |||
Други анјони
|
Флуорид | ||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |||
| Референце инфокутије | |||
Хлорид је анјон (негативно наелектрисани јон) Cl− који настаје прикључивањем електрона атому хлора, или кад се једињење као што је хлороводоник раствори у води или неком другом поларном растварачу. Овај назив такође означава и сваку со која потиче од хлороводоничне киселине. Хлоридне соли као што је натријум хлорид често су веома растворне у води.[6] Хлорид је есенцијални електролит присутан у свим телесним флуидима који је одговоран за одржавање киселинско/базног баланса, трансмитоване нервних импулса и регулацију флуида у и изван ћелија. У органској хемији именом „хлорид“ означавају се и нека органска једињења која садрже у себи хлор а нису соли. На пример, метил хлорид, са стандардним именом хлорометан (погледајте ИУПАЦ књиге) је органско једињење са ковалентном C−Cl везом у којој хлор није анјон.
Најпознатији хлорид је натријум хлорид, познат и као кухињска со. Он је и најраспрострањенији од соли растворених у океанима. Познати хлориди су још: магнезијум хлорид (MgCl2), амонијум хлорид (NH4Cl), калај(II) хлорид (SnCl2), калај(IV) хлорид (SnCl4), хлороводоник (HCl), угљеник тетрахлорид (CCl4), бром хлорид (BrCl).
Електрична својства[уреди | уреди извор]
Хлоридни јон је много већи од атома хлора, 167 и 99 pm, респективно. Јон је безбојан и дијамагнетичан. У воденом раствору, он је у већини случајева високо растворљив; међутим, за неке хлоридне соли, као што су сребро хлорид, олово(II) хлорид и жива(I) хлорид, мало су растворљиве у води.[7] У воденом раствору хлорид је везан за протонске крајеве молекула воде.
Присуство у природи[уреди | уреди извор]
Морска вода садржи 1,94% хлорида. Неки минерали који садрже хлорид обухватају хлориде натријума (халит или NaCl), калијума (силвит или KCl) и магнезијума (бисхофит), хидратисани MgCl2. Концентрација хлорида у крви назива се серумски хлорид, а ову концентрацију регулишу бубрези. Хлоридни јон је структурна компонента неких протеина, нпр. присутан је у ензиму амилаза.
Хлорид се налази као електролит, може да тече кроз хлоридне канале (укључујући GABAA рецептор), и бива транспортован путем KCC2 и NKCC2 транспортери. Хлорид је обично (мада не увек) у вишој ванћелијског концентрацији, због чега има негативан реверзни потенцијал (око -61 mV на 37 °C у ћелији сисара).[8]
Улога у биологији[уреди | уреди извор]
Хлорид је есенцијални електролит, који се уноси и износи из ћелије путем хлоридних канала и игра кључну улогу у одржавању ћелијске хомеостазе и преношењу акционих потенцијала у неуронима.[9] Карактеристичне концентрације хлорида у моделским организмима су: у E. coli и пупећем квасцу 10-200 mM (у зависности од медија), у ћелијама сисара 5-100 мМ и у крвној плазми 100 mM.[10]
Бубрежна реапсорпција хлорида[уреди | уреди извор]
Бубрежна реапсорпција хлорида (Cl−) је део бубрежне физиологије, чија главна сврха је да се не изгуби сувише хлорида у урину.
| Карактеристика | проксимална тубула | Хенлеова петља | дистална тубула | систем колекторских канала | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| S1 | S2 | S3 | силазни део | уски узлазни део | широки узлазни део | повезујућа тубула | иницијална прикупљачка тубула | кортикални сабирни канали | медуларни сабирни канали | ||
| реапсорпција (%) | |||||||||||
| реапсорпција (mmol/дан) | |||||||||||
| концентрација (mM) | 115[11] | 135[11] | |||||||||
| електрична погонска сила (mV) | −3[12] | +3[12] | +15[12] | −5 to +5[12] | −40[12] | ||||||
| хемијска погонска сила (mV) | |||||||||||
| електрохемијска погонска сила (mV) | (позитивна) [13] | ||||||||||
| апикални транспортни протеини | (пасивно)[13] | ||||||||||
| базолатерални транспортни протеини |
|
|
хлоридни канали | ||||||||
| Друга реапсорпциона својства | |||||||||||
Улога у привреди[уреди | уреди извор]
Индустрија хлорних алкалија је знатни потрошач светског енергетског буџета. Овај процес претвара натријум хлорид у хлор и натријум хидроксид, који се користе за прављење многих других материјала и хемикалија. Процес укључује две паралелне реакције:
- 2 Cl− → Cl
2 + 2 e− - 2 H
2O + 2 e− → H2 + 2 OH−
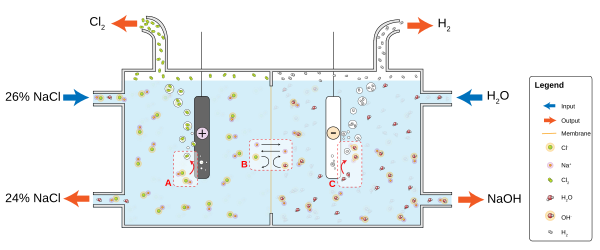
Квалитет и обрада воде[уреди | уреди извор]
Други значајни вид примена хлорида је десалинизација, која обухвата енергетски интензивно уклањање хлоридних соли да би се добила вода за пиће. У нафтној индустрији, хлориди су пажљиво надгледани састојак блатовог система.[14] Повећање садржаја хлорида у блатном систему може бити показатељ бушења у формацију слане воде високог притиска. Његово повећање такође може указивати на лош квалитет циљаног песка.
Хлорид је такође користан и поуздан хемијски показатељ фекалне контаминације реке/подземне воде, јер је хлорид нереактивни растворак и свеприсутан је у канализацији и питкој води. Многе компаније које регулишу воду широм света користе хлорид за проверу нивоа загађења река и извора пијаће воде.[15]
Употреба у домаћинству[уреди | уреди извор]
Хлоридне солик као што је натријум хлорид се користе за презервацију хране.
Корозија[уреди | уреди извор]
Присуство хлорида, нпр. у морској води, значајно погоршава услове дубинске корозије већине метала (укључујући нерђајуће челике, алуминијум, легуре алуминијума и високолегиране материјале) поспешујући формирање и раст рупа аутокаталитичким процесом.

Кристали натријум хлорида, који су попут већине хлоридних соли безбојни и растворни у води. 
Структура натријум хлорида, показује тенденцију хлоридних јона (зелене сфере) да се везују за неколико катјона.
Реакције хлорида[уреди | уреди извор]
Хлорид може да буде оксидован, али се не може редуковати. Прва оксидација, која се користи у хлор-алкалном процесу, је претварање у гас хлора. Хлор се може даље оксидовати у друге оксиде и оксианјоне, укључујући хипохлорит (ClO−, активни састојак хлорног избељивача), хлор диоксид (ClO2), хлорат (ClO−
3) и перхлорат (ClO−
4).
У погледу својих кисело-базних својстава, хлорид је веома слаба база, што показује негативна pKa вредност хлороводоничне киселине. Хлорид се може протонисати јаким киселинама, као што је сумпорна киселина:
- NaCl + H2SO4 → NaHSO4 + HCl
Реакција јонских хлоридних соли са другим солима је размена анјона. Присуство хлорида често се открива формирањем нерастворљивог сребро-хлорида након третирања са јоном сребра:
- Cl− + Ag+ → AgCl
Концентрација хлорида у тесту може се одредити коришћењем хлоридометра, који детектује јоне сребра након што се сав хлорид у тесту исталожи путем ове реакције.
Хлорисане сребрне електроде се најчешће користе у ex vivo електрофизиологији.[16]
Примери[уреди | уреди извор]
Један од примера је кухињска со, која је натријум хлорид са хемијском формулом NaCl. Она се у води дисоцира на Na+ и Cl− јоне. Соли, као што су калцијум хлорид, магнезијум хлорид, калијум хлорид, имају различите намене у распону од медицинских третмана до стварања цемента.[6]
Калцијум хлорид (CaCl2) је со која се продаје у облику пелета за уклањање влаге из просторија. Калцијум хлорид се такође користи за одржавање неасфалтираних путева и за учвршћивање основа путева за нову изградњу. Поред тога, калцијум хлорид се широко користи као средство за уклањање леда, јер је ефикасан у снижавању тачке топљења када се нанесе на лед.[17]
Примери ковалентно везаних хлорида су фосфор трихлорид, фосфор пентахлорид и тионил хлорид, који су реактивна хлорирајућа средства која су коришћена у лабораторији.
Други оксианјони[уреди | уреди извор]
Хлор може да поприми оксидациона стања од −1, +1, +3, +5, или +7. Познато је неколико неутралних хлорних оксида.
| Оксидационо стање хлора | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Име | хлорид | хипохлорит | хлорит | хлорат | перхлорат |
| Формула | Cl− | ClO− | ClO− 2 |
ClO− 3 |
ClO− 4 |
| Структура | 
|

|

|
Референце[уреди | уреди извор]
- ^ „Chloride ion - PubChem Public Chemical Database”. The PubChem Project. USA: National Center for Biotechnology Information.
- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б Zumdahl 2009, стр. A21
- ^ а б Green, John, and Sadru Damji. "Chapter 3." Chemistry. Camberwell, Vic.: IBID, 2001. Print.
- ^ Zumdahl, Steven (2013). Chemical Principles (7th изд.). Cengage Learning. стр. 109. ISBN 978-1-285-13370-6.
- ^ Equilibrium (or reversal) potentials
- ^ Jentsch, Thomas J.; Stein, Valentin; Weinreich, Frank; Zdebik, Anselm A. (1. 4. 2002). „Molecular Structure and Physiological Function of Chloride Channels”. Physiological Reviews. 82 (2): 503—568. ISSN 0031-9333. PMID 11917096. doi:10.1152/physrev.00029.2001.
- ^ Milo, Ron; Philips, Rob. „Cell Biology by the Numbers: What are the concentrations of different ions in cells?”. book.bionumbers.org. Приступљено 24. 3. 2017.
- ^ а б в г д ђ е ж з и Walter F., PhD. Boron (2005). Medical Physiology: A Cellular And Molecular Approaoch. Elsevier/Saunders. ISBN 978-1-4160-2328-9. Page 780
- ^ а б в г д Walter F., PhD. Boron (2005). Medical Physiology: A Cellular And Molecular Approaoch. Elsevier/Saunders. стр. 777. ISBN 978-1-4160-2328-9.
- ^ а б Walter F., PhD. Boron (2005). Medical Physiology: A Cellular And Molecular Approaoch. Elsevier/Saunders. стр. 779. ISBN 978-1-4160-2328-9.
- ^ Petroleum Engineering Handbook, Volume II: Drilling Engineering. Society of Petroleum Engineers. 2007. стр. 90—95. ISBN 978-1-55563-114-7.
- ^ „Chlorides”. www.gopetsamerica.com. Архивирано из оригинала 18. 08. 2016. г. Приступљено 14. 4. 2018.
- ^ Molleman, Areles (2003). "Patch Clamping: An Introductory Guide to Patch Clamp Electrophysiology". Wiley & Sons. ISBN 978-0-471-48685-5.
- ^ „Common Salts”. hyperphysics.phy-astr.gsu.edu. Georgia State University.
Литература[уреди | уреди извор]
- Zumdahl, Steven S. (2009). Chemical Principles (6th изд.). Houghton Mifflin Company. стр. A21. ISBN 978-0-618-94690-7.




