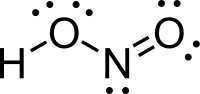
Азотаста киселина
| |
| Називи | |
|---|---|
| Преферисани IUPAC назив
Нитроус ацид | |
| Системски IUPAC назив
Хидроксидооксидоазот | |
| Идентификација | |
3Д модел (Jmol)
|
|
| 3DMet | Б00022 |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.029.057 |
| EC број | 231-963-7 |
| Гмелин Референца | 983 |
| КЕГГ[1] | |
| МеСХ | Нитроус+ацид |
| |
| Својства | |
| HNO2 | |
| Моларна маса | 47,013 g/mol |
| Агрегатно стање | бледо плави раствор |
| Густина | Približno 1 g/ml |
| Тачка топљења | Poznata je samo u rastvoru |
| Киселост (пКа) | 3.398 |
| Опасности | |
| Тачка паљења | није запаљива |
| Сродна једињења | |
Други ањони
|
Азотна киселина |
Други катјони
|
Натријум нитрит Калијум нитрит Амонијум нитрит |
Сродна једињења
|
Диазот триоксид |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
Азотаста киселина (нитритна киселина) је једињење са молекулском формулом HNO2). Она је слаба и монобазина киселина која је позната само у раствору и у облику нитритних соли.[4][5]
Азотаста киселина се користи за прављење диазида из амина. До тога долази нуклеофилним нападом амина на нитрит, репротонацијом уз помоћ растварача, и двоструком елиминацијом у води. Диазид се затим ослобађа и даје карбен или карбеноид.
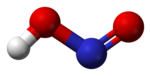
Структура[уреди | уреди извор]
У гасовитој фази, планарни молекул азотасте киселине може да поприми cis и trans форму. Trans форма је предоминатна на собној температури, и ИР мерења указују да је стабилнија за око 2.3 kJ mol−1.[6]
 |
 |
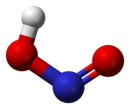 |
(са микроталаног спектра) |
Припрема[уреди | уреди извор]
Азотаста киселина се прави опрезном закишељавањем хладних разблажених раствора нитритног јона, NO2−. Слободна азотаста киселина је нестабилна и брзо се разлаже.
Разлагање[уреди | уреди извор]
Осим у веома разблаженим, хладним растворима, азотаста киселина се брзо разлаже у азот диоксид, азот моноксид, и воду:
- 2 HNO2 → NO2 + NO + H2O
Азот диоксид се диспропорционише у азотну киселину и азотасту киселину у воденом раствору:[7]
- 2 NO2 + H2O → HNO3 + HNO2
У топлим или концентрисаним растворима, свеукупна реакција доводи до формирања азотне киселине, воде, и азот оксида:
- 3 HNO2 → HNO3 + 2 NO + H2O
Референце[уреди | уреди извор]
- ^ Јоанне Wиxон; Доуглас Келл (2000). „Wебсите Ревиеw: Тхе Кyото Енцyцлопедиа оф Генес анд Геномес — КЕГГ”. Yеаст. 17 (1): 48—55. дои:10.1002/(СИЦИ)1097-0061(200004)17:1<48::АИД-YЕА2>3.0.ЦО;2-Х.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2005.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II изд.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
- ^ Kameoka Yohji, Pigford Robert (1977). „Absorption of Nitrogen Dioxide into Water, Sulfuric Acid, Sodium Hydroxide, and Alkaline Sodium Sulfite Aqueous”. Ind. Eng. Chem. Fundamen. 16 (1): 163—169. doi:10.1021/i160061a031.
Spoljašnje veze[уреди | уреди извор]
