Фактор некрозе тумора-алфа
Фактор некрозе тумора (ТНФ, кахексин или кахектин; раније познат као фактор некрозе тумора алфа или ТНФ-а) је адипокин и цитокин. ТНФ је члан суперфамилије ТНФ, која се састоји од различитих трансмембранских протеина са хомологним ТНФ доменом.
Као адипокин, ТНФ промовише инсулинску резистенцију и повезан је са дијабетесом типа 2 изазваним гојазношћу. Као цитокин, ТНФ користи имуни систем за ћелијску сигнализацију. Ако макрофаги (одређена бела крвна зрнца) открију инфекцију, ослобађају ТНФ како би упозорили друге ћелије имуног система као део инфламаторног одговора.
ТНФ сигнализација се дешава преко два рецептора: ТНФР1 и ТНФР2. ТНФР1 је конститутивно експримиран на већини типова ћелија, док је ТНФР2 ограничен првенствено на ендотелне, епителне и подгрупе имуних ћелија. ТНФР1 сигнализација има тенденцију да буде проинфламаторна и апоптотска, док је ТНФР2 сигнализација антиинфламаторна и промовише пролиферацију ћелија. Супресија ТНФР1 сигнализације је важна за лечење аутоимуних болести, док ТНФР2 сигнализација промовише зарастање рана.[1]
ТНФ-α постоји као трансмембрански облик (мТНФ-а) и као растворљиви облик (сТНФ-α). сТНФ-α је резултат ензимског цепања мТНФ-а, процесом који се назива презентација супстрата. мТНФ-α се углавном налази на моноцитима/макрофагима где ступа у интеракцију са ткивним рецепторима контактом од ћелије до ћелије. сТНФ-а се селективно везује за ТНФР1, док се мТНФ-а везује и за ТНФР1 и за ТНФР2. Везивање ТНФ-а за ТНФР1 је иреверзибилно, док је везивање за ТНФР2 реверзибилно.[2]
Примарна улога ТНФ-α је у регулацији имуних ћелија. ТНФ, као ендогени пироген, може да изазове грозницу, апоптотичку смрт ћелија, кахексију и упалу, инхибира туморигенезу и репликацију вируса и реагује на сепсу преко ћелија које производе ИЛ-1 и ИЛ-6. Дисрегулација производње ТНФ-а је умешана у низ људских болести укључујући Алцхајмерову болест,[3] рак, велику депресију,[4] псоријазу[5] и инфламаторну болест црева (ИБЦ).[6] Иако су контроверзне, неке студије повезују депресију и ИБД са повећаним нивоом ТНФ-а.[7]
Под именом тасонермин, ТНФ се користи као имуностимулирајући лек у лечењу одређених карцинома. Лекови који сузбијају дејство ТНФ-а користе се у лечењу различитих инфламаторних болести, на пример реуматоидног артритиса.
Одређени карциноми могу изазвати прекомерну производњу ТНФ-а. ТНФ је паралелан са паратироидним хормоном како у изазивању секундарне хиперкалцемије тако и код канцера са којима је повезана прекомерна производња.
Откриће[уреди | уреди извор]
Теорија антитуморог респонса имунског система ин виво је била оформљена пре више од 100 године од стране лекара Wилијам Б. Коли. 1968 године је Др. Гале А Грангер са Калифорнијског универзитета у Ирвинама је открио цитотоксични фактор који производе лимфоцити и назвао га је лимфотоксин (LT).[8] Заслугу за ово откриће такође има др. Нанси Х. Руддле са Јелског универзитета, која је истовремено независно објавила ту исту активност.[9] Накнадно 1975 године др. Ллоyд Ј. Олд из Меморијалног Слоан-Кеттеринг центар за рак, Њујорк, је објавио још један цитотоксични фактор који производе макрофаге, и назвао га је фактор некрозе тумора (TNF).[10] Oba faktora su bila opisana na osnovu njihove sposobnosti da ubiju mišje fibrosarkom L-929 ћелије.
Кад су LT и TNF cDNK секвенце клониране 1984 године,[11] испоставило се да су веома сличне. Путем TNF везивања за рецептор, и његовим истискивањем LT-ом је потврђена функционална хомологија између ова два фактора. Секвенциона и функционална хомологија TNF и LT је довела до преименовања TNF као TNFα и LT као TNFβ. 1985 године, Бруц А. Беутлер и Антони Церами су открили да је хормоне који индукује кахексију, и који је претходно био назван кахектин, заправо TNF.[12] Ови истраживачи су потом утврдили да је TNF кључни медијатор септичког шока у респонсу на инфекцију.[13] Субсеквентно је било прихваћено да је TNF прототипски члан велике цитокинске фамилије, TNF фамилије.
Ген[уреди | уреди извор]
Људски TNF ген (TNFA) је био клониран 1985.[14] Он се налази на хромозому 6п21.3, садржи око 3 кб и има 4 ексона. Задњи ексон кодира за више од 80% излученог протеина.[15] TNF-алфа 3' UTR садржи AU-богат елемент (ARE).
Структура[уреди | уреди извор]
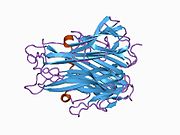
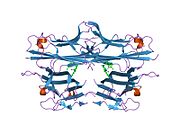
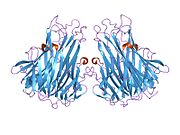
TNF се првенствено производи као 212-аминокиселина-дугачак тип II трансмембрански протеин који формира стабилне хомотримере.[16][17] Из ове форме интегрисане у мембрану, растворни хомотримерни цитокин (sTNF) се формира путем протеолитичког одсецања металопротеазама TNF-алфа конвертујућим ензимима (TACE, који се такође зове ADAM17).[18] Растворни 51 kDa тримерични sTNF је склон дисоцијацији у концентрацијама испод наномоларних, тако да губи своју биоактивност.
17-kDa TNF протомери (185-аминокиселина-дуги) се састоје од две антипаралелне β-наборане равни са антипаралелним β-ланцима. Они формирају 'Швајцарска ролна' β-структуру, која је типична за TNF фамилију, а која је такође присутна код виралних капсидних протеина.
Ћелијска сигнализација[уреди | уреди извор]

Два рецептора, TNF-R1 (TNF рецептор тип 1; CD120a; p55/60) и TNF-R2 (TNF рецептор тип 2; CD120b; p75/80), се могу везати за TNF. TNF-R1 је изражен у већини ткива, и може бити потпуно активиран са обе форме протеина, мембрански-везаном и растворном тримерном формом TNF. TNF-R2 се може наћи само у ћелијама имунског система, и одговара на форму TNF-тримера која је везана за мембрану. Највећи део доступних информација о TNF сигнализацији изведен из TNF-R1. Улога TNF-R2 рецептора није довољно испитана.
Након контакта са њиховим лигандом, TNF рецептори такође формирају тримере, њихови избочени делови попуњавају жлебове између TNF мономера. Везивање узрокује конформациону промену рецептора, чиме долази до дисоцијације инхибиторног протеина SODD са интрацелуларног домена. Ова дисоцијација омогућава адаптерском протеину TRADD да се веже за домен угинућа, а овим ствара могућност за додатно протеинско везивање. Након TRADD везивања, три сигнална пута могу бити иницирана.[19][20]
- Активација NF-κB: TRADD регрутује TRAF2 и RIP. TRAF22 затим регрутује мултикомпонентни протеин киназу IKK, што омогућава серин-треонин кинази RIP да га активира. Инхибиторни протеин, IκBα, који се нормално везује за NF-κB и инхибира његову транслокацију, се фосфорилише IKK киназом и накнадно се деградира, чиме се ослобађа NF-κB. NF-κB је хетеродимерни транскрипциони фактор који се транслоцира у нуклеус и посредује транскрипцију великог броја протеина који имају удела у ћелијском преживљавању и пролиферацији, инфламаторном одговору, као и антиапоптозних фактора.
- Активација MAPK пута: Од три главне MAPK каскаде, TNF индукује јаку активацију стрес-везане JNK групе, евоцира умерени p38-MAPK одговор, и одговоран је за минималну активацију класичних ERK протеина. TRAF2 активира JNK-индукујуће низводне киназе MEKK1 и ASK1 (било директно или кроз GCK и Trx, респективно), и те две киназе фосфорилизују MKK7, која онда активира JNK. JNK се транслоцира у нуклеус и активира транскрипционе факторе као што су c-Jun и ATF2. JNK сигнални пут учествује у ћелијској диференцијацији, пролиферацији, и генерално је проапоптозан.
- Индукција сигнала смрти: Попут свих домен-смрти садржавајућих чланова TNFR суперфамилије, TNF-R1 учествује у сигнализацији ћелијске смрти.[21] Међутим, TNF-индукована ћелијска смрт игра само мању улогу у поређењу са његовим свеобухватним функцијама у инфламаторном процесу. Његов смрт-индукујући капацитет је слаб у поређењу са другим члановима фамилије (као што је Fas), и често је прикривен NF-κB антиапоптозним ефектима. Ипак, TRADD везује FADD, који онда регрутује цистеин протеазу каспазу-8. Висока концентрација капсазе-8 индукује његову ауто-протеолитичку активацију и накнадно цепање ефекторских каспаза, што доводи до ћелијске апоптозе.
Интеракције[уреди | уреди извор]
За фактор некрозе тумора-алфа је било показано да интерагује са TNFRSF1A.[22][23]
Види још[уреди | уреди извор]
- Лимфотоксин (Фактор некрозе тумора-бета)
Референце[уреди | уреди извор]
- ^ Гоугх, Портиа; Мyлес, Иан А. (2020). „Тумор Нецросис Фацтор Рецепторс: Плеиотропиц Сигналинг Цомплеxес анд Тхеир Дифферентиал Еффецтс”. Фронтиерс ин Иммунологy. 11. ПМЦ 7723893
 . ПМИД 33324405. дои:10.3389/фимму.2020.585880
. ПМИД 33324405. дои:10.3389/фимму.2020.585880  ..
..
- ^ Сзондy, Зсузса; Паллаи, Анна (2017). „Трансмембране ТНФ-алпха реверсе сигналинг леадинг то ТГФ-бета продуцтион ис селецтивелy ацтиватед бy ТНФ таргетинг молецулес: Тхерапеутиц имплицатионс”. Пхармацологицал Ресеарцх. 115: 124—132. ПМИД 27888159. С2ЦИД 40818956. дои:10.1016/ј.пхрс.2016.11.025.
- ^ Сwардфагер, Wалтер; Ланцтôт, Криста; Ротхенбург, Лана; Wонг, Амy; Цаппелл, Јацлyн; Херрманн, Натхан (2010). „А Мета-Аналyсис оф Цyтокинес ин Алзхеимер'с Дисеасе”. Биологицал Псyцхиатрy. 68 (10): 930—941. ПМИД 20692646. С2ЦИД 6544784. дои:10.1016/ј.биопсyцх.2010.06.012.
- ^ Доwлати, Yекта; Херрманн, Натхан; Сwардфагер, Wалтер; Лиу, Хелена; Схам, Лаурен; Реим, Елyсе К.; Ланцтôт, Криста L. (2010). „А Мета-Аналyсис оф Цyтокинес ин Мајор Депрессион”. Биологицал Псyцхиатрy. 67 (5): 446—457. ПМИД 20015486. С2ЦИД 230209. дои:10.1016/ј.биопсyцх.2009.09.033.
- ^ Вицтор ФЦ, Готтлиеб АБ (2002). „ТНФ-алпха анд апоптосис: имплицатионс фор тхе патхогенесис анд треатмент оф псориасис”. Ј Другс Дерматол. 1 (3): 264—75. ПМИД 12851985..
- ^ Брyнсков Ј, Фоегх П, Педерсен Г, Еллервик C, Киркегаард Т, Бингхам А, Саермарк Т (2002). "Тумоур нецросис фацтор алпха цонвертинг ензyме (ТАЦЕ) ацтивитy ин тхе цолониц муцоса оф патиентс wитх инфламматорy боwел дисеасе". Гут. Брyнсков, Ј.; Фоегх, П.; Педерсен, Г.; Еллервик, C.; Киркегаард, Т.; Бингхам, А.; Саермарк, Т. (2002). „Тумоур нецросис фацтор цонвертинг ензyме (ТАЦЕ) ацтивитy ин тхе цолониц муцоса оф патиентс wитх инфламматорy боwел дисеасе”. Гут. 51 (1): 37—43. ПМЦ 1773288
 . ПМИД 12077089. дои:10.1136/гут.51.1.37. Непознати параметар
. ПМИД 12077089. дои:10.1136/гут.51.1.37. Непознати параметар |ДУПЛИЦАТЕ_дои=игнорисан (помоћ). - ^ Талароwска, Моника; Гаłецки, Пиотр; Сземрај, Јанусз; Гаłецка, Елżбиета; Бобиńска, Кинга (1970). „Ис тхере а линк бетwеен ТНФ гене еxпрессион анд цогнитиве дефицитс ин депрессион”. Ацта Биоцхим. Пол. 64 (1): 65—73. ПМИД 27991935. дои:10.18388/абп.2016_1276..
- ^ Колб WП, Грангер ГА (1968). „Лyмпхоцyте ин витро цyтотоxицитy: цхарацтеризатион оф хуман лyмпхотоxин”. Проц. Натл. Ацад. Сци. У.С.А. 61 (4): 1250—5. Бибцоде:1968ПНАС...61.1250К. ПМЦ 225248
 . ПМИД 5249808. дои:10.1073/пнас.61.4.1250
. ПМИД 5249808. дои:10.1073/пнас.61.4.1250  .
.
- ^ Руддле НХ, Wаксман БХ (1968). „Цyтотоxицитy медиатед бy солубле антиген анд лyмпхоцyтес ин делаyед хyперсенситивитy. 3. Аналyсис оф мецханисм”. Ј. Еxп. Мед. 128 (6): 1267—79. ПМЦ 2138574
 . ПМИД 5693925. дои:10.1084/јем.128.6.1267.
. ПМИД 5693925. дои:10.1084/јем.128.6.1267.
- ^ Царсwелл ЕА, Олд Љ, Кассел РЛ, Греен С, Фиоре Н, Wиллиамсон Б (1975). „Ан ендотоxин-индуцед серум фацтор тхат цаусес нецросис оф туморс”. Проц. Натл. Ацад. Сци. У.С.А. 72 (9): 3666—70. Бибцоде:1975ПНАС...72.3666Ц. ПМЦ 433057
 . ПМИД 1103152. дои:10.1073/пнас.72.9.3666
. ПМИД 1103152. дои:10.1073/пнас.72.9.3666  .
.
- ^ Пенница D, Недwин ГЕ, Хаyфлицк ЈС, Сеебург ПХ, Дерyнцк Р, Палладино МА, Кохр WЈ, Аггарwал ББ, Гоеддел DV (1984). „Хуман тумоур нецросис фацтор: прецурсор струцтуре, еxпрессион анд хомологy то лyмпхотоxин”. Натуре. 312 (5996): 724—9. Бибцоде:1984Натур.312..724П. ПМИД 6392892. С2ЦИД 4245957. дои:10.1038/312724а0.
- ^ Беутлер Б, Греенwалд D, Хулмес ЈД, Цханг M, Пан YЦ, Матхисон Ј, Улевитцх Р, Церами А (1985). „Идентитy оф тумоур нецросис фацтор анд тхе мацропхаге-сецретед фацтор цацхецтин”. Натуре. 316 (6028): 552—4. Бибцоде:1985Натур.316..552Б. ПМИД 2993897. С2ЦИД 4339006. дои:10.1038/316552а0.
- ^ Беутлер Б, Милсарк ИW, Церами АЦ (1985). „Пассиве иммунизатион агаинст цацхецтин/тумор нецросис фацтор протецтс мице фром летхал еффецт оф ендотоxин”. Сциенце (Јоурнал). 229 (4716): 869—71. Бибцоде:1985Сци...229..869Б. ПМИД 3895437. дои:10.1126/сциенце.3895437.
- ^ Олд Љ (1985). „Тумор нецросис фацтор (ТНФ)”. Сциенце. 230 (4726): 630—2. Бибцоде:1985Сци...230..630О. ПМИД 2413547. дои:10.1126/сциенце.2413547.
- ^ Недwин ГЕ, Наyлор СЛ, Сакагуцхи АY, Смитх D, Јарретт-Недwин Ј, Пенница D, Гоеддел DV, Граy ПW (1985). „Хуман лyмпхотоxин анд тумор нецросис фацтор генес: струцтуре, хомологy анд цхромосомал лоцализатион”. Нуцлеиц Ацидс Рес. 13 (17): 6361—73. ПМЦ 321958
 . ПМИД 2995927. дои:10.1093/нар/13.17.6361.
. ПМИД 2995927. дои:10.1093/нар/13.17.6361.
- ^ Криеглер M, Перез C, ДеФаy К, Алберт I, Лу СД (1988). „А новел форм оф ТНФ/цацхецтин ис а целл сурфаце цyтотоxиц трансмембране протеин: рамифицатионс фор тхе цомплеx пхyсиологy оф ТНФ”. Целл. 53 (1): 45—53. ПМИД 3349526. С2ЦИД 31789769. дои:10.1016/0092-8674(88)90486-2.
- ^ Танг П, Хунг MC, Клостергаард Ј (1996). „Хуман про-тумор нецросис фацтор ис а хомотример”. Биоцхемистрy. 35 (25): 8216—25. ПМИД 8679576. дои:10.1021/би952182т.
- ^ Блацк РА, Рауцх ЦТ, Козлоскy ЦЈ, Песцхон ЈЈ, Слацк ЈЛ, Wолфсон МФ, Цастнер БЈ, Стоцкинг КЛ, Реддy П, Сринивасан С, Нелсон Н, Боиани Н, Сцхоолеy КА, Герхарт M, Давис Р, Фитзнер ЈН, Јохнсон РС, Паxтон РЈ, Марцх ЦЈ, Церретти ДП (1997). „А металлопротеинасе дисинтегрин тхат релеасес тумоур-нецросис фацтор-алпха фром целлс”. Натуре. 385 (6618): 729—33. Бибцоде:1997Натур.385..729Б. ПМИД 9034190. С2ЦИД 4251053. дои:10.1038/385729а0.
- ^ Wајант Х, Пфизенмаиер К, Сцхеурицх П (2003). „Тумор нецросис фацтор сигналинг”. Целл Деатх Диффер. 10 (1): 45—65. ПМИД 12655295. С2ЦИД 7922995. дои:10.1038/сј.цдд.4401189.
- ^ Цхен Г, Гоеддел DV (2002). „ТНФ-Р1 сигналинг: а беаутифул патхwаy”. Сциенце. 296 (5573): 1634—5. Бибцоде:2002Сци...296.1634Ц. ПМИД 12040173. С2ЦИД 25321662. дои:10.1126/сциенце.1071924.
- ^ Гаур У, Аггарwал ББ (2003). „Регулатион оф пролифератион, сурвивал анд апоптосис бy мемберс оф тхе ТНФ суперфамилy”. Биоцхем. Пхармацол. 66 (8): 1403—8. ПМИД 14555214. дои:10.1016/С0006-2952(03)00490-8.
- ^ Боуwмеестер, Теwис; Бауцх Ангела; et al. (2004). „А пхyсицал анд фунцтионал мап оф тхе хуман ТНФ-алпха/НФ-каппа Б сигнал трансдуцтион патхwаy”. Нат. Целл Биол. Енгланд. 6 (2): 97—105. ИССН 1465-7392. ПМИД 14743216. С2ЦИД 11683986. дои:10.1038/нцб1086.
- ^ Мицхеау, Оливиер; Тсцхопп Јüрг (2003). „Индуцтион оф ТНФ рецептор I-медиатед апоптосис виа тwо сеqуентиал сигналинг цомплеxес”. Целл. Унитед Статес. 114 (2): 181—90. ИССН 0092-8674. ПМИД 12887920. С2ЦИД 17145731. дои:10.1016/С0092-8674(03)00521-X.
Спољашње везе[уреди | уреди извор]
- Тумор+Нецросис+Фацтор-алпха на US National Library of Medicine Medical Subject Headings (MeSH)