Карбонилна група

У органској хемији, карбонилна група је фамилија функционалних група које се састоје од угљениковог атома двоструко-везаног за кисеоников атом: C=O.[1]
Термин карбонил се такође може односити на угљен-моноксид као лиганд у неорганским или органометалним комплексима (метални карбонил, нпр. никл-тетракарбонил).
Карбонилна једињења[уреди | уреди извор]
Карбонилна група карактерише следеће типове једињења:
| Једињење | Алдехид | Кетон | Карбоксилна киселина | Естар | Амид | Енон | Ацил халид | Ацил анхидрид |
| Структура |  |
 |
 |
 |
 |

| ||
| Генерална формула | RCHO | RCOR' | RCOOH | RCOOR' | RCONR'R'' | RC(O)C(R')CR''R''' | RCOX | (RCO)2О |
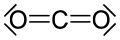
Други органски карбонили су уреја и карбамати, деривати ацил хлорида: хлороформати и фосген, карбонатни естри, тиоестри, лактони, лактами, хидроксамати, и изоцијанати. Примери неорганских карбонилних једињења су угљен-диоксид и карбонил-сулфид.
Специјална група карбонилних једињења су 1,3-дикарбонил једињења која имају киселе протоне на централној метиленској јединици. Примери су Мелдрумска киселина, диетил малонат и ацетилацетон.
Реактивност[уреди | уреди извор]

Кисеоник је електронегативнији од угљеника, тако да одвлачи електронску густину са угљеника чиме повећава поларност везе. Карбонилни угљеник постаје електрофилан, и стога лакше реагује са нуклеофилима. Исто тако, електронегативни кисеоник може да реагује са електрофилима; на пример са протоном из киселог раствора или другим Луисовим киселинама.
Алфа водоници карбонилног једињења су знатно киселији (~103 пута киселији) него у водоници типичне C-H везе. На пример, pKa вредности ацеталдехида и ацетона су 16.7 и 19, респективно.[2] Карбонил је у таутомерној резонанци са енолом. Депротонација енола јаком базом производи енолат, који је снажан нуклеофил и може да алкилује електрофиле као што су други карбонили.
Референце[уреди | уреди извор]
- ^ Цлаyден, Јонатхан; Греевес, Ницк; Wаррен, Стуарт; Wотхерс, Петер (2001). Органиц Цхемистрy (I изд.). Оxфорд Университy Пресс. ИСБН 978-0-19-850346-0.
- ^ Оуеллетте, Р.Ј. анд Раwн, Ј.D. “Органиц Цхемистрy” 1ст Ед. Прентице-Халл, Инц., 1996: Неw Јерсеy. ISBN 978-0-02-390171-3..
Literatura[уреди | уреди извор]
Dodatna literatura[уреди | уреди извор]
- L.G. Wade, Jr (2002). Organic Chemistry (5th изд.). Prentice Hall. ISBN 978-0-13-033832-7.
- The Frostburg State University Chemistry Department. Organic Chemistry Help (2000).
- Advanced Chemistry Development, Inc. IUPAC Nomenclature of Organic Chemistry (1997).
- William Reusch. tara VirtualText of Organic Chemistry (2004).
- Purdue Chemistry Department [1] (retrieved Sep 2006). Includes water solubility data.
- William Reusch. (2004) Aldehydes and Ketones Архивирано на сајту Wayback Machine (30. април 2010), Приступљено 23. 5. 2005.
- ILPI. (2005) The MSDS Hyperglossary- Anhydride.
