Међумолекулска сила

Међумолекулске силе су силе привлачења и одбијања које делују између суседних честица: атома, молекула или јона. Оне су слабе у поређењу са интрамолекулским силама које држе атоме молекула. На пример, ковалентна веза присутна у HCl молекулима је много јача него силе присутне између суседних молекула, које се јављају кад су молекули довољно близу један другог.[1][2] Оба сета сила су есенцијални делови поља сила, које се често користи у молекулској механици.
Истраживање интермолекуларних сила почиње од макроскопских опажања која указују на постојање и деловање сила на молекуларном нивоу. Ове опсервације обухватају термодинамичко понашање неидеалинх гасова изражено помоћу виријалних коефицијената, напона паре, вискозности, површинског напона, и података о апсорпцији.
Прва референца о природи микроскопских сила се може наћи у раду Алексиса Клера са насловом Теорија Земљине фигуре.[3] Неки из дугог низа научника који су допринели истраживању макроскопских сила су: Лаплас, Гаус, Максвел и Болцман.
Привлачне међумолекулске силе се групишу у следеће типове:
- Водонично везивање
- Јонско везивање
- Дипол–индуковани дипол силе
- Јон–дипол силе
- Диполом индуковане диполне силе, или Дебајеве силе
Информације о интермолекуларним силама добијају се макроскопским мерењима својстава попут вискозности и података о притиску, запремини, температури (PVT). Веза са макроскопским аспектима је дата путем виријалних коефицијената и Ленард-Џоунсових потенцијала.
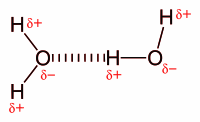
Водонично везивање[уреди | уреди извор]
Водонична веза је привлачење између усамљеног пара једног електронегативног атома и атома водоника, који је везан за било азот, кисеоник, или флуор.[4] Водонична веза се обично описује као јака електростатичка дипол–дипол интеракција. Међутим, она исто тако има извесна својства ковалентног везивања: она је дирекциона, јача је од интеракција ван дер Валсове силе, производи интератомска растојања која су краћа од суме ван дер Валсових радијуса, и обично обухвата ограничен број интеракционих партнера, што се може интерпретирати као вид валенце.
Интермолекуларно водонично везивање је одговорно за високу тачку кључања воде (100 °Ц) у поређењу са другим хидридима 16. групе, који немају водоничне везе. Интрамолекуларно везивање водоника и кисеоника је делом одговорно за секундарне, терцијарне и квартернарне структуре протеина и нуклеинских киселина. Оно исто тако игра важну улогу у структури полимера, синтетичких и природних.[5]
Јонско везивање[уреди | уреди извор]
Привлачење између катјонских и ањонских места је нековалентна или интермолекуларна интеракција која се обично назива јонско спаривање или сони мост.[6] Ова интеракција је есенцијално последица електростатичких сила, мада је у воденом медијуму асоцијација вођена ентропијом и често је чак ендотермна. Већина соли формира кристале са карактеристичним растојањима између јона; за разлику од многих других нековалентних интеракција сони мостови нису дирекциони и показују у чврстом стању обично контакт који је одређен само ван дер Валсовим радијусима јона. Неоргански и органски јони испољавају у води при умереној јонској јачини сличне соне мостове са ΔG вредностима асоцијације од око 5 до 6 kJ/mol за 1:1 комбинације ањона и катјона, скоро независно од њихове природе (јонске величине, поларизабилности итд).[7] ΔG вредности су адитивне и приближно су линеарна функција од наелектрисања. ΔG вредности зависе од јонске јачине (I) раствора, што је описано Дебај-Хикеловом једначином.[8]:217–63[9][10]
Дипол–дипол и сличне интеракције[уреди | уреди извор]
Регуларни дипол[уреди | уреди извор]
Дипол – дипол интеракције су електростатичке интеракције перманентних молекулских дипола. Те интеракције имају тенденцију оријентисања молекула тако да се повећава привлачење (смањује потенцијална енергија). Пример дипол – дипол интеракције се може видети код хлороводоника (HCl). Позитивни крај поларног молекула привлачи негативни крај другог молекула и узрокује да молекули поприме специфичне оријентације. Поларни молекули се међусобно привлаче. На пример HCl и хлороформ (CHCl3).
Често молекули садрже диполарне групе, али немају свеукупни диполни моменат. Ово се дешава ако постоји симетрија унутар молекула која узрокује да се диполи међусобно поништавају. Примери таквих молекула су тетрахлорометан и угљен-диоксид. Дипол–дипол интеракција између два појединачна атома је обично једнака нули, јер се атоми ретко носиоци перманентног дипола. Ове силе су додатно дискутоване у секцији о Кесомовој интеракцији, испод.
Силе јон-дипол и јон-индуковани дипол[уреди | уреди извор]
Силе између јона и дипола, и јона и индукованих дипола, су сличне са интеракцијама међу диполима и индукованим диполима, али у њима учествују јони, уместо само поларних и неполарних молекула. Силе јон–дипол и јон–индуковани дипол су јаче од дипол–дипол интеракција, зато што је наелектрисање било ког јона знатно веће од наелектрисања диполног момента. Јон–дипол везивање је јаче од водоничног везивања.[11]
Јон–дипол сила се састоји од интеракције јона и поларног молекула. Они се поравнавају тако да су позитивне и негативне групе једна поред друге, што омогућава максимално привлачење.
Јон–индуковани дипол сила се састоји од интеракције јона и неполарног молекула. Попут силе између дипола и индукованог дипола, наелектрисање јона узрокује дисторзију електронског облака на неполарном молекулу.[12]
Ван дер Валсове силе[уреди | уреди извор]
Ван дер Валове силе настају из интеракције између ненаелектрисаних атома или молекула, што доводи не само до таквих феномена као што је кохезија кондензованих фаза и физичка адсорпција гасова, него исто тако до универзалне силе привлачења између макроскопских тела.[13]
Кесомове интеракције (имеђу перманентних дипола)[уреди | уреди извор]
Први допринос ван дер Валсових сила је узрокован електростатичким интеракцијама између наелектрисања (у молекулским јонима), диполима (за поларне молекуле), квадриполима (свим молекулима са симетријом нижом од кубне), и перманентним мултиполима. То се назива Кесовом интеракцијом, која носи назив по Вилему Хендрику Кесу.[14] Ове силе потичу од привлачења између перманентних дипола (диполарних молекула) и температурно су зависне.[13]
Оне се састоје од привлачних интеракција између дипола који су ансамбли усредњени преко различитих ротационих оријентација дипола. Подразумева се да молекули константно ротарају и никад не бивају фиксирани у месту. Ово је добра претпоставка, мада у неком тренутку молекули бивају заробљени у месту. Енергија Кесомове интеракције зависи од инверзног шестог степена растојања, за разлику од енергије интеракције два просторно фиксирана дипола, која зависи од инверзног трећег степена растојања. Кесомова интеракција се може јавити само између молекула који поседују перманентне диполне моменте, и.е. два поларна молекула. Исто тако Кесомове интеракције су веома слабе ван дер Валсове интеракције које се не јављају у растворима који садрже електролите. Угаоно усредњена интеракција је дата следећом једначином:
где је m = диполни моменат, = пермитивност слободног простора, = диелектрична константа околног материјала, T = температура, = Болцманова константа, и r = растојање између молекула.
Дебајева сила индукованог дипола[уреди | уреди извор]
Силе индукованог дипала се јављају услед индукције (такође познате као поларизација), која је привлачна интеракција између перманентног мултипола на једном молекулу и индукованог мултипола другог.[15][16][17][18] Ова интеракција је добила име по Петеру Дебају.
Пример индукционе интеракције између перманентног дипола и индукованог дипола су HCl и Ar. У овом систему, Ar осећа утицај дипола, његове електроне привлачи (на H страну) и одбија (са Cl стране) HCl.[15][17] Ова врста интеракције се може очекивати између било којег поларног молекула и неполарног/симетричног молекула. Сила индуковане интеракције је далеко слабија него дипол - дипол интеракција, међутим она је јача од Лондонове силе.
Лондонова дисперзиона сила[уреди | уреди извор]
Она је позната као квантно индукована тренутна поларизација или тренутна диполом индукована диполна сила. Лондонова дисперзиона сила је узрокована корелисаним кретањем електрона у интерагујућим молекулима. Електрони, који припадају различитим молекулима, почињу да „осећају“ и избегавају један другог на кратким међумолекулским растојањима, што се често описује као формирање „тренутних дипола“ који се привлаче.[19][20][21]
Релативна јачина сила[уреди | уреди извор]
| Тип веза | Енергија дисоцијације (kcal),[22][23] | Енергија дисоцијације
(kJ/mol) |
Напомена |
|---|---|---|---|
| Јонска решетка | 250–4000[24] | 1100-20000 | |
| Ковалентна | 30–260 | 130–1100 | |
| Водоничне везе | 1–12 | 4–50 | Око 5 kcal/mol (21 kJ/mol) у води |
| Дипол–дипол | 0.5–2 | 2–8 | |
| Ван дер Валсова сила | <1 то 15 | <4 то 63 | Прицењено из енталпија испаравања угљоводоника[25] |
Ово поређење је приближно – релативне јачина сила варирају у зависности од молекула. Стварне релативне снаге ће варирати у зависности од укључених молекула. На пример, присуство воде ствара конкурентске интеракције које у великој мери слабе снагу јонских и водоничних веза.[26] Може се сматрати да ће за статичке системе, јонско и ковалентно везивање увек бити јаче од интермолекуларних сила у било којој датој супстанци. Али није тако за велике покретне системе као што су молекули ензима у интеракцији са молекулима супстрата.[27] Овде бројне интрамолекуларне (најчешће - водоничне) везе формирају активно међустање где међумолекулске везе узрокују раскидање једне од ковалентних веза, док се друге формирају, на тај начин омогућавајући хиљаде ензимских реакција, тако важних за живе организме.
Утицај на понашање гасова[уреди | уреди извор]
Интермолекуларне силе су одбојне на кратким удаљеностима и привлачне на великим удаљеностима (погледајте Ленард-Џоунсов потенцијал). У гасу, сила одбијања углавном има ефекат спречавања два молекула да заузму исту запремину. Ово даје реалном гасу тенденцију да заузме већу запремину од идеалног гаса при истој температури и притиску. Привлачна сила зближава молекуле и даје реалном гасу тенденцију да заузме мању запремину од идеалног гаса. Која интеракција је важнија зависи од температуре и притиска (погледајте фактор компресибилности).
У гасу, растојања између молекула су генерално велика, тако да интермолекуларне силе имају само мали ефекат. Привлачну силу не савладава сила одбијања, већ топлотна енергија молекула. Температура је мера топлотне енергије, те повећање температуре смањује утицај привлачне силе. Насупрот томе, температура есенцијално не утиче на силе одбијања.
Када се гас компримује да би се повећала његова густина, повећава се утицај привлачне силе. Ако је гас довољно густ, привлачности могу постати довољно велике да превазиђу тенденцију топлотног кретања да изазове распршивање молекула. Тада се гас може кондензовати и формирати чврсту или течну, односно кондензовану фазу. Нижа температура погодује формирању кондензоване фазе. У кондензованој фази, постоји скоро равнотежа између привлачних и одбојних сила.
Квантномеханичке теорије[уреди | уреди извор]
Интермолекуларне силе уочене између атома и молекула могу се феноменолошки описати да дељују између сталних и тренутних дипола, као што је горе наведено. Алтернативно, може се тражити фундаментална, обједињујућа теорија која је у стању да објасни различите врсте интеракција као што су водоничне везе,[28] ван дер Валсова сила[29] и дипол-дипол интеракције. Обично се то ради применом идеја квантне механике на молекуле, а Рејли-Шредингерова теорија пертурбације је била посебно ефикасна у том погледу. Када се примени на постојеће методе квантне хемије, такво квантно механичко објашњење међумолекулских интеракција пружа низ приближних метода које се могу користити за анализу међумолекуларних интеракција.[30] Једна од најкориснијих метода за визуелизацију ове врсте интермолекуларних интеракција, која се може пронаћи у квантној хемији, је индекс нековалентне интеракције, који се заснива на електронској густини система. Лондонске дисперзивне силе играју велику улогу у томе.
Што се тиче топологије електронске густине, недавно су се појавиле методе засноване на методама градијента електронске густине, посебно са развојем ИБСИ (индекс унутрашње чврстоће везе),[31] ослањајући се на ИГМ методологију (Независни модел градијента).[32][33][34]
Референце[уреди | уреди извор]
- ^ Доналд А. МцQуаррие; Јохн D. Симон (1997). Пхyсицал Цхемистрy: А Молецулар Аппроацх (1ст изд.). Университy Сциенце Боокс. ИСБН 0935702997.
- ^ Петер Аткинс; Јулио де Паула (2001). Пхyсицал Цхемистрy (7тх изд.). W. Х. Фрееман. ИСБН 0716735393.
- ^ Маргенау, Х. анд Кестнер, Н.: Тхеорy оф интер-молецулар форцес, Интернатионал Сериес оф Монограпхс ин Натурал Пхилосопхy. . Pergamon Press. 1969. ISBN 978-1-4831-1928-1.
- ^ IUPAC. „hydrogen bond”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Lindh, Ulf (2013), „Biological functions of the elements”, Ур.: Selinus, Olle, Essentials of Medical Geology (Revised изд.), Dordrecht: Springer, стр. 129—177, ISBN 978-94-007-4374-8, doi:10.1007/978-94-007-4375-5_7
- ^ Ionic Interactions in Natural and Synthetic Macromolecules A. Ciferri and A. Perico, Eds., 2012 John Wiley & Sons, Inc., p. 35 ff. ISBN 978-0-470-52927-0.
- ^ Biedermann F; Schneider, H. J. (2016). „Experimental Binding Energies in Supramolecular Complexes”. Chem. Rev. 116 (9): 5216—5300. PMID 27136957. doi:10.1021/acs.chemrev.5b00583.
- ^ The Collected Papers of Peter J. W. Debye. New York, New York: Interscience Publishers, Inc. 1954.
- ^ ^ Harris, Daniel C. (2003). Quantitative Chemical Analysis (6th изд.). W. H. Freeman & Company. ISBN 978-0-7167-4464-1.
- ^ Salzman, William R. (21. 8. 2001). „Mixtures; Partial Molar Quantities; Ideal Solutions”. Chemical Thermodynamics. University of Arizona. Архивирано из оригинала 7. 6. 2007. г. Приступљено 23. 10. 2007.
- ^ Tro, Nivaldo (2011). Chemistry: A Molecular Approach. United States: Pearson Education Inc. стр. 466. ISBN 978-0-321-65178-5.
- ^ Blaber, Michael (1996). Intermolecular Forces Архивирано на сајту Wayback Machine (1. август 2020). mikeblaber.org
- ^ а б Leite, F. L.; Bueno, C. C.; Da Róz, A. L.; Ziemath, E. C.; Oliveira, O. N. (2012). „Theoretical Models for Surface Forces and Adhesion and Their Measurement Using Atomic Force Microscopy”. International Journal of Molecular Sciences. 13 (12): 12773—856. PMC 3497299
 . PMID 23202925. doi:10.3390/ijms131012773
. PMID 23202925. doi:10.3390/ijms131012773  .
.
- ^ Keesom, W. H. (1915). „The second virial coefficient for rigid spherical molecules whose mutual attraction is equivalent to that of a quadruplet placed at its center” (PDF). Proceedings of the Royal Netherlands Academy of Arts and Sciences. 18: 636—646.
- ^ а б Blustin PH, 1978. A Floating Gaussian Orbital calculation on argon hydrochloride (Ar • HCl). Theoret. Chim. Acta 47, 249–257.
- ^ Nannoolal Y, 2006. Development and critical evaluation of group contribution methods for the estimation of critical properties, liquid vapour pressure and liquid viscosity of organic compounds. University of Kwazulu-Natal PhD Thesis.
- ^ а б Roberts JK and Orr WJC, 1938. Induced dipoles and the heat of adsorption of argon on ionic crystals. Trans. Faraday Soc. 34, 1346–1349.
- ^ Sapse AM, Rayez-Meaume MT, Rayez JC and Massa LJ, 1979. Ion-induced dipole H-n clusters. Nature 278, 332–333.
- ^ R. Eisenschitz and F. London, Z. Physik 60, 491 (1930)
- ^ F. London, Z. Physik 63, 245 (1930) and Z. Physik. Chemie, 33, 8-26 (1937). English translations in H. Hettema, Quantum Chemistry, Classic Scientific Papers, World Scientific, Singapore (2000).
- ^ F. London, Transactions of the Faraday Society 33, 8-26 (1937)
- ^ Volland, Dr. Walt. „"Intermolecular" Forces”. Архивирано из оригинала 3. 2. 2010. г. Приступљено 20. 9. 2009.
- ^ Organic Chemistry: Structure and Reactivity by Seyhan Ege, pp. 30–33, 67
- ^ „Lattice Energies”. Приступљено 21. 1. 2014.
- ^ Majer, V.; Svoboda, V. (1985). Enthalpies of Vaporization of Organic Compounds. Oxford: Blackwell Scientific Publications. ISBN 978-0-632-01529-0.
- ^ Alberts B (2015). Molecular biology of the cell (6th изд.). New York, NY. ISBN 978-0-8153-4432-2. OCLC 887605755.
- ^ Savir Y, Tlusty T (мај 2007). „Conformational proofreading: the impact of conformational changes on the specificity of molecular recognition”. PLOS ONE. 2 (5): e468. Bibcode:2007PLoSO...2..468S. PMC 1868595
 . PMID 17520027. doi:10.1371/journal.pone.0000468
. PMID 17520027. doi:10.1371/journal.pone.0000468  .
.
- ^ Arunan E, Desiraju GR, Klein RA, Sadlej J, Scheiner S, Alkorta I, et al. (2011-07-08). „Definition of the hydrogen bond (IUPAC Recommendations 2011)”. Pure and Applied Chemistry. 83 (8): 1637—1641. ISSN 1365-3075. S2CID 97688573. doi:10.1351/PAC-REC-10-01-02
 .
.
- ^ Landau LD, Lifshitz EM (1960). Electrodynamics of Continuous Media
 . Oxford: Pergamon. стр. 368–376.
. Oxford: Pergamon. стр. 368–376.
- ^ King M (1976). „Theory of the Chemical Bond”. Journal of the American Chemical Society. 98 (12): 3415—3420. doi:10.1021/ja00428a004.
- ^ Klein J, Khartabil H, Boisson JC, Contreras-García J, Piquemal JP, Hénon E (март 2020). „New Way for Probing Bond Strength” (PDF). The Journal of Physical Chemistry A. 124 (9): 1850—1860. Bibcode:2020JPCA..124.1850K. PMID 32039597. S2CID 211070812. doi:10.1021/acs.jpca.9b09845.
- ^ Lefebvre C, Rubez G, Khartabil H, Boisson JC, Contreras-García J, Hénon E (јул 2017). „Accurately extracting the signature of intermolecular interactions present in the NCI plot of the reduced density gradient versus electron density” (PDF). Physical Chemistry Chemical Physics. 19 (27): 17928—17936. Bibcode:2017PCCP...1917928L. PMID 28664951. doi:10.1039/C7CP02110K.
- ^ Lefebvre C, Khartabil H, Boisson JC, Contreras-García J, Piquemal JP, Hénon E (март 2018). „The Independent Gradient Model: A New Approach for Probing Strong and Weak Interactions in Molecules from Wave Function Calculations” (PDF). ChemPhysChem. 19 (6): 724—735. PMID 29250908. doi:10.1002/cphc.201701325.
- ^ Ponce-Vargas M, Lefebvre C, Boisson JC, Hénon E (јануар 2020). „Atomic Decomposition Scheme of Noncovalent Interactions Applied to Host-Guest Assemblies”. Journal of Chemical Information and Modeling. 60 (1): 268—278. PMID 31877034. S2CID 209488458. doi:10.1021/acs.jcim.9b01016.
Literatura[уреди | уреди извор]
- The Collected Papers of Peter J. W. Debye. New York, New York: Interscience Publishers, Inc. 1954.
- George A. Jeffrey. An Introduction to Hydrogen Bonding (Topics in Physical Chemistry). Oxford University Press, USA (March 13). 1997. ISBN 978-0-19-509549-4.
- Сун, C. Q.; Сун, Yи (2016). Тхе Аттрибуте оф Wатер: Сингле Нотион, Мултипле Мyтхс. Спрингер. ИСБН 978-981-10-0178-9.
- Паулинг, L. (1960). Тхе натуре оф тхе цхемицал бонд анд тхе струцтуре оф молецулес анд црyсталс; ан интродуцтион то модерн струцтурал цхемистрy (3рд изд.). Итхаца (НY): Цорнелл Университy Пресс. стр. 450. ИСБН 978-0-8014-0333-0.
- Диллон, П. Ф. (2012). Биопхyсицс: А Пхyсиологицал Аппроацх. Цамбридге Университy Пресс. стр. 37. ИСБН 978-1-139-50462-1.
- Хирсцхфелдер, Ј. О.; Цуртисс, C. Ф.; Бирд, Р. Б. (1954), Молецулар Тхеорy оф Гасес анд Лиqуидс, Неw Yорк: Wилеy
- Стоне, А. Ј. (1996), Тхе Тхеорy оф Интермолецулар Форцес, Оxфорд: Цларендон Пресс
- Јохнсон, Давид Артхур (2002). Металс анд Цхемицал Цханге. Опен Университy. Роyал Социетy оф Цхемистрy. ИСБН 978-0-85404-665-2.
- Паулинг, Линус (1960). Тхе Натуре оф тхе Цхемицал Бонд анд тхе Струцтуре оф Молецулес анд Црyсталс: Ан Интродуцтион то Модерн Струцтурал Цхемистрy. Цорнелл Университy Пресс. ИСБН 978-0-8014-0333-0. дои:10.1021/ја01355а027.
Спољашње везе[уреди | уреди извор]
- Софтвер за израчунавање међумолекулских сила