Органофосфор
Органофосфорна једињења су разградива органска једињења која садрже угљеник–фосфорну веза. Ова група једињења не обухвата фосфатне и фосфитне естре. Они се првенствено користе за контролу штеточина као алтернатива хлорисаним угљоводоницима, који су постојани током дугог временског периода. Органофосфорна хемија се бави својствима и реактивношћу органофосфорних једињења. Фосфор и азот су у истој групи периодног система, и стога фосфорна и азотна једињења имају слична својства.[1][2][3]
Ова једињења су веома ефективни инсектициди. Нека од њих једнако отровна за људе у малим дозама (нервни гас). У ову групу једињења спадају нека од најтоксичнијих супстанци икад креираних.[4]
Дефиниција органофосфорних једињења је варијабилна, што може да доведе до забуне. У индустријској и еколошкој хемији, органофосфорна једињења морају једино да садрже један органски супституент, и не морају да имају директну везу између фосфора и угљеника. Стога је велики део пестицида (е.г., малатион), обухваћен овом класом једињења.
Фосфор може да поприми низ оксидативних стања, те се органофосфорна једињења могу класификовати по валентном стању форсфора, и.е. фосфор(V) вс фосфор(III), који су предоминантне класе једињења.
Органофосфорна(V) једињења, главне категорије[уреди | уреди извор]
Фосфатни естри и амиди[уреди | уреди извор]
Фосфатни естри имају општу структуру P(=O)(OR)3 са P(V). Таква једињења су технолошки важна као противпожарни агенси, и пластификатори. Она не садрже P−C везу, те у техничком смислу нису органофосфорна једињења него естри фосфорне киселине. Мноштво деривата је нађено у природи, као што је фосфатидилхолин. Фосфатни естри настају алкохолизом фосфорних оксихлорида. Познати су различити амидо-алкокси деривати, један медицински значајан пример је лек против рака циклофосфамид. Исто тако неки од деривата који садрже тиофосфорилну групу (P=S) су пестициди, попут малатиона. Органофосфати који се припремају у великим размерама су цинк дитиофосфати, као адитиви за морторна уља. Неколико милиона килограма тог координационог комплекса се производи годишње путем реакције фосфор пентасулфида са алкохолима.[5]

Примери органофосфата и сродних једињења: фосфатидилхолин, трифенилфосфат, циклофосфамид, паратион, и зинц дитиофосфат.
Ова једињења се природно разграђују путем хидролизе и крајњи продукти су фосфат и органски алкохол или амин из којих су изведени.
Фосфонска и фосфинске киселине и њихови естри[уреди | уреди извор]
Фосфонати су естри фосфонске киселине и имају општу формулу RP(=O)(OR')2. Фосфонати имају многобројне техничке примене. Један широко познати члан је глифосат, који је продаји под називом Roundup. Са формулом (HO)2P(O)CH2NHCH2CO2H, овај дериват глицина један од најшире коришћених хербицида. Бисфосфонати су класа лекова за третман остеопорозе. Нервни гас сарин, који садржи C–P и F–P везе, је фосфонат.
Фосфинати имају две P–C везе, и општу формулу R2P(=O)(OR'). Комерцијално значајан припадник хербицида је глуфосинат. Слично горе поменутом глифосату, он има структуру CH3P(O)(OH)CH2CH2CH(NH2)CO2H.

Примери фосфоната и фосфината: сарин (фосфонат), глифосат (фосфонат), фосфомицин (фосфонат), золедронска киселина (фосфонат), и глуфосинат (фосфинат). У воденом раствору, фосфонска киселина се јонизују и формирају се кореспондирајући органофосфонати.
Мајкелис-Абрузова реакција је главни метод за синтезу ових једињења. На пример, диметилметилфосфонат (погледајте горње формуле) се формира путем преуређивања триметилфосфита, у присуству катализатора метил јодида. У Хорнер–Вадсворт–Емонсовој реакцији и Сејферт–Гилбертовој хомологацији, фосфонати се користе у реакцији са карбонил једињењима. Кабачник–Филдсова реакција је метод за припрему аминофосфоната. Та једињења садрже веома инертну везу између фосфора и угљеника. Консеквентно, ти материјали се хидролизују, чиме се формирају деривати фосфонске и фосфинске киселине, али не и фосфати.
Фосфински оксиди, имиди, и халкогениди[уреди | уреди извор]
Фосфински оксиди (ознака δ3λ3) имају општу структуру R3P=O са формалним оксидационим стањем V. Фосфински оксиди формирају водоничне везе и неки од њих су стога растворни у води. P=O веза је веома поларна са диполним моментом од 4,51 D за трифенилфосфин оксид.
Једињења сродна са фосфинским оксидима су имиди (R3PNR') и сродни халкогениди (R3PE, где је Е = S, Se, Te). Ова једињења се убрајају међу термички најстабилнија органофосфорна једињења.
Фосфонијум соли и фосфорани[уреди | уреди извор]
Једињења са формулом [PR4+]X− сачињавају фосфонијумске соли. Ова хемијска класа садржи тетраедрална фосфор(V) једињења. Са комерцијалног гледишта, најважнији члан је тетракис(хидроксиметил)фосфонијум хлорид, [P(CH2OH)4]Cl, који се користи за умањење запаљивости текстила. Годишње се произведе око два милиона килограма хлорида и сродног сулфата.[5] Они се формирају реакцијом фосфина са формалдехидом у присуству минералне киселине:
- PH3 + HX + 4 CH2O → [P(CH2OH)4+]X−
Разне фосфонијум соли се могу припремити путем алкилације и арилације органофосфина:
- PR3 + R'X → [PR3R'+]X−
Метилација трифенилфосфина је први корак у припреми Витиговог реагенса.

Примери фосфор(V) једињења: фосфонијум јон P(CH2OH)4+, две резонантне структуре Витиговог реагенса Ph3PCH2, и пентафенилфосфоран, ретко пентаорганофосфорно једињење.
Родитељско једињење фосфорана (δ5λ5) је PH5, које је непознато. Сродна једињења која садрже халиде и органске супституенте на фосфору су доста честа. Једињења са пет органских супституената су ретка, мада је P(C6H5)5 познат. Он је дериват P(C6H5)4+ који настаје реакцијом са фениллитијумом.
Фосфорни илиди су незасићени фосфорани, познати као Витигов реагенси, е.г. CH2P(C6H5)3. Та једињења имају тетраедрални фосфор(V) и она се сматрају сродним са фосфинским оксидима. Она су исто тако изведена из фосфонијум соли, али путем депротонације у уместо алкилације.
Органофосфор(III) једињења, главне категорије[уреди | уреди извор]
Фосфити, фосфонити, и фосфинити[уреди | уреди извор]
Фосфити, познати као фосфитни естри, имају општу формуну P(OR)3 и оксидационо стање +3. Таква једињења настају путем алкохолизе фосфор трихлорида:
- PCl3 + 3 ROH → P(OR)3 + 3 HCl
Ово је општа реакција, која представља веома велики број једињења. Фосфити се користе у Перковој реакцији и Мајкелис-Абрузовој реакцији. Они се користе као лиганди у органометалној хемији.
Интермедијери између фосфита и фосфина су фосфонити (P(OR)2R') и фосфинити (P(OR)R'2). Таква једињења настају путем реакција алкохолизе кореспондирајућих фосфинских и фосфонских хлорида ((PClR'2) и PCl2R', respektivno).
Fosfini[уреди | уреди извор]
Roditeljsko jedinjenje fosfina je PH3. Оно се назива фосфин у САД и Британском Комонвелту, док је у другим земљама познато као фосфан.[6] Замена једног или више водоничних центара са органским супституентима (алкил, арил), даје PH3−xRx, органофосфин, генерално зван фосфин.

Разна редукована органофосфорна једињења: комплекси органофосфинских пинцерних лиганда, хиралних дифосфина који се користе у хомогеној катализи, примарни фосфин PhPH2, и фосфор(I) једињење (PPh)5.
Поређење фосфина и амина[уреди | уреди извор]
Атом фосфора у фосфинима има формално оксидационо стање −3 (δ3λ3). Ова једињења су фосфорни аналози амина. Попут амина, фосфини имају тригоналну пиримидалну молекуларну геометрију мада често са мањим C-E-C угловима (E = N, P), бар у одсуству стерних ефеката. C-P-C угао везе је 98,6° за триметилфосфин, расте до 109,7° кад се метил групе замене tert-бутил групама. Кад се користе као лиганди, стерна запремина терцијарних фосфина се процењује путем њиховог конусног угла. Баријера инверзији је исто тако знатно виша код амина за процес као што је азотна инверзија, и стога фосфини са три различита супституента могу да пређу у термички стабилне оптичке изомере. Фосфини су обично мање базни него кореспондирајући амини, на пример сам фосфонијум јон има pKa од −14, у поређењу са 9,21 за амонијум јон; триметилфосфонијум има pKa од 8,65 у поређењу са 9,76 за триметиламонијум. Међутим, трифенилфосфин (pKa 2,73) је базнији од трифениламина (pKa −5), углавном зато што је слободни пар азота у NPh3 делом делокализован у три фенилна прстена. Док је слободни пар азота делокализован у пиролу, слободни пар на атому фосфора у фосфорном еквиваленту пирола (фосфолу) није. Реактивност фосфина одговара активности амина у погледу нуклеофилности при формирању фосфонијумских соли са општом структуром PR4+X−. Ово својство се користи у Апеловој реакцији за конвертовање алкохола у алкил халиде. Фосфини се лако оксидују до кореспондирајућих фосфинских оксида, док се оксиди амина теже формирају. То један од разлога што се фосфини веома ретко срећу у природи.
Синтетичке руте[уреди | уреди извор]
Са комерцијалног гледишта, најважнији фосфин је трифенилфосфин. Неколико милиона килограма овог материјала се произведе годишње. Он се припрема реакцијом хлоробензена, PCl3, и натријума.[5] Фосфини који су у већој мери специјализовани обично се припремају користећи друге руте.[7] Фосфорни халиди подлежу нуклеофилној супституцији дејством органометалних реагенаса као што су Грињарови реагенси. Консеквентно, неке синтезе обухватају нуклеофилну замену фосфидних ањона еквивалентима (R2P−) са арил- и алкил халидима. Примарни (RPH2) и секундарни фосфини (RRPH и R2PH) се додају у алкене у присуству јаке базе (е.г., KOH у DMSO). Марковниковљево правило важи за ове реакције. Сличне реакције се јављају са алкинима.[8] База није неопходна за електрон-дефицитарне алкене (е.г., деривате акрилонитрила) и алкине.
Под условима слободних радикала P-H везе примарних и секундарних фосфина се додају у алкене. Такве реакције теку путем анти-Марковниковљеве региохемије. Азобисизобутиронитрил или органски пероксиди су корисни као иницијатори. Терцијарни фосфински оксиди и сулфиди се могу редуковати хлоросиланом и другим реагенсима.
Реакције[уреди | уреди извор]
Главни типови реакција фосфина су оне у којима они делују као нуклеофили и базе. Њихова нуклеофилност је евидентна у њиховим реакцијама са алкил халидима при чему се формирају фосфонијум соли. Фосфини су нуклеофилни катализатори при димеризацији енона у разним реакцијама органске синтезе, е.г. Раухут-Каријева реакција.
Фосфини су редукујући агенси, као што је илустровано у Штаудингеровој редукцији конвертовања азида у амине и у Мицунобијевој реакцији конвертовања алкохола у естре. У тим процесима, фосфин се оксидује до фосфинског оксида. Исто тако је познато да фосфини редукују активиране карбонилне групе, на пример редукција α-кето естра до α-хидрокси естра.[9] У предложеном реакционом механизму, први протон на позајмици са метил групе у триметилфосфину (трифенилфосфин не реагује).
Фосфински лиганди[уреди | уреди извор]
Фосфини као што је триметилфосфин су важни лиганди у неорганској хемији. Превасходно захваљујући асиметричној синтези, мноштво различитих хиралних дифосфина је нашло широку примену, као што су БИНАП и ДИПАМП. Велики број фосфинских лиганда укључујући дифосфине се једноставно називају „фос лигандима”.
| сПхос | 
|
СПАНпхос | 
|
| СЕГпхос | 
|
Трипхос | |
| Ксантфос | 
|
XПхос | 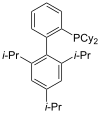
|
| Хирафос | 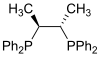
|
дуПхос | 
|
| Репрезентативни фос лиганди | |||
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ -{Dillon, K. B.; Mathey, F.; Nixon, J. F. Phosphorus. The Carbon Copy; John Wiley & Sons,}. ISBN 978-0-471-97360-7.
- ^ -{Quin, L. D. A Guide to Organophosphorus Chemistry; John Wiley & Sons,}. 2000. ISBN 978-0-471-31824-8.
- ^ Racke, K.D. (1992). "Degradation of organophosphorus insecticides in environmental matrices". стр. 47–73 in: Chambers, J.E., Levi, P.E. (eds.), Organophosphates: Chemistry, Fate, and Effects. Academic Press, San Diego. 1997. ISBN 978-0-12-167345-1.
- ^ Lewis, Robert Alan (1998). Lewisʼ Dictionary of Toxicology. CRC Lewis. стр. 763. ISBN 978-1-56670-223-2. Приступљено 18. 7. 2013.
- ^ а б в Svara, Jürgen; Weferling, Norbert & Hofmann, Thomas (2006). „Phosphorus Compounds, Organic”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_545.pub2.
- ^ "phosphanes" in IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford . 1997. ISBN 978-0-9678550-9-7. . doi:10.1351/goldbook.P04548. Недостаје или је празан параметар
|title=(помоћ) - ^ Downing, J.H.; Smith, M.B. „Phosphorus Ligands”. Comprehensive Coordination Chemistry II. 2003: 253—296. doi:10.1016/B0-08-043748-6/01049-5.
- ^ Arbuzova, S. N.; Gusarova, N. K.; Trofimov, B. A. (2006). „Nucleophilic and free-radical additions of phosphines and phosphine chalcogenides to alkenes and alkynes”. Arkivoc. v (5): 12—36. doi:10.3998/ark.5550190.0007.503.
- ^ Zhang, W.; Shi, M. „Reduction of activated carbonyl groups by alkyl phosphines: formation of α-hydroxy esters and ketones”. Chem. Commun. 2006: 1218—1220. doi:10.1039/b516467b.
Literatura[уреди | уреди извор]
- Svara, Jürgen; Weferling, Norbert & Hofmann, Thomas (2006). „Phosphorus Compounds, Organic”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_545.pub2.
- Lewis, Robert Alan (1998). Lewisʼ Dictionary of Toxicology. CRC Lewis. стр. 763. ISBN 978-1-56670-223-2. Приступљено 18. 7. 2013.
Spoljašnje veze[уреди | уреди извор]
- organophosphorus chemistry @ www.chem.wisc.edu
- NMR predictor for organophosphorus compound chemical shifts from Alan Brisdon's Research Group Link






