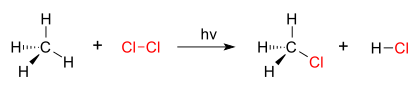
Супституција (хемија)
У супституционим реакцијама, функционална група једног хемијског једињења се замењује другом групом.[1][2] У органској хемији, реакције електрофилне и нуклеофилне супституције имају примарни значај. Реакције органске супституције се класификују у неколико главних типова органских реакција у зависности од тога да ли је реагенс електрофил или нуклеофил, да ли је реакциони интермедијар карбокатјон, карбањон или слободни радикал, или да ли је супстрат алифатичан или ароматичан. Детаљно разумевање типа реакције помаже у предвиђању продукта реакције. То је такође корисно за оптимизацију реакције у погледу променљивих, као што су температура и извор растварача.
Добар пример реакције супституције је фотохемијска хлоринација метана којом се формира метил хлорид. Када се хлорни гас (Цл2) озрачи, неки од молекула се цепају на два радикала хлора (Цл•), чији су слободни електрони јако нуклеофилни. Један од њих прекида ковалентну везу Ц–Х у ЦХ4 и граби атом водоника да би формирао електрични неутрални ХЦл. Други радикал реформише ковалентну везу са ЦХ3• да би формирао ЦХ3Цл (метил хлорид).
| Хлоринација метана хлором |
|---|
Нуклеофилна супституција[уреди | уреди извор]
Нуклеофилна супституција се одвија кад је реагенс нуклеофил (атом или молекул са слободним електронима).[1][2] Нуклеофил реагује са алифатичним супстратом у реакцији нуклеофилне алифатичне супституција.[3][4] Та супституција се може одвијати путем два различита механизма: унимолекуларна нуклеофилна супституција (SN1) и бимолекуларна нуклеофилна супституција (SN2). SN1 механизам има два ступња. У првом ступњу, одлазећа група се удаљи, чиме се формира карбокатјон. У другом ступњу, нуклеофилни реагенс напада карбокатјон и формира сигма везу. Овај механизам може да произведе било инверзију или задржавање конфигурације. SN2 реакција има само један ступањ. Напад реагенса и уклањање одлазеће групе се одвијају истовремено. Овај механизам увек доводи до инверзије конфигурације.[5]
Кад је супстрат ароматично једињење реакциони тип је нуклеофилна ароматична супституција. Деривати карбоксилних киселина реагују са нуклеофилима у нуклеофилној ацилној супституцији.[6] Ова врста реакције може бити корисна у припреми једињења.
Најопштији облик за реакцију може се дати као
- Нуц: + Р-ЛГ → Р-Нуц + ЛГ:
где Р-ЛГ означава супстрат. Електронски пар (:) из нуклеофила (Нуц:) напада супстрат (Р-ЛГ), формирајући нову ковалентну везу Нуц-Р-ЛГ. Претходно стање наелектрисања се враћа када одлазећа група (ЛГ) оде са електронским паром. Главни производ у овом случају је Р-Нуц. У таквим реакцијама, нуклеофил је обично електрично неутралан или негативно наелектрисан, док је супстрат обично неутралан или позитивно наелектрисан.
Пример нуклеофилне супституције је хидролиза алкил бромида, Р-Бр, под базним условима, где је нападачки нуклеофил база ОХ−, а одлазећа група је Бр−:
- Р-Бр + ОХ− → Р-ОХ + Бр−
Реакције нуклеофилне супституције су уобичајене у органској хемији и могу се широко категорисати као да се одвијају на угљенику засићеног алифатичног једињења угљеника или (ређе) у ароматичном или другом незасићеном угљениковом центру.[1]
Механизми[уреди | уреди извор]
Нуклеофилне супституције на алифатичним угљеничним центрима могу се одвијати помоћу два различита механизма, унимолекуларне нуклеофилне супституције (СН1) и бимолекуларне нуклеофилне супституције (СН2).
Механизам СН1 има два корака. У првом кораку, одлазећа група одлази, формирајући карбокатјон C+. У другом кораку, нуклеофилни реагенс (Нуц:) се везује за карбокатион и формира ковалентну сигма везу. Ако супстрат има хирални угљеник, овај механизам може резултирати или инверзијом стереохемије или задржавањем конфигурације. Обично се и једно и друго јавља без преференције. Резултат је рацемизација.
Механизам СН2 има само један корак. Напад реагенса и избацивање групе која одлази се дешавају истовремено. Овај механизам увек резултира инверзијом конфигурације. Ако је супстрат који је под нуклеофилним нападом хиралан, реакција ће стога довести до инверзије његове стереохемије, назване Валденова инверзија.
СН2 напад се може десити ако напад са задњи стране није стерички ометан супституентима на супстрату. Стога се овај механизам обично јавља у неометаном примарном центру угљеника. Ако постоји стерично закрчење на супстрату у близини одлазеће групе, као што је у терцијарном центру угљеника, супституција ће укључивати СН1 а не СН2 механизам; СН1 би такође био вероватнији у овом случају, јер би се могао формирати довољно стабилан карбокациони посредник.
Електрофилна супституција[уреди | уреди извор]
Електрофили учествују у реакцијама електрофилне супституције, а посебно у електрофилним ароматичним супституцијама.[7][8]
| Електрофилна ароматична супституција |
|---|
Електрофилне реакције са другим незасићеним једињењима, осим арена, генерално доводе до електрофилне адиције уместо супституције.
Радикална замена[уреди | уреди извор]
Реакција радикалне супституције укључује радикале.[1] Пример је Хансдикерова реакција.[9][10][11][12][13]
Органометална супституција[уреди | уреди извор]
Реакције купловања су класа реакција катализованих металом које укључују органометално једињење РМ и органски халид Р′X који заједно реагују да би формирали једињење типа Р-Р′ са формирањем нове везе угљеник-угљеник. Примери укључују Хекову реакцију, Улманову реакцију и Вурц-Фитигову реакцију. Постоје многе варијације.[14]
Супституисана једињења[уреди | уреди извор]
Супституисана једињења су хемијска једињења у којима је један или више атома водоника у структури језгра замењено функционалном групом као што је алкил, хидрокси или халоген, или са већим супституентским групама.
На пример, бензен је једноставан ароматични прстен. Бензени који су подвргнути супституцији су хетерогена група хемикалија са широким спектром употребе и својстава:
| Примери супституисаних једињења бензена | ||
| једињење | општа формула | општа структура |
| Бензен | C6Х6 | 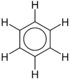 |
| Толуен | C6Х5-ЦХ3 | |
| о-Ксилен | C6Х4(-ЦХ3)2 | 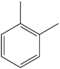 |
| Меситилен | C6Х3(-ЦХ3)3 |  |
| Фенол | C6Х5-ОХ | 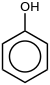 |
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ а б в г Марцх, Јеррy (1985), Адванцед Органиц Цхемистрy: Реацтионс, Мецханисмс, анд Струцтуре (3рд изд.), Неw Yорк: Wилеy, ИСБН 0-471-85472-7
- ^ а б Имyанитов, Наум С. (1993). „Ис Тхис Реацтион а Субститутион, Оxидатион-Редуцтион, ор Трансфер?”. Ј. Цхем. Едуц. 70 (1): 14—16. Бибцоде:1993ЈЦхЕд..70...14И. дои:10.1021/ед070п14.
- ^ Неуманн ЦН, Хоокер ЈМ, Риттер Т (јун 2016). „Цонцертед нуцлеопхилиц ароматиц субститутион wитх (19)Ф(-) анд (18)Ф(-)”. Натуре. 534 (7607): 369—73. ПМЦ 4911285
 . ПМИД 27281221. дои:10.1038/натуре17667.
. ПМИД 27281221. дои:10.1038/натуре17667.
- ^ Рохрбацх С, Смитх АЈ, Панг ЈХ, Пооле DL, Туттле Т, Цхиба С, Мурпхy ЈА (новембар 2019). „Цонцертед Нуцлеопхилиц Ароматиц Субститутион Реацтионс”. Ангеwандте Цхемие. 58 (46): 16368—16388. ПМЦ 6899550
 . ПМИД 30990931. дои:10.1002/ание.201902216.
. ПМИД 30990931. дои:10.1002/ание.201902216.
- ^ Цлаyден, Јонатхан; Греевес, Ницк; Wаррен, Стуарт; Wотхерс, Петер (2001). Органиц Цхемистрy (I изд.). Оxфорд Университy Пресс. ИСБН 978-0-19-850346-0.
- ^ Голдстеин СW, Билл А, Дхугуру Ј, Гхонеим О (септембар 2017). „Нуцлеопхилиц Ароматиц Субститутион Аддитион анд Идентифицатион оф ан Амине.”. Јоурнал оф Цхемицал Едуцатион. 94 (9): 1388—90. Бибцоде:2017ЈЦхЕд..94.1388Г. дои:10.1021/ацс.јцхемед.6б00680.
- ^ Смитх, Мицхаел Б.; Марцх, Јеррy (2007). Адванцед Органиц Цхемистрy: Реацтионс, Мецханисмс, анд Струцтуре (6тх изд.). Неw Yорк: Wилеy-Интерсциенце. ИСБН 0-471-72091-7.
- ^ Гаwлеy, Роберт Е. (1999-06-04). „А пропосал фор (слигхт) модифицатион оф тхе Хугхес–Инголд мецханистиц десцрипторс фор субститутион реацтионс”. Тетрахедрон Леттерс. 40 (23): 4297—4300. ИССН 0040-4039. дои:10.1016/С0040-4039(99)00780-7.
- ^ Ли, Ј. Ј. (2014-01-30). „Хунсдиецкер–Бородин Реацтион”. Наме Реацтионс: А Цоллецтион оф Детаилед Мецханисмс анд Сyнтхетиц Апплицатионс (5тх изд.). Спрингер Сциенце & Бусинесс Медиа. стр. 327—328. ИСБН 9783319039794.
- ^ Бородин, А. (1861). „Уебер Бромвалериансäуре унд Бромбуттерсäуре” [Абоут бромовалериц ацид анд бромобутyриц ацид]. Аннален дер Цхемие унд Пхармацие (на језику: Герман). 119: 121—123. дои:10.1002/јлац.18611190113.
- ^ Бородин, А. (1861). „Уебер де Монобромбалдриансäуре унд Монобромбуттерсäуре” [Абоут тхе монобромовалериц ацид анд монобромобутyриц ацид]. Зеитсцхрифт фüр Цхемие унд Пхармацие (на језику: Герман). 4: 5—7.
- ^ Симонини, А. (1892). „Üбер ден Аббау дер феттен Сäурен зу кохленстоффäрмерен Алкохолен” [Абоут тхе бреакдоwн оф фаттy ацидс то лоwер царбон алцохолс]. Монатсхефте фüр Цхемие унд верwандте Теиле андерер Wиссенсцхафтен (на језику: Герман). 13 (1): 320—325. С2ЦИД 197766447. дои:10.1007/БФ01523646.
- ^ Симонини, А. (1893). „Üбер ден Аббау дер феттен Сäурен зу кохленстоффäрмерен Алкохолен” [Абоут тхе бреакдоwн оф фаттy ацидс то лоwер царбон алцохолс]. Монатсхефте фüр Цхемие унд верwандте Теиле андерер Wиссенсцхафтен (на језику: Герман). 14 (1): 81—92. С2ЦИД 104367588. дои:10.1007/БФ01517859.
- ^ Елсцхенброицх, C.; Салзер, А. (1992). Органометаллицс: А Цонцисе Интродуцтион (2нд изд.). Wеинхеим: Wилеy-ВЦХ. ИСБН 3-527-28165-7.
Литература[уреди | уреди извор]
- Р. А. Росси, Р. Х. де Росси, Ароматиц Субститутион бy тхе СРН1 Мецханисм, АЦС Монограпх Сериес Но. 178, Америцан Цхемицал Социетy, 1983. ISBN 0-8412-0648-1
- L. Г. Wаде, Органиц Цхемистрy, 5тх ед., Прентице Халл, Уппер Саддле Ривер, Неw Јерсеy, 2003.
- С. Р. Хартсхорн, Алипхатиц Нуцлеопхилиц Субститутион, Цамбридге Университy Пресс, Лондон, 1973. ISBN 0-521-09801-7
- Introducing Aliphatic Substitution with a Discovery Experiment Using Competing Electrophiles Timothy P. Curran, Amelia J. Mostovoy, Margaret E. Curran, and Clara Berger Journal of Chemical Education 2016 93 (4), 757-761 . doi:10.1021/acs.jchemed.5b00394. Недостаје или је празан параметар
|title=(помоћ) - N.S.Imyanitov. Electrophilic Bimolecular Substitution as an Alternative to Nucleophilic Monomolecular Substitution in Inorganic and Organic Chemistry. J. Gen. Chem. USSR (Engl. Transl.) 1990; 60 (3); 417-419.
- Unimolecular Nucleophilic Substitution does not Exist / N.S.Imyanitov. SciTecLibrary
- Lenoir, D.; Chiappe, C. (2003). „What is the Nature of the First-Formed Intermediates in the Electrophilic Halogenation of Alkenes, Alkynes, and Allenes?”. Chem. Eur. J. 9 (5): 1036—1044. PMID 12596140. doi:10.1002/chem.200390097.
- Brown, R. S. (1997). „Investigation of the Early Steps in Electrophilic Bromination through the Study of the Reaction with Sterically Encumbered Olefins”. Acc. Chem. Res. 30 (3): 131—137. doi:10.1021/ar960088e.
- Vollhardt, K. Peter C.; Schore, Neil Eric (јануар 2014). Organic chemistry : structure and function (7th изд.). New York, NY. ISBN 978-1-4641-2027-5. OCLC 866584251.
- Fahey, Robert C.; Lee, Do-Jae. (април 1968). „Polar additions to olefins and acetylenes. V. Bimolecular and termolecular mechanisms in the hydrochlorination of acetylenes”. Journal of the American Chemical Society (на језику: енглески). 90 (8): 2124—2131. ISSN 0002-7863. doi:10.1021/ja01010a034.
- Carroll, Felix A. (2010). Perspectives on structure and mechanism in organic chemistry (2nd изд.). Hoboken, N.J.: John Wiley. ISBN 9780470276105. OCLC 286483846.
- Mootz, Dietrich; Deeg, Axel (јул 1992). „2-Butyne and hydrogen chloride cocrystallized: solid-state geometry of Cl-H.cntdot..cntdot..cntdot..pi. hydrogen bonding to the carbon-carbon triple bond”. Journal of the American Chemical Society (на језику: енглески). 114 (14): 5887—5888. ISSN 0002-7863. doi:10.1021/ja00040a077.
- Lowry, Thomas H. (1987). Mechanism and theory in organic chemistry
 . Richardson, Kathleen Schueller. (3rd изд.). New York: Harper & Row. ISBN 978-0060440848. OCLC 14214254.
. Richardson, Kathleen Schueller. (3rd изд.). New York: Harper & Row. ISBN 978-0060440848. OCLC 14214254. - Wang, Z.; Tu, Y.; Frohn, M.; Zhang, J.; Shi, Y. (1997). „An Efficient Catalytic Asymmetric Epoxidation Method”. J. Am. Chem. Soc. 119 (46): 11224—11235. doi:10.1021/ja972272g.
- Davis, F. A.; Kumar, A.; Chen, B. C. (1991). „Chemistry of oxaziridines. 16. A short, highly enantioselective synthesis of the AB-ring segments of γ-rhodomycionone and α-citromycinone using (+)-[(8,8-dimethoxycamphoryl)sulfonyl]oxaziridine”. J. Org. Chem. 56 (3): 1143—1145. doi:10.1021/jo00003a042.
- Uehlin, L.; Wirth, T. (2001). „Novel Polymer-Bound Chiral Selenium Electrophiles”. Org. Lett. 3 (18): 2931—2933. PMID 11529793. doi:10.1021/ol0164435.
- Tjosaas F, Fiksdahl A (фебруар 2006). „A simple synthetic route to methyl 3-fluoropyridine-4-carboxylate by nucleophilic aromatic substitution”. Molecules (Basel, Switzerland). 11 (2): 130—3. PMC 6148553
 . PMID 17962783. doi:10.3390/11020130
. PMID 17962783. doi:10.3390/11020130  .
. - Bella M, Kobbelgaard S, Jørgensen KA (март 2005). „Organocatalytic regio- and asymmetric C-selective S(N)Ar reactions-stereoselective synthesis of optically active spiro-pyrrolidone-3,3'-oxoindoles”. Journal of the American Chemical Society. 127 (11): 3670—1. PMID 15771481. doi:10.1021/ja050200g.
Спољашње везе[уреди | уреди извор]
- „Nucleophiles and Electrophiles”. butane.chem.uiuc.edu. Архивирано из оригинала 01. 08. 2020. г. Приступљено 2020-09-21.
- „Electrophile | chemistry”. Encyclopedia Britannica (на језику: енглески). Приступљено 2020-09-21.
- Aromatic Substitution Reactions – MSU