Закон о одржању масе
Закон о одржању масе представља експериментално утврђену чињеницу да је у хемијским реакцијама маса реактаната једнака маси производа реакције. С обзиром на то да у нуклеарним реакцијама и при великим брзинама (упоредивим са брзином светлости) долази до претварања масе у енергију или обрнуто, може се сматрати специјалним случајем закона о одржању материје.
Увод[уреди | уреди извор]
Површним посматрањем неких процеса у природи (као што су раст дрвета, сагоревање свеће или испаравање воде) може се доћи до убеђења да материја може настати и нестати. Међутим пажљивим посматрањем може се утврдити да ово није случај. Материја може да промени свој облик, агрегатно стање и сл. али не може настати ни из чега или нестати.
А. L. Лавоазије (Lavoisier) је 1774. у експерименту у коме је загревао калај са ваздухом у затвореном суду приметио да је тежина целог система иста пре и после калцинације. Овим је доказано да систем није добио ни изгубио на тежини. Овај експеримент је указао на чињеницу да нема пре и после реакције нема промене количине материје.
Како је Ломоносов формулисао сличну правилност нешто раније (1748. или 1756), закон се понекад зове и Лавоазје-Ломоносовљев закон.
Овај закон може да се дефинише:
Укупна маса супстанци које улазе у реакцију једнака је укупној маси производа реакције. Ако А и Б представљају масе двеју супстанци које учествују у некој хемијској реакцији при којој настају масе C и D других двеју (хемијски промењених) супстанци, закон о одржању масе се може изразити као:
A+B = C+D
Овај закон се понекада и назива закон о неуништивости материје.
Експериментална потврда[уреди | уреди извор]
Х. Ландолт (1893) и А. Хеyдwеиллер (1901) су извршили експерименте да би потврдили тачност овог закона. Из ових експеримената су закључили да постоји мало одступање у укупним масама али да су наведена одступања у оквиру експерименталне грешке.
Ј. Ј. Малеy је 1912. године употребио вагу која је била знатно усавршена да би се отклонио недостатак горе наведених експеримената. Он је успео да докаже да у случају реакције између баријумхлорида и натријумсулфата, свака промена у маси мора бити мања од једног милионитог дела.
Маса – енергија конверзија[уреди | уреди извор]
Када се говори о овом закону мора се приметити да према теорији релативитета материја (као облик енергије) и енергија могу прелазити једна у другу, у међусобном односу који је дефинисан познатом Ајнштајновом једначином:
E = mc2
где је
E - ослобођена или апсорбована енергија
m - губитак или добитак масе
c – брзина светлости
Другим речима, уместо два фундаментална закона: закона о одржању масе и закона о држању енергије, постоји само један принцип.
При било којој хемијској промени која је праћена променом температуре, вршиће се и одговарајућа промена масе. То значи да се при хемијској промени врши промена масе, али ако се узме у обзир висока вредност c, губитак масе изузетно низак и према таме закон о одржању масе као што је горе наведен може се узети као тачан за сва експериментална мерења.
Формулација и примери[уреди | уреди извор]
Закон одржања масе може се формулисати само у класичној механици када су енергетске скале повезане са изолованим системом много мање од , где је маса типичног објекта у систему, мерена у референтном оквиру где објекат мирује, а је брзина светлости.
Закон се може математички формулисати у областима механике флуида и механике континуума, где се очување масе обично изражава помоћу једначине континуитета, дате у диференцијалном облику као
где је густина (маса по јединици запремине), је време, је дивергенција, и је поље брзине протока. Тумачење једначине континуитета за масу је следеће: За дату затворену површину у систему, временска промена масе затворене површином једнака је маси која прелази преко површине, позитивна ако материја улази и негативна ако материја се излази. За цео изоловани систем, овај услов подразумева да се укупна маса , збир маса свих компоненти у систему, не мења у времену, и.е.
,
где је диференцијал који дефинише интеграл преко целог времена система.
Једначина континуитета за масу је део Ојлерових једначина динамике флуида. Многе друге једначине конвекције-дифузије описују очување и проток масе и материје у датом систему.
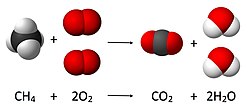
У хемији, израчунавање количине реактаната и производа у хемијској реакцији, или стехиометрија, заснива се на принципу очувања масе. Принцип подразумева да је током хемијске реакције укупна маса реактаната једнака укупној маси производа. На пример, у следећој реакцији
- ЦХ
4 + 2 О
2 → ЦО
2 + 2 Х
2О,
где се један молекул метана (ЦХ
4) и два молекула кисеоника О
2 претварају у један молекул угљен-диоксида (ЦО
2) и два молекула воде (Х
2О). Број молекула каји је резултат реакције може се извести из принципа очувања масе, пошто су у почетку присутна четири атома водоника, 4 атома кисеоника и један атом угљеника (као и у коначном стању), затим број молекула произведене воде мора бити тачно два по произведеном молекулу угљен-диоксида.
Историја[уреди | уреди извор]


Још 520. године пре нове ере, џаинска филозофија, некреационистичка филозофија заснована на учењу Махавире,[4] наводи да се универзум и његови састојци као што је материја не могу уништити или створити. Џаински текст Татвартасутра (2. век нове ере) наводи да је супстанца трајна, али њене модове карактерише стварање и уништавање.[5]
Важна идеја у античкој грчкој филозофији била је да „Ништа не долази из ничега“, тако да је оно што сада постоји увек постојало: ниједна нова материја не може настати тамо где је раније није било. Експлицитна изјава овога, заједно са даљим принципом да ништа не може прећи у ништа, налази се код Емпедокла (око 4. века пре нове ере): „Немогуће је да било шта настане из онога што није, и не може бити изведено или тврђено да оно што јесте може бити потпуно уништено.“[6]
Даљи принцип очувања изнео је Епикур око 3. века пре нове ере, који је, описујући природу универзума, написао да је „свеукупност ствари увек била таква каква је сада, и увек ће бити“.[7]
Принцип очувања материје такође је навео Хаџе Насирудин Туси (око 13. века нове ере). Он је написао да „тело материје не може потпуно нестати. Оно само мења свој облик, стање, састав, боју и друга својства и претвара се у другу сложену или елементарну материју”.[8]
Открића у хемији[уреди | уреди извор]
До 18. века принцип очувања масе током хемијских реакција био је нашироко коришћен и био је важна претпоставка током експеримената, чак и пре него што је дефиниција формално успостављена,[9] као што се може видети у радовима Џозефа Блека, Хенрија Кевендиша и Жана Реја.[10] Први који је изложио принцип био је Михаил Ломоносов 1756. Он је то успео да демонстрира експериментима и водио је дискусије о принципу 1748. у преписци са Леонардом Ојлером,[11] иако се његов допринос у овој области понекад оспорава.[12][13] Према речима совјетског физичара Јакова Дорфмана:
Универзални закон који је Ломоносов формулисао на основу општих филозофско-материјалистичких разматрања, он никада није доводио у питање, нити проверавао, већ му је, напротив, служио као солидна полазна позиција у свим истраживањима током његовог живота.[14]
Рафиниранију серију експеримената је касније извео Антоан Лавоазје који је свој закључак изнео 1773. и популаризовао принцип очувања масе. Демонстрације принципа су оповргле тада популарну теорију флогистона која је тврдила да се маса може добити или изгубити у процесима сагоревања и размене топлоте.
Пратећи пионирски рад Лавоазјеа, исцрпни експерименти Жана Стаса подржали су доследност овог закона у хемијским реакцијама,[15] иако су спроведени са другим намерама. Његово истраживање[16][17] је показало да у одређеним реакцијама губитак или добитак није могао бити већи од 2 до 4 дела на 100.000.[18] Разлика у прецизности коју је имао за циљ и остварио Лавоазије, с једне стране, и Морли и Стас, с друге стране, огромна је.[19]
Референце[уреди | уреди извор]
- ^ Волкенстеин, Микхаил V. (2009). Ентропy анд Информатион (иллустратед изд.). Спрингер Сциенце & Бусинесс Медиа. стр. 20. ИСБН 978-3-0346-0078-1. Еxтрацт оф паге 20
- ^ Окуň, Лев Борисович (2009). Енергy анд Масс ин Релативитy Тхеорy. Wорлд Сциентифиц. стр. 253. ИСБН 978-981-281-412-8. Еxтрацт оф паге 253
- ^ Леwис, Давид (2012). Еарлy Руссиан Органиц Цхемистс анд Тхеир Легацy (иллустратед изд.). Спрингер Сциенце & Бусинесс Медиа. стр. 29. ИСБН 978-3-642-28219-5. Еxтрацт оф паге 29
- ^ Махавира ис датед 598 БЦ - 526 БЦ. Сее. Дундас, Паул; Јохн Хиннелс (2002). Тхе Јаинс. Лондон: Роутледге. ИСБН 978-0-415-26606-2. п. 24
- ^ Девендра (Муни.), Т. Г. Калгхатги, Т. С. Девадосс (1983) А соурце-боок ин Јаина пхилосопхy Удаипур:Сри Тарак Гуру Јаин Гран. п.57. Алсо сее Таттвартхасутра версес 5.29 анд 5.37
- ^ Фр. 12; сее пп.291–2 оф Кирк, Г. С.; Ј. Е. Равен; Малцолм Сцхофиелд (1983). Тхе Пресоцратиц Пхилосопхерс (2 изд.). Цамбридге: Цамбридге Университy Пресс. ИСБН 978-0-521-27455-5.
- ^ Лонг, А. А.; D. Н. Седлеy (1987). „Епицуреанисм: Тхе принципалс оф цонсерватион”. Тхе Хелленистиц Пхилосопхерс. Вол 1: Транслатионс оф тхе принципал соурцес wитх пхилосопхицал цомментарy. Цамбридге: Цамбридге Университy Пресс. стр. 25—26. ИСБН 978-0-521-27556-9.
- ^ Фарид Алакбаров (Суммер 2001). А 13тх-Центурy Дарwин? Туси'с Виеwс он Еволутион, Азербаијан Интернатионал 9 (2).
- ^ Wхитакер, Роберт D. (1975-10-01). „Ан хисторицал ноте он тхе цонсерватион оф масс”. Јоурнал оф Цхемицал Едуцатион. 52 (10): 658. Бибцоде:1975ЈЦхЕд..52..658W. ИССН 0021-9584. дои:10.1021/ед052п658.
- ^ Роберт D. Wхитакер, "Ан Хисторицал Ноте он тхе Цонсерватион оф Масс", Јоурнал оф Цхемицал Едуцатион, 52, 10, 658-659, Оцт 75
- ^ Писмен, Лен (2018). Тхе Сwингс оф Сциенце: Фром Цомплеxитy то Симплицитy анд Бацк. Спрингер. стр. 41. ИСБН 978-3-319-99777-3.
- ^ Помпер, Пхилип (октобар 1962). „Ломоносов анд тхе Дисцоверy оф тхе Лаw оф тхе Цонсерватион оф Маттер ин Цхемицал Трансформатионс”. Амбиx. 10 (3): 119—127. дои:10.1179/амб.1962.10.3.119.
- ^ Ломоносов, Микхаил Васил’евицх (1970). Микхаил Васил'евицх Ломоносов он тхе Цорпусцулар Тхеорy. Хенрy M. Леицестер (транс.). Цамбридге, Масс.: Харвард Университy Пресс. Интродуцтион, п. 25.
- ^ Дорфман, Яков (1961). Закон сохранения массы при химических реакциях и физические воззрения Ломоносова // Ломоносов М.В. Сборник статей и материалов, Т.5. http://gidropraktikum.narod.ru/Lomonosov-Dorfman.djvu: М.-Л.: Издательство АН СССР. стр. 193.
- ^ Маттхеw Монцриефф Паттисон Муир, Тхе Елементс оф Цхемистрy (1904)
- ^ Ноув. Рецхерцхес сур лес лоис дес пропортионс цхимиqуес (1865) 152, 171, 189
- ^ "Цонсерватион оф Масс ин Цхемицал Цхангес"Јоурнал - Цхемицал Социетy, Лондон, Вол.64, Парт 2 Цхемицал Социетy (Греат Бритаин)
- ^ Wиллиам Едwардс Хендерсон, А Цоурсе ин Генерал Цхемистрy (1921)
- ^ Ида Фреунд, Тхе студy оф Цхемицал Цомпоситион: ан аццоунт оф итс метход анд хисторицал девелопмент, wитх иллустративе qуотатионс (1904)
Литература[уреди | уреди извор]
- Молерова модерна неорганска хемија, поправљено издање Г. D. Паркерса, четрвто неизмењено издање, Научна књига, Београд 197
- Силагадзе, З. К. (2008), „Релативитy wитхоут теарс”, Ацта Пхyсица Полоница Б, 39 (4): 811—885, Бибцоде:2008АцППБ..39..811С
 , арXив:0708.0929
, арXив:0708.0929 
- Оас, Гарy (2005), „Он тхе Абусе анд Усе оф Релативистиц Масс”, арXив:пхyсицс/0504110

- Маx Јаммер (1997), Цонцептс оф Масс ин Цлассицал анд Модерн Пхyсицс, Цоуриер Довер Публицатионс, стр. 177—178, ИСБН 978-0-486-29998-3
Спољашње везе[уреди | уреди извор]
- Усенет Пхyсицс ФАQ
- "Доес масс цханге wитх велоцитy?" бy Пхилип Гиббс ет ал., 2002, ретриевед Аугуст 10, 2006
- "Wхат ис тхе масс оф а пхотон?" бy Матт Аустерн ет ал., 1998, ретриевед Јуне 27, 2007
- Масс ас а Вариабле Qуантитy Архивирано на сајту Wayback Machine (16. јул 2015)











