Enzim

| Biohemija |
|---|
 |
| Ključne komponente |
| Istorija i teme |
| Portali: Biologija, Hemija, MCB |
Enzim ili ferment je biološki katalizator, tj ima moć da utiče na brzinu hemijske reakcije.[1][2]
Enzimi su neophodni kako bi život bio moguć, jer mnoge reakcije koje se odvijaju u ćelijama organizma su previše spore i vodile bi do drugačijih produkata koje organizmu ili nisu potrebni ili bi mu štetili. Kvar, genetičke mutacije, nedovoljna ili povećana proizvodnja, jednog jedinog enzima može da bude bude glavni uzrok teških genetičkih poremećaja. Na primer, poremećaj fenilketonurija je rezultat nedostatka enzima fenilalanin hidroksilaza, koji katalizuje prvi korak u razlaganju amino kiseline fenilalanina. Ako ovaj enzim ne funkcioniše kako treba, i ne razloži amino kiselinu, neograničena proizvodnja fenilalanina vodi do mentalne retardacije. Pored fenilketonurije postoji još čitav niz oboljenja, zajednički nazvanih enzimopatije, čiji je uzrok mutacija gena, a posledica nedostatak nekog enzima.

Kao i svi katalizatori enzimi funkcionišu tako što snižavaju aktivacionu energiju reakcije, i na taj način je ubrzavaju. Enzimi mogu da ubrzaju reakcije na nivou od po nekoliko miliona puta. Enzim, kao svaki katalizator, ostaje nepromenjen reakcijom na koju utiče i to mu omogućava da, kad se jedna reakcija završi, uključi u drugu, potpuno nepromenjen. Takođe enzimi ne utiču na relativnu energiju između reagenata i produkata, tako da ne utiču na ekvilibrijum reakcije. Međutim, ono što enzim odvaja od svih ostalih katalizatora je njihova specifičnost u pogledu stereohemije, hemijske selektivnosti i specifičnosti.
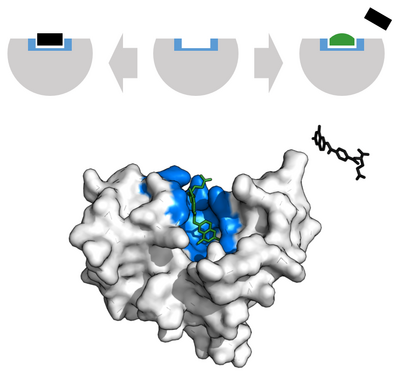
Osnovna ideja enzima je ta da se na enzim povežu molekuli reakcije na koju enzim deluje, stvori se kompleks sastavljen od enzima i molekula koji nije dugoročan, i iz tog kompleksa, odnosno te interakcije, imamo proizvod te reakcije, dok enzim ostaje potpuno nepromenjen reakcijom. Ovo je prikazano grafički:
Enzimi se takođe svakodnevno koriste u produktima kao što su deterdženti za sudove, veš, i razne druge kućne hemikalije.
Danas je poznato više od 5.000 enzima. Nomenklatura enzima nam pomaže pri imenovanju ovog velikog broja enzima, i po njoj enzimima se daje ime koje se završava sa -za, a prefiks je hemijska supstanca koja transformiše, odnosno na koju enzim utiče. Na primer, enzima koji ima ulogu u DNK replikaciji i koji vrši reakciju polimerizacije molekula DNK se naziva DNK polimeraza.
Istorija[uredi | uredi izvor]

Termin enzim je poreklom iz grčkog jezika ένζυμο i znači zakiseliti. Krajem 1700. i početkom 1800, naučnici su primetili reakcije koje nastaju varenjem mesa pomoću žučnih kiselina i reakcije koje prate konverzaciju dekstrina u šećer.
Proučavanjem fermentacije šećera u alkohol pomoću kvasca, Luj Paster je došao do zaključka da je fermentacija moguća usled postojanja fermenata u kvascu, za koje je mislio da su prisutne samo u živim organizmima.
Godine 1897, Hans i Eduard Buhner su koristili ekstrakte kvasca kako bi fermentisali šećer bez prisustva živih ćelija kvasca. Oni su bili zainteresovani u pravljenje ekstrakata kvasca u medicinske svrhe, i jedan od načina čuvanja, je bio dodavanje velike količine šećera u ekstrakte. Na njihovo iznenađenje, otkrili su da je šećer fermentisan, iako u celoj smesi nije bilo prisutnih živih ćelija kvasca. Termin enzim je korišćen tad prvi put i opisuje supstancu u ekstraktu kvasca koji je doveo do fermentacije šećera.
3-D Struktura[uredi | uredi izvor]
Dugo se smatralo da su svi enzimi po hemijskom sastavu proteini. Međutim, kao što u biohemiji često biva, imamo izuzetak u vidu nekoliko vrsta ribonukleinskih kiselina (RNK) koje se specifično nazivaju ribozimi. Smatra se da su RNK verovatno bile i prvi katalizatori u evoluciji žive materije.
Što se proteinskih enzima tiče, a oni čine veliku većinu enzima u ljudskom telu, njihova funkcija je kao i kod drugih proteina, određena strukturom. Enzim može biti:
- Monomeričan, što znači da sadrži samo jedan polipeptidni lanac, obično od sto ili više amino kiselina
- Oligomeričan, odnosno sadrži veći broj polipeptidnih lanaca, koji mogu biti ili identični ili da se razlikuju, ali koji funkcionišu zajedno kao jedna jedinica.
Kao i svaki protein, monomer je jedan dugačak linearan lanac amino kiselina, koji se savija i povija na određeni način i za produkat ima trodimenzionalnu strukturu.
Većina enzima su obično veći molekuli od onih molekula na koje deluju, i svega desetak amino kiselina enzima dođe u direktan kontakt sa molekulom koji biva transformisan. Region u kojem dolazi do tog direktnog kontakta enzima i molekula se naziva Aktivni region. Veći broj enzima takođe ima dodatne regione za kofaktore koji su potrebni pri katalizaciji reakcije. Kontakti između molekula na koji se deluje i postojećih kofaktora ubrzava ili usporava aktivnost enzima po potrebi.
Specifičnost[uredi | uredi izvor]
Enzimi su uglavnom veoma specifični kad su u pitanju reakcije koje upotrebljavaju sa molekulima na koje deluju. Oblik, forma, struktura, naelektrisanje, hidrofilni i hidrofobni karakter enzima kao i molekula utiču na ovu specifičnost.
Hipoteza ključa i brave[uredi | uredi izvor]

Najuočljivija karakteristika enzima je njihova specifičnost. Emil Fišer je 1890. godine konstatovao da je ova hipoteza korektna usled specifičnosti oblika enzima i molekula na koje oni deluju. Svaki molekul na koji određeni enzim utiče, ima tačno određeni oblik, pomoću kojeg se molekule poveže na tačno određeni enzim. Na primer, ako je molekul na koji enzim utiče u obliku kocke, a sam enzim ima region u obliku trougla na koji molekul treba da se nadoveže, do povezivanja neće doći, jer u tom slučaju enzim nije korektan za taj molekul. Ova hipoteza se zato i naziva hipoteza ključa i brave, jer je svaki ključ specifičan za svaku bravu koju otključava. Ovaj model je danas u velikoj meri napušten zbog rigidnosti s kojom posmatra enzim i supstrat, kao i usled nemogućnosti da se njime objasne alosterizacija i enzimska kooperativnost.
Hipoteza Indukovanog prilagođavanja[uredi | uredi izvor]

1958. Danijel Košland je predložio modifikaciju hipoteze Ključ i brava koja je nazvana hipoteza Indukovanog prilagođavanja (eng. Induced-Fit-Model). Enzimi su veoma fleksibilne strukture. Aktivni region enzima može biti modifikovan kako bi došlo do interakcije molekula i enzima. Lanci amino kiselina se mogu preklapati na taj način koji bi odgovarao enzimu, kako bi došlo do interakcije, i na taj način enzim mogao da izvrši svoju katalitičku funkciju. U veoma retkim slučajevima, molekuli pri ulasku u Aktivni region mogu da se prilagode enzimu, kako bi došlo do interakcije enzima i molekula. Analogija slična ovoj je na primer kada oblačimo rukavicu, i kako se rukavica prilagođava našoj ruci, kako bi se savršeno prilagodila ruci.
Kofaktori[uredi | uredi izvor]

Neki enzimi su kao samostalne jedinice same sebi dovoljne da bi bile potpuno aktivne, tj. nisu im potrebni dodatni faktori da bi se ta aktivnost postigla. Međutim, nekim enzimima su potrebni molekuli koji bi pomogli pri aktiviranju enzima, i ti molekuli se zove kofaktori. Kofaktori mogu biti neorganskog porekla, kao na primer joni metala, ili mogu da imaju organsko poreklo, i kao takvi se nazivaju koenzimi.
Enzimi kojima su potrebni kofaktori, a trenutno ih nemaju se nazivaju apoenzimi. Enzim koji je povezan sa svojim kofaktorom, naziva se holoenzim, i taj oblik predstavlja aktivni oblik enzima. Većina kofaktora nije kovalentno povezana sa enzimima, ali ima i onih koji su kovalentnim vezama povezani za enzim, i kao takvi, kofaktori se nazivaju prostetična grupa npr. kofaktor hem je povezan kovalentnom vezom za hemoglobin.
Većina kofaktora su ili regenerisani ili hemijski nepromenjeni tokom i posle reakcije u kojoj učestvuju. Veliki broj kofaktora su derivati vitamina i služe kao transportna tela za transport elektrona, atoma ili funkcionalnih grupa, od enzima ka molekulu. Najčešći primeri su NAD i NADP, koji su transportna tela za elektrone, i Koenzim A, koji je transportno telo za acetilnu grupu.
Termodinamika[uredi | uredi izvor]

Kao sa svim katalizatorima, sve reakcije na koje utiče enzim, tj. koje su katalizatorskog tipa, moraju biti spontante, odnosno vrednost Gibsove slobodne energije mora biti negativna. Bez enzima reakcije se kreću u istom pravcu kao i sa enzimom, ali mnogo manjom brzinom, gde dolazi uloga enzima, a to je ubrzanje brzine reakcije. Međutim, nekatalizirane spontane reakcije mogu dovesti do drugačijih produkata od kataliziranih reakcija, tj. od reakcija u kojima su prisutni enzimi. Takođe enzimi mogu da utiču na više reakcija istovremeno, tako da ona reakcija koja je sa termodinamičke tačke gledišta bolja, tj. ima veće šanse da bude realizovana, može da povuče sa sobom onu reakciju koja nije, i na taj način obe reakcije su realizovane. Na primer, cepanje jedinjenja koje poseduje veoma veliku energiju ATP (Adenozin-tri-fosfat) je sa termodinamičke tačke gledišta uspešna reakcija, i ona zauzvrat pomaže reakcijama koje nisu, a na koje istovremeno deluje isti enzim kao i na cepanje ATP reakcije.
Enzimi katalizuju reakcije u oba smera jednako. Enzimi nikad ne menjaju ekvilibrijum reakcije, već samo brzinu koja dovodi do stvaranja tog ekvilibrijuma, tj. ravnoteže.
Kinetika[uredi | uredi izvor]
Godine 1913. Leonor Mikelis i Maud Menten su predstavili kvantitativnu teoriju kinetike enzima, koja je danas poznata pod imenom Mikelis-Mentenina teorija kinetike.[3] Njihov rad je dalje usavršio G. E. Brigs i Dž. B. S. Halden, koji su razradili veliki broj kinetičkih jednačina koje se i danas koriste.[4]
Enzimi mogu da izvedu i do nekoliko miliona reakcije u jednoj sekundi. Da bi se utvrdila maksimalna brzina reakcije, koncentracija molekula na koji enzim deluje se uvećava sve dok se ne dostigne konstantna rata proizvodnje, odnosno formacije hemijskih produkata. Ovo je maksimalna brzina enzima Vmax. U ovom koraku, svi regioni enzima su u interakciji sa molekulom, odnosno velikim brojem istih molekula na koje enzim deluje. Vmax je jedna od kinetičkih parametara za koji su biohemičari zainteresovani. Takođe od interesa je rata, odnosno stopa reakcije, a to je određeno količinom molekula na koji enzima deluje.
Ovaj parametar, koncentracija molekula se označava Mikelis-Menten konstantom Km), i ta konstanta predstavlja koncentraciju molekula kako bi enzim dostigao polovinu svoje maksimalne brzine. Svaki enzim ima karakterističnu konstantu Km za dati, odnosno određeni molekul.
Efikasnost enzima može biti predstavljena kcat/Km. Parametar kcat se takođe naziva proizvodni broj, koji uzima u obzir sve korake reakcije, i količnik je Vmax kao i krajnje sveukupne koncentracije enzima. kcat/Km je koristan parametar pri komparaciji, odnosno upoređivanju jednog enzima naspram drugog, ili jednog enzima naspram svog molekula, jer se uzimaju u obzir i afinitet kao katalitička sposobnost. Teorijski maksimum za kcat/Km ze naziva difuzijski limit, tj. ograničenje rasprostranjenosti, i ono je između 108 to 109 (M−1 s−1). U ovom koraku, tj. u ovom momentu, svaki sudar, tj. svaki kontakt enzima sa svojim molekulom će imati za rezultat katalizu i brzina formiranja produkata nije ograničena brzinom reakcije, već ograničenjem rasprostranjenosti, tj. difuzijskim limitom. Enzimi koji dostignu kcat/Km vrednost se nazivaju katalitički savršenim ili kinetički savršenim. Primeri takvih enzima su trio-fosfatna izomeraza, ugljenikova anhidraza, fumaraza, acetilholinesteraza.
Brzina enzimskih reakcija zavisi od uslova rastvora i koncentracije supstrata. Da bi se odredila maksimalna brzina enzimatske reakcije, koncentracija supstrata se povećava dok se ne dostigne konstantna brzina formiranja produkta. To je prikazano krivom zasićenja. Do zasićenja dolazi zato što sa povećanjem koncentracije supstrata, sve više i više slobodnog enzima biva konvertovano u ES (enzim - supstrat) kompleks. Pri maksimalnoj enzimskoj brzini reakcije (Vmax), sva aktivna mesta enzima su vezana za supstrat, i količina ES kompleksa je jednaka totalnoj količini enzima.[5]:8.4
Inhibicija[uredi | uredi izvor]
Brzine enzimskih reakcija se mogu umanjiti dejstvom različitih tipova enzimskih inhibitora.[6]:73–74
Tipovi inhibicije[uredi | uredi izvor]
- Kompetitivni
- Kompetitivni inhibitor i supstrat ne mogu da se istovremeno vežu za enzim.[7] Kompetitivni inhibitori su često veoma slični stvarnom enzimskom substratu. Na primer, lek metotreksat je kompetitivni inhibitor enzima dihidrofolatna reduktaza, koji katalizuje redukciju dihidrofolata do tetrahidrofolata. Sličnost između struktura dihidrofolata i tog leka je prikazana na slici. Ovaj tip inhibicije se može prevazići primenom visokih koncentracija supstrata. U nekim slučajema, inhibitor se može vezati za različito mesto od mesta vezivanja supstrata i time izvršiti alosterni uticaj kojim se menja oblik uobičajenog mesta vezivanja.
- Nekompetitivni
- Nekompetitivni inhibitor se vezuje na različito mesto od mesta vezivanja supstrata. Substrat se još uvek vezuje sa svojim uobičajenim afinitetom i stoga Km ostaje isti. Međutim inhibitor redukuje katalitičku efikasnost enzima tako da se Vmax smanjuje. U kontrastu sa kompetitivnom inhibicijom, nekompetitivna inhibicija se ne može prevazići visokom koncentracijom supstrata.[6]:76–78
- Beskompetitivni
- Beskompetitivni inhibitor se ne može vezati za slobodni enzim, nego samo za kompleks enzima i supstrata. Iz tog razloga ovaj tip inhibitora je najefektivniji pri visokom koncentracijama supstrata. U prisustvu inhibitora, kompleks enzima i supstrata je neaktivan.[6]:78 Ova vrsta inhibicije je retka.[8]
- Mešoviti
- Mešoviti inhibitori se vezuju za alosterno mesto, i vezivanje supstrata i inhibitora utiče jedno na drugo. Enzimska funkcija biva redukovana ali se ne eliminiše vezivanjem inhibitora. Ovaj tip inhibitora ne sledi Mihaelis-Menteninu jednačinu.[6]:76–78
- Ireverzibilni
- Ireverzibilni inhibitor permanentno inaktivira enzim, obično putem formiranja kovalentne veze sa proteinom. Penicilin[9] i aspirin[10] su lekovi u širokoj upotrebi koji deluju na takav način.
Funkcije inhibitora[uredi | uredi izvor]
U mnogim organizmima, inhibitori mogu da deluju kao komponenta povratnog mehanizma. Ako enzim proizvodi preveliku količinu jedne supstance u organizmu, ta supstanca može da deluje kao inhibitor enzima na početku puta kojim se ona formira, uzrokujući usporavanje produkcije supstance, ili zaustavljanje procesa kad je supstanca prisutna u dovoljnoj količini. Ovo je oblik negativne povratne sprege. Glavni metabolički putevi, kao što je ciklus limunske kiseline, koriste ovaj mehanizam.[5]:17.2.2
Pošto inhibitori moduliraju funkciju enzima, oni se često koriste kao lekovi. Mnogi takvi lekovi su reverzibilni kompetitivni inhibitori koji strukturno podsećaju na prirodni supstrat enzima, poput metotreksata. Drugi dobro poznati primeri su statini, koji se koriste za tretiranje visokih nivoa holesterola,[11] i proteazni inhibitori koji se koriste u tretmanu retroviralnih infekcija, kao što je HIV.[12] Poznati primer ireverzibilnog inhibitora koji se koristi kao lek je aspirin, koji inhibira enzime COX-1 i COX-2 koji proizvode inflamacionog glasnika, prostaglandina.[10] Inhibitori enzima mogu da budu otrovi. Na primer, otrov cijanid je ireverzibilni enzimski inhibitor koji se kombinuje sa bakrom i gvožđem u aktivnom mestu enzima citohrom c oksidaza i blokira ćelijsko disanje.[13]
Nomenklatura enzima[uredi | uredi izvor]
Prema konvenciji, ime enzima se sastoji od naziva radnje koju obavlja, i sufiksa - aza. Na primer, imamo enzim koji se zove DNK polimeraza. Iz ovoga možemo da zaključimo da enzim vrši polimerizaciju DNK molekula, i enzim se završava sa sufiksom -aza. Drugi primer, imamo enzim Alkohol dehidrogenaza, za kojeg možemo da zaključimo da vrši dehidrogenizaciju alkohola i enzim se opet završava sa - aza.
Kinaze su enzimi koji učestvuju u transferu fosfatnih grupa. U ovom slučaju takvih enzima ima jako puno, što bi dovelo do konfuzije jer bi se pojavilo puno enzima za istom funkcijom. U ovom slučaju, pored gorenavedenih primera davanja imena, dodaju su karakteristike specifične za dati enzim, kao na primer optimalna pH vrednost (primer ovakvog enzima je enzim Alkalna fosfataza).
Međunarodna Unija Biohemije i Molekularne Biologije je razvila nomenklaturu po kojoj se enzimi nazivaju. Svaki enzim sadrži u imenu (latinica ES broj) EC broj (komisacioni broj enzima, ili na engleskom Enzyme Commission number) i red od četiri broja. Radi objašnjavanja svi pojmovi u davanju imena enzima će u daljem tekstu biti pisana latinicom po pravilu nomenklature.
Dakle, prvi (od četiri broja) naširoko klasifikuje enzim na osnovu mehanizma:
| Grupa | Katalizovana reakcija | Tipična reakcija | Primer enzimi |
| EC 1 Oksidoreduktaze |
katalizuju oksido-redukcione reakcije; vrše transfer vodonikovih i kiseonikovih atoma sa jednog molekula na drugi | AH + B → A + BH (redukovana) A + O → AO (oksidovana) |
Dehidrogenaza, Oksidaza |
| EC 2 Transferaze |
vrše transfer funkcionalnih grupa (npr. transfer metil grupe ili fosfatne grupe) | AB + C → A + BC | Kinaze |
| EC 3 Hidrolaze |
katalizuju hidrolitične reakcije | AB + H2O → AOH + BH | Lipaza, Amilaza, Peptidaza |
| EC 4 Lijaze |
cepaju ili kidaju razliite hemijske veze (izuzeci su hidrolitične i oksidativne reakcije, jer su ti enzimi tih reakcije već pomenuti u gornjim grupama). C-C, C-N, C-O ili C-S veze se kidaju | RCOCOOH → RCOH + CO2 | |
| EC 5 Izomeraze |
katalizuju reakcije izomerizacije u pojedinačnom molekulu | AB → BA | Izomeraza |
| EC 6 Ligaze |
spajaju molekule sa kovalentnim vezama: C-O, C-S, C-N i C-C | X + Y+ ATP → XY + ADP + Pi | DNK Ligaza |
Za kompletnu listu enzima po gorenavedenoj nomenklaturi, videti sledeću stranicu [1]
Upotreba enzima[uredi | uredi izvor]
Enzimi su neophodni u svakodnevnom životu, od funkcionisanje organizma do svakodnevnih kućnih poslova.
- Enzim Proteaza se dobija iz bakterija, a koristi se u supstancama kao što je deterdžent. Enzim pomaže u uklanjanju mrlja sa tkanina i odeće.
- Enzim Amiloglukosidaza se koristi pri proizvodnji piva, jer se pomoću ovog enzima proizvodi nisko kalorično pivo.
- Enzim Lipaza je našao upotrebu u prehrambenoj industriji i koristi se veoma puno pri pravljenju Buđavog sira.
Reference[uredi | uredi izvor]
- ^ Smith 1997.
- ^ Grisham & Garrett 1999, str. 426–427.
- ^ Michaelis L, Menten M (1913). „Die Kinetik der Invertinwirkung” [The Kinetics of Invertase Action] (PDF). Biochem. Z. (na jeziku: German). 49: 333—369. doi:10.1021/bi201284u.; Michaelis L, Menten ML, Johnson KA, Goody RS (2011). „The original Michaelis constant: translation of the 1913 Michaelis-Menten paper”. Biochemistry. 50 (39): 8264—9. PMC 3381512
 . PMID 21888353. doi:10.1021/bi201284u.
. PMID 21888353. doi:10.1021/bi201284u.
- ^ Briggs GE, Haldane JB (1925). „A Note on the Kinetics of Enzyme Action”. The Biochemical Journal. 19 (2): 339—339. PMC 1259181
 . PMID 16743508.
. PMID 16743508.
- ^ a b Stryer L, Berg JM, Tymoczko JL (2002). Biochemistry (5th izd.). San Francisco: W.H. Freeman. ISBN 978-0-7167-4955-4.
- ^ a b v g Cornish-Bowden A (2004). Fundamentals of Enzyme Kinetics (3 izd.). London: Portland Press. ISBN 978-1-85578-158-0.
- ^ Price NC (1979). „What is meant by 'competitive inhibition'?”. Trends in Biochemical Sciences. 4 (11): N272—N273. doi:10.1016/0968-0004(79)90205-6.
- ^ Cornish-Bowden A (1986). „Why is uncompetitive inhibition so rare? A possible explanation, with implications for the design of drugs and pesticides”. FEBS Letters. 203 (1): 3—6. PMID 3720956. doi:10.1016/0014-5793(86)81424-7.
- ^ Fisher JF, Meroueh SO, Mobashery S (2005). „Bacterial resistance to beta-lactam antibiotics: compelling opportunism, compelling opportunity”. Chemical Reviews. 105 (2): 395—424. PMID 15700950. doi:10.1021/cr030102i.
- ^ a b Johnson DS, Weerapana E, Cravatt BF (2010). „Strategies for discovering and derisking covalent, irreversible enzyme inhibitors”. Future Medicinal Chemistry. 2 (6): 949—64. PMID 20640225. doi:10.4155/fmc.10.21.
- ^ Endo A (1. 11. 1992). „The discovery and development of HMG-CoA reductase inhibitors” (PDF). J. Lipid Res. 33 (11): 1569—82. PMID 1464741.
- ^ Wlodawer A, Vondrasek J (1998). „Inhibitors of HIV-1 protease: a major success of structure-assisted drug design”. Annual Review of Biophysics and Biomolecular Structure. 27: 249—84. PMID 9646869. doi:10.1146/annurev.biophys.27.1.249.
- ^ Yoshikawa S, Caughey WS (1990). „Infrared evidence of cyanide binding to iron and copper sites in bovine heart cytochrome c oxidase. Implications regarding oxygen reduction”. The Journal of Biological Chemistry. 265 (14): 7945—58. PMID 2159465.
Literatura[uredi | uredi izvor]
- Cornish-Bowden A (2004). Fundamentals of Enzyme Kinetics (3 izd.). London: Portland Press. ISBN 978-1-85578-158-0.
- Stryer L, Berg JM, Tymoczko JL (2002). Biochemistry (5th izd.). San Francisco: W.H. Freeman. ISBN 978-0-7167-4955-4.
- Grisham, Charles M.; Garrett, Reginald H. (1999). Biochemistry. Philadelphia: Saunders College Pub. str. 426-7. ISBN 978-0-03-022318-1.
- Smith, AL, ur. (1997). Oxford dictionary of biochemistry and molecular biology. Oxford Oxfordshire: Oxford University Press. ISBN 978-0-19-854768-6.
- Koshland D. The Enzymes, v. I, ch. 7, Acad. Press, New York, 1959
- Perutz M. Proc. Roy. Soc., B (1967) 167, 448,
- Cha, Y., Murray, C. J. & Klinman, J. P. Science (1989) 243, 1325-1330.
- Leonor Michaelis, Maud Menten, Die Kinetik der Invertinwirkung, Biochem. Z. (1913) 49, 333-369.
- G. E. Briggs and J. B. S. Haldane, A note on the kinetics of enzyme action, Biochem. J., (1925) 19, 339-339.
- R.R. Dogonadze and V.G. Levich. Theory of Non-radiative Electronic Transitions between Ions in Solution, Dokladi Akademii Nauk SSSR. Ser. Fizicheskoy Khimii, Moscow, Vol. 124, 1959, 123-126.
- R.R. Dogonadze. Rate of Electron Transfer Reactions in Solutions, Dokladi Akademii Nauk SSSR. Ser. Fizicheskoy Khimii, Moscow, Vol. 133, 1960, 1368-1371.
- Nishimura M and Chance B. Biochim Biophys Acta. (1963) 66, 1-16.
- V.G. Levich, R.R. Dogonadze, E.D. German, A.M. Kuznetsov and Yu.I. Kharkats. Theory of Homogeneous Reactions Involving Proton Transfer, Electrochim.Acta, 15, 1970, 353-367.
- M.V. Volkenshtein, R.R. Dogonadze, A.K. Madumarov, Z.D. Urushadze, Yu.I. Kharkats. Theory of Enzyme Catalysis.- Molekuliarnaya Biologia, (1972), 431-439 (In Russian, English summary)
- Berg JM, Tymoczko JL, Stryer L (2002). Biochemistry (5th izd.). New York, NY: W. H. Freeman. ISBN 978-0-7167-3051-4., A biochemistry textbook available free online through NCBI Bookshelf.
- Cornish-Bowden A, ur. (1997). New Beer in an Old Bottle: Eduard Buchner and the Growth of Biochemical Knowledge. Universitat de València. ISBN 978-84-370-3328-0. Arhivirano iz originala 13. 12. 2010. g. Pristupljeno 25. 02. 2017., A history of early enzymology.
- Suzuki, H. (2015). How Enzymes Work: From Structure to Function. Boca Raton, FL: CRC Press. ISBN 978-981-4463-92-8.
- Cornish-Bowden A (2012). Fundamentals of Enzyme Kinetics (4th izd.). Weinheim: Wiley-VCH. ISBN 978-3527330744.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 5. izdanje. Spektrum Akademischer Verlag, Heidelberg – Berlin. 2003. ISBN 978-3-8274-1303-1.
- David Fell: Understanding the Control of Metabolism. Portland Press Ltd, London 1997. 2003. ISBN 978-1-85578-047-7.
- Alfred Schellenberger (ed): Enzymkatalyse. Einführung in die Chemie, Biochemie und Technologie der Enzyme. Gustav Fischer Verlag, Jena. 1989. ISBN 978-3-540-18942-8.
- Donald Voet, Judith G. Voet (2004). Biochemistry (3rd izd.). London: John Wiley & Sons Inc. ISBN 978-0-471-39223-1.
- Maria-Regina Kula: Enzyme in der Technik, Chemie in unserer Zeit, 14. Jahrg. 1980, Nr. 2. str. 61–70, ISSN 0009-2851
- Brigitte Osterath, Nagaraj Rao, Stephan Lütz, Andreas Liese: Technische Anwendung von Enzymen. Chemie in unserer Zeit 41(4). str. 324–333 (2007), ISSN 0009-2851
Spoljašnje veze[uredi | uredi izvor]
- PDBsum Datoteka poznatih 3D struktura enzima
- BRENDA, kompilacija informacija i literature svih poznatih enzima
- Expanding the toolbox of cytochrome P450s through enzyme engineering Arhivirano na sajtu Wayback Machine (26. februar 2014)