Izohorski proces
| Termodinamika |
|---|
 |
Izohorski proces je termodinamički proces tokom kojeg zapremina idealnog gasa koji u njemu učestvuje ostaje konstantnom.
Šarlov zakon[uredi | uredi izvor]
Prilikom ovog procesa važi sledeća relacija: p/T=const, što se izvodi iz jednačine stanja idealnog gasa. S obzirom da je pV=nRT => p/T=nR/V. Pošto su sve veličine sa desne strane jednakosti konstantne to važi i za celu desnu stranu pa otuda dobijamo navedenu relaciju između temperature i pritiska pri izohorskom procesu.
Izohora[uredi | uredi izvor]
Ovaj proces možemo grafički da predstavimo uz pomoć izohore. U pV dijagramu ima oblik prave linije pravca normalnog na V-osu. Na slici je prikazana jedna takva izohora. U tom slučaju gas prelazi iz stanja sa manjim pritiskom u stanje sa većim. Pošto je izoterma koja prolazi kroz tačku koja odgovara konačnom stanju u ovom procesu iznad one koja prolazi kroz tačku koja određuje početno ona odgovara većoj temperaturi. Iz toga se može zaključiti da je povećanjem pritiska došlo do porasta temperature, što je potvrda važenja Šarlovog zakona.
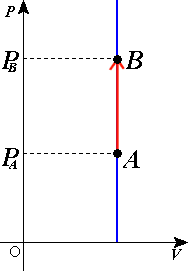
Rad pri izohorskom procesu[uredi | uredi izvor]
Pri izohorskom procesu gas ne vrši rad. To se može pokazati iz relacije:
Pošto pri izohorskom procesu ne dolazi do promene zapremine važi da je ΔV jednako nuli, otuda je i rad u ovom procesu takođe jednak nuli.
Ovo se može objasniti i preko dijagrama sa slike. Rad je po definiciji jednak površini ispod grafika datog procesa u pV dijagramu. Očigledno da je u ovom slučaju ta površina, a samim tim i rad jednaki nuli.
Količina toplote[uredi | uredi izvor]
Obrazac za količinu toplote oslobođene ili dobijene od strane sistema koji učestvuje u izohorskom procesu glasi:
Pritom je: Q- tražena količina toplote, n- broj molova gasa koji učestvuje u procesu ,c-molarni toplotni kapacitet pri stalnoj zapremini, Т-temperatura.
Prema Prvom zakonu termodinamike:
S obzirom da je rad jednak nuli:
Kako je za jedan mol gasa, za n mola važi:
Integralisanjem obe strane dobija se:
- ,
Ili u konačnom obliku:
Vidi još[uredi | uredi izvor]
Spoljašnje veze[uredi | uredi izvor]
- Isochoric process (jezik: engleski)






















