Kalijum hlorat
| |

| |
| Nazivi | |
|---|---|
| Drugi nazivi
Kalijum hlorat(V)
| |
| Identifikacija | |
| ECHA InfoCard | 100.021.173 |
| MeSH | Potassium+chlorate |
| Svojstva | |
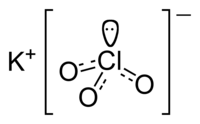
| KClO3 | |
| Molarna masa | 122,55 g/mol |
| Agregatno stanje | Beli kristali ili prah |
| Gustina | 2,32 g/cm³, основно |
| Tačka topljenja | 356 °C |
| Tačka ključanja | ~400 °C, razlaže se |
| 7.3 g/100 ml (20 °C) (70F) | |
| Struktura | |
| Kristalna rešetka/struktura | ? |
| Opasnosti | |
EU klasifikacija (DSD)
|
Oksidant (O) Škodljiv (Xn) Opasan za životnu sredinu (N) |
| R-oznake | R9, R22, R51/53 |
| S-oznake | (S2), S13, S17, S46, S61 |
| NFPA 704 | |
| Tačka paljenja | none |
| Srodna jedinjenja | |
Drugi anjoni
|
Kalijum-bromat Kalijum-jodat |
Drugi katjoni
|
Amonijum-hlorat Natrijum-hlorat |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |
| Reference infokutije | |
Kalijum hlorat je hemijsko jedinjenje koje se sastoji od kalijuma, hlora i kiseonika. Njegova molekulska formula je KClO3. Spada u kalijumove soli hlorne kiseline.[1][2]
U svom čistom obliku, to je bela kristalna supstanca. Posle natrijum hlorata, to je drugi najčešći hlorat u industrijskoj upotrebi. To je jako oksidaciono sredstvo i njegova najvažnija primena je u sigurnosnim šibicama. [3] U drugim primenama je uglavnom zastareo i zamenjen je sigurnijim alternativama poslednjih decenija. Korišćeno je kao:
- Oksidaciono sredstvo,
- U vatrometima, raketnim gorivima i eksplozivima,
- Za pripremu kiseonika, kako u laboratoriji tako iu hemijskim generatorima kiseonika,
- Kao dezinfekciono sredstvo, na primer u u medicinskim ispiranjima usta,
- U poljoprivredi kao herbicid.
Proizvodnja[uredi | uredi izvor]
Na industrijskoj skali, kalijum-hlorat se proizvodi reakcijom metateze soli natrijum-hlorata i kalijum-hlorida:
Reakciju pokreće niska rastvorljivost kalijum hlorata u vodi. Ravnoteža reakcije se pomera na desnu stranu kontinuiranim taloženjem proizvoda (Le Šatelijeov princip). Preteča natrijum hlorata se industrijski proizvodi u veoma velikim količinama elektrolizom natrijum hlorida, obične kuhinjske soli. [3]
Ponekad se koristi i direktna elektroliza KCl u vodenom rastvoru, pri čemu niska rastvorljivost KClO3 u vodi uzrokuje da se so lako izoluje iz reakcione smeše jednostavnim taloženjem iz rastvora.
Kalijum hlorat se može proizvesti u malim količinama disproporcijacijom u rastvoru natrijum hlorida praćeno reakcijom metateze sa kalijum hloridom:
Može se proizvesti i prolaskom hlornog gasa kroz vrelu otopinu kaustične kiseline: [4]
Sinteza kalijum hlorata se može izvršiti elektrolizom rastvora natrijum hlorida i taloženjem proizvedenog natrijum hlorata sa kalijum hloridom. Da bi se izvršila ova konkretna elektroliza, umesto razdvajanja katode (od čelika) i anode (od aktivnog titanijuma) pomoću membrane kao što se radi u hlor-alkalnom procesu, oni moraju biti suprotstavljeni: tako da se hlor koji se disocira elektrolizom reaguje sa kaustičnom sodom i formira natrijum hipohlorit:
Pri visokim temperaturama, natrijum hipohlorit se disocira u hloride i hlorate:
Ali možemo dobiti kalijum-hlorat direktno, elektrolizom rastvora kalijum-hlorida; mehanizam reakcije je sledeći:
Na katodi:
Na anodi:
U prošlosti, kalijum hlorat se proizvodio mešanjem hlora u rastvoru kaustične sode. Prvo su formirani kalijum hlorid i kalijum hipohlorit u jednakim razmerama. Toplota proizvedena egzotermnom prirodom ove reakcije bila je dovoljna da se hipohlorit razdvoji na dva dela hlorida i jedan deo kalijum-hlorata. Dakle, nalazimo u osnovi iste reakcije kao i ranije, ali sa skupljim reagensima (hlorni gas i kaustična soda), ali bez korišćenja električne energije. Hemijska jednačina izgleda ovako:
Međutim, vidimo da je hlorat fiksirao samo šestinu investiranog hlora.
Upotreba[uredi | uredi izvor]



Kalijum hlorat je bio jedan od ključnih sastojaka u ranim udarnim kapislama (prajmerima) za vatreno oružje. Nastavlja se sa tom primenom, gde ga nije zamenio kalijum perhlorat.
Pogonska sredstva na bazi hlorata su efikasnija od tradicionalnog baruta i manje su podložna oštećenjima od vode. Međutim, oni mogu biti izuzetno nestabilni u prisustvu sumpora ili fosfora i mnogo su skuplji. Hloratna goriva se moraju koristiti samo u opremi koja je za njih projektovana; nepoštovanje ove mere predostrožnosti je čest izvor nesreća. Kalijum hlorat, često u kombinaciji sa srebrnim fulminatom, koristi se u trikovima koji stvaraju buku poznatim kao "krekeri", "snapperi", "pop-its", "caps" ili "bang-snaps", popularna vrsta novogodišnje pirotehnike.
Druga primena kalijum hlorata je kao oksidator u dimnoj kompoziciji poput one koja se koristi u dimnim granatama (bombama). Od 2005. patrona sa kalijum hloratom pomešanim sa laktozom i kolofonijumom (smolom) se koristi za stvaranje belog dima koji signalizira izbor novog pape na papskoj konklavi. [5]
Laboratorije srednjih škola i fakulteti često koriste kalijum hlorat za stvaranje gasa kiseonika. To je daleko jeftiniji izvor od rezervoara kiseonika pod pritiskom ili kriogenog rezervoara. Kalijum hlorat se lako raspada ako se zagreva dok je u kontaktu sa katalizatorom, obično mangan(IV) dioksidom (MnO2). Dakle, može se jednostavno staviti u epruvetu i zagrejati iznad gorionika. Ako je epruveta opremljena čepom i crevom sa jednom rupom, topli kiseonik se može izvući. Reakcija je sledeća:
Zagrevanjem u odsustvu katalizatora se pretvara u kalijum perhlorat: [8]
Daljim zagrevanjem, kalijum perhlorat se razlaže na kalijum hlorid i kiseonik:
Bezbedno izvođenje ove reakcije zahteva veoma čiste reagense i pažljivu kontrolu temperature. Rastopljeni kalijum hlorat je izuzetno moćan oksidant i spontano reaguje sa mnogim uobičajenim materijalima kao što je šećer. Eksplozije su nastale usled prskanja tečnih hlorata u lateks ili PVC cevi generatora kiseonika i od kontakta između hlorata i ugljovodoničnih zaptivnih masti. Nečistoće u samom kalijum hloratu takođe mogu prouzrokovati probleme. Kada radite sa novom serijom kalijum hlorata, preporučljivo je uzeti mali uzorak (~1 gram) i snažno ga zagrejati na otvorenoj staklenoj ploči. Kontaminacija može izazvati eksploziju ove male količine, što ukazuje na to da hlorat treba odbaciti.
Kalijum-hlorat se koristi u hemijskim generatorima kiseonika (koji se takođe nazivaju hloratne sveće ili kiseonikove sveće), koji se koriste kao sistemi za snabdevanje kiseonikom npr. aviona, svemirskih stanica, podmornica, i odgovoran je za najmanje jednu avionsku nesreću. Požar na svemirskoj stanici Mir je bio povezan sa svećama za proizvodnju kiseonika koje koriste sličan litijum perhlorat. Razlaganje kalijum hlorata je takođe korišćeno da se obezbedi snabdevanje kiseonikom za reflektore.
Kalijum hlorat se takođe koristi kao pesticid. U Finskoj se prodavao pod trgovačkim imenom Fegabit.
Kalijum hlorat može reagovati sa sumpornom kiselinom i formirati visoko reaktivan rastvor hlorne kiseline i kalijum sulfata:
Tako proizveden rastvor je dovoljno reaktivan da se spontano zapali ako je prisutan zapaljivi materijal (šećer, papir, itd.).
U hemijskim laboratorijama koristi se za oksidaciju HCl i oslobađanje malih količina gasovitog hlora.
Ustanici u Avganistanu takođe uveliko koriste kalijum hlorat kao ključni sastojak u proizvodnji improvizovanih eksplozivnih naprava. Kada su uloženi značajni napori da se smanji dostupnost amonijum-nitratnog đubriva u Avganistanu, proizvođači IED-a počeli su da koriste kalijum-hlorat kao jeftinu i efikasnu alternativu. U 2013. godini, 60% IED u Avganistanu koristilo je kalijum hlorat, što ga čini najčešćim sastojkom koji se koristi u u IED-ima. [6] Kalijum-hlorat je takođe bio glavni sastojak auto-bombe korišćene u bombaškim napadima na Baliju 2002. u kojima su poginule 202 osobe.
Kalijum hlorat se koristi za forsiranje faze cvetanja longan drveta, uzrokujući da proizvodi plodove voća u toplijim klimama. [7]
Kalijum-hlorat se uglavnom koristi u pirotehnici, na primer za pripremu molotovljevog koktela, [8] kao i za hloratne eksplozive, koji se danas više ne koriste (mešavina KClO3 i organskog goriva – npr. ulje, drveno brašno, božićnih petardi...) . U prošlosti se koristio za bojenje kože.
Takođe se koristi u vatrometima i petardama, ali posebno za pravljenje šibica. Za vatromet se zamenjuje što je više moguće kalijum perhloratom, koji je manje opasan za rukovanje. Međutim, ponekad se traži kalijum hlorat da bi se dobile spektakularne boje u pirotehničkim događajima. [9]
Takođe se prirodno koristio za proizvodnju eksploziva. Hloratit sadrži npr. približno 90% kalijum hlorata, 10% ugljovodonika i dodatak na bazi piljevine; ali ovaj eksploziv osetljiv na trenje je u velikoj meri zamenjen oksidantima koji su manje opasni za rukovanje i koji su najmanje efikasni kao kalijum perhlorat, posebno za pripremu znatno stabilnijih eksploziva. Ako se traži manje opasan oksidant, npr. za prajmer crnog baruta za vatromete, ili pirotehničke bombe, danas se umesto toga oslanjamo na tradicionalni kalijum nitrat.

Upotreba alžirskih bombi, ovih petardi napravljenih od mešavine kalijum hlorata, crvenog fosfora i sušenog gumiarabika, oblikovanih u loptu i umotanih u papir, nije bez opasnosti. Ova mešavina kalijum hlorata se obično naziva Armstrongova smeša i njeno direktno rukovanje skoro uvek dovodi do povreda, zbog njene osetljivosti na najmanji udar, trenje ili elektrostatičko pražnjenje.
Ova visokoeksplozivna supstanca se takođe koristi za paljenje sigurnosnih šibica: ona čini upaljač šibice i reaguje sa tragovima crvenog fosfora sa šibica. Razdvajanje materijala dva reagensa tada je predstavljalo pravu proizvodnu tajnu, koju je 1844. otkrio švedski hemičar Gustaf Erik Paš: tako da se šibica ne može spontano zapaliti; jer su fosforne šibice i sumporni štapići zamenili jer su sadržavali kalijum hlorat. [10]
Kalijum-hlorat, kao i natrijum-hlorat, nekada se koristio kao herbicid sve do zabrane. [11]
Uopšteno govoreći, čistim kalijum hloratom treba rukovati samo sa velikom pažnjom, jer i najmanja nečistoća, ne samo fosfora, već čak i sumporna ili metalna strugotina, verovatno će ga učiniti eksplozivnim.
Kalijum hlorat je ulazio u sastav različitih vrsta jake vode, "holandske kiseline (ili nagrizivača)", preparat ploča za graviranje sastavljen od 88% vode, 10% dimeće hlorovodonične kiseline i 2% hlorata. [12]
Nekada se verovalo da kalijum-hlorat ima antiseptičko dejstvo, koji se koristio u sastavu tečnosti za ispiranje usta, [13] ali je ova teza sada kontroverzna, čak dovedena u pitanje. Maksimalna terapeutska doza, odnosno netoksična doza, iznosi 1 g za odraslu osobu: [10] preko toga, oštećuje krv i uništava nervno tkivo. Smrtonosna doza je 5 do 15 g. [14] Danas se sumnja u njegovo antiseptičko dejstvo: s obzirom na njegovu toksičnost, bolje je izbegavati njegovu upotrebu u farmakopeji.
Međutim, naziv Kalijum hloratum, koja se nalazi između ostalog u određenim homeopatskim preparatima, u obliku kreme ili granula, predstavlja latinsku formu kalijum hlorida, i nema nikakve veze sa toksičnim hloratom.
Bezbednost[uredi | uredi izvor]
Kalijum hloratom treba pažljivo rukovati. Reaguje snažno, i u nekim slučajevima se spontano zapali ili eksplodira, kada se pomeša sa mnogim zapaljivim materijalima. Snažno gori u kombinaciji sa gotovo svim zapaljivim materijalima, čak i onim koji su obično slabo zapaljivi (uključujući običnu prašinu i vlakna). Smeše kalijum hlorata i goriva mogu da se zapale u kontaktu sa sumpornom kiselinom, pa ih treba držati podalje od ovog reagensa. Sumpor treba izbegavati u pirotehničkim kompozicijama koje sadrže kalijum hlorat, jer su ove smeše sklone spontanoj deflagraciji. Većina sumpora sadrži tragove kiselina koje sadrže sumpor, a one mogu izazvati spontano paljenje - "Cvetovi sumpora" ili "sublimirani sumpor", uprkos ukupnoj visokoj čistoći, sadrže značajne količine sumpornih kiselina. Takođe, mešavine kalijum hlorata sa bilo kojim jedinjenjem sa svojstvima podsticanja paljenja (npr. Antimon(III) sulfid) su veoma opasne za pripremu, jer su izuzetno osetljive na udar.
Rizik[uredi | uredi izvor]
Kalijum hlorat je toksična i štetna supstanca po zdravlje koja zagađuje životnu sredinu. Može osloboditi visoko štetna jedinjenja hlora. Zbog svojih oksidacionih svojstava gori čak i pod vodom. Kalijum-hlorat spada u materije (tzv. eksplozivni prekursori) za koje je predloženo da budu zabranjene za prodaju široj javnosti. [15]
Vidi još[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Handbook of Inorganic Chemicals. McGraw-Hill. 2002. ISBN 978-0-07-049439-8.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. izd.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ a b Vogt, Helmut; Balej, Jan; Bennett, John E.; Wintzer, Peter; Sheikh, Saeed Akbar; Gallone, Patrizio (15. 6. 2000). „Chlorine Oxides and Chlorine Oxygen Acids”. Ur.: Ullmann. Ullmann's Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag. ISBN 9783527303854. doi:10.1002/14356007.a06_483.
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Daniel J. Wakin and Alan Cowell (13. 3. 2013). „New Round of Voting Fails to Name a Pope”. The New York Times. Pristupljeno 13. 3. 2013.
- ^ „Afghan bomb makers shifting to new explosives for IEDs”. USAToday.com. 25. 6. 2013. Pristupljeno 2013-06-25.
- ^ Manochai, P.; Sruamsiri, P.; Wiriya-alongkorn, W.; Naphrom, D.; Hegele, M.; Bangerth, F. (12. 2. 2005). „Year around off-season flower induction in longan (Dimocarpus longan, Lour.) trees by KClO3 applications: potentials and problems”. Scientia Horticulturae. Department of Horticulture, Maejo University, Chiang Mai, Thailand; Department of Horticulture, Chiang Mai University, Chiang Mai, Thailand; Institute of Special Crops and Crop Physiology, University of Hohenheim, 70593 Stuttgart, Germany. 104 (4): 379—390. doi:10.1016/j.scienta.2005.01.004. Pristupljeno 28. 11. 2010.
- ^ prskavek,Sovětské zápalné láhve Arhivirano na sajtu Wayback Machine (7. decembar 2013)
- ^ Takeo Shimizu. Fireworks — The Art, Science and Technique (4e izd.). Midland (Texas): Pyrotechnica Publications. str. 53 et suiv., p. 92 et suiv. ISBN 0-929388-05-4.
- ^ a b Alexander P. Hardt (2001). Pyrotechnics. Post Falls, Idaho, USA: Pyrotechnica Publications. str. 74 i dalje. ISBN 0-929388-06-2.
- ^ Règlement n° 98/2013 de l’Union européenne ; article 115 de la loi n° 2016-731 du 3 juin 2016 (codifié à l’art. L. 2351-1 du code de la défense).
- ^ Manly Banister (1969). „3. Etching the plate”. Practical Guide to Etching and Other Intaglio Printmaking Techniques (na jeziku: engleski). New York: Sterling Publ. Co. str. 28.
- ^ Céline Couteau (13. 03. 2018). „Si Grand-mère sait faire un bon café, Boiron, en revanche, n’est pas fort en produits bucco-dentaires…”. Regard sur les cosmétiques. Pristupljeno 6. 11. 2021.
- ^ Hermann Ammon (2014). „Kaliumchlorat”. Hunnius pharmazeutisches Wörterbuch (na jeziku: nemački) (11 izd.). Berlin: de Gruyter. ISBN 978-3-11-030990-4.
- ^ Návrh Nařízení Evropského parlamentu a Rady na regulaci prodeje a používání prekurzorů výbušnin
Literatura[uredi | uredi izvor]
- Handbook of Inorganic Chemicals. McGraw-Hill. 2002. ISBN 978-0-07-049439-8.
- Patnaik, Pradyot (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 978-0-07-049439-8.
- Vohlídal, Jiří; Štulík, Karel; Julák, Alois (1999). Chemické a analytické tabulky (1 izd.). Prag: Grada Publishing. ISBN 80-7169-855-5.













![{\displaystyle {\ce {2 KClO3(s) ->[\Delta][MnO_2] 3 O2(g) + 2 KCl(s)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8bce0d11cf57ee2802e42385013f05fe6f1c58e3)


