Neon
 odaje crveni sjaj u stanju plazme | |||||||||||||||||||||
| Opšta svojstva | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ime, simbol | neon, Ne | ||||||||||||||||||||
| Izgled | bezbojni gas koji pokazuje narandžastocrveni sjaj kada se stavi u električno polje | ||||||||||||||||||||
| U periodnom sistemu | |||||||||||||||||||||
| |||||||||||||||||||||
| Atomski broj (Z) | 10 | ||||||||||||||||||||
| Grupa, perioda | grupa 18 (plemeniti gasovi), perioda 2 | ||||||||||||||||||||
| Blok | p-blok | ||||||||||||||||||||
| Kategorija | plemeniti gas | ||||||||||||||||||||
| Rel. at. masa (Ar) | 20,1797(6)[1] | ||||||||||||||||||||
| El. konfiguracija | |||||||||||||||||||||
po ljuskama | 2, 8 | ||||||||||||||||||||
| Fizička svojstva | |||||||||||||||||||||
| Tačka topljenja | 24,56 K (−248,59 °C, −415,46 °F) | ||||||||||||||||||||
| Tačka ključanja | 27,104 K (−246,046 °C, −410,883 °F) | ||||||||||||||||||||
| Gustina na STP (0 °C i 101,325 kPa) | 0,9002 g/L | ||||||||||||||||||||
| tečno st., na t.k. | 1,207 g/cm3[2] | ||||||||||||||||||||
| Trojna tačka | 24,556 K, 43,37 kPa[3][4] | ||||||||||||||||||||
| Kritična tačka | 44,4918 K, 2,7686 MPa[4] | ||||||||||||||||||||
| Toplota fuzije | 0,335 kJ/mol | ||||||||||||||||||||
| Toplota isparavanja | 1,71 kJ/mol | ||||||||||||||||||||
| Mol. topl. kapacitet | 20,79[5] J/(mol·K) | ||||||||||||||||||||
Napon pare
| |||||||||||||||||||||
| Atomska svojstva | |||||||||||||||||||||
| Energije jonizacije | 1: 2080,7 kJ/mol 2: 3952,3 kJ/mol 3: 6122 kJ/mol (ostale) | ||||||||||||||||||||
| Kovalentni radijus | 58 pm | ||||||||||||||||||||
| Valsov radijus | 154 pm | ||||||||||||||||||||
| Ostalo | |||||||||||||||||||||
| Kristalna struktura | postraničnocentr. kubična (FCC) | ||||||||||||||||||||
| Brzina zvuka | 435 m/s (gas, na 0 °C) | ||||||||||||||||||||
| Topl. vodljivost | 49,1×10−3 W/(m·K) | ||||||||||||||||||||
| Magnetni raspored | dijamagnetičan[6] | ||||||||||||||||||||
| Magnetna susceptibilnost (χmol) | −6,74·10−6 cm3/mol (298 K)[7] | ||||||||||||||||||||
| Modul stišljivosti | 654 GPa | ||||||||||||||||||||
| CAS broj | 7440-01-9 | ||||||||||||||||||||
| Istorija | |||||||||||||||||||||
| Predviđanje | Vilijam Remzi (1897) | ||||||||||||||||||||
| Otkriće i prva izolacija | Vilijam Remzi & Moris Travers[8][9] (1898) | ||||||||||||||||||||
| Glavni izotopi | |||||||||||||||||||||
| |||||||||||||||||||||
Neon (Ne, lat. neon) plemeniti je gas sa atomskim brojem 10.[10] U periodnom sistemu stoji u 8. glavnoj grupi (18. grupa) i stoga se ubraja u plemenite gasove. Kao i ostali plemeniti gasovi, neon je bezbojni, izrazito nereaktivni, jednoatomni gas. Po mnogim osobinama kao što su tačka topljenja, ključanja i gustina, stoji između lakšeg helijuma i težeg argona. U svemiru, neon spada među najčešće elemente, ali je na Zemlji relativno redak, jer je poput helijuma, njegov najveći deo tokom vremena ispario u svemir. On se nalazi u gornjim slojevima Zemlje u količini od 5 × 10−7%. Stabilni izotopi su mu: 20Ne, 21Ne i 22Ne.[11]
Kao i kripton i ksenon, neon su takođe otkrili Vilijam Remzi i Moris Travers 1898. godine frakcijskom destilacijom tečnog vazduha. Najpoznatija upotreba ovog gasa ogleda se u svetlećim cevima, takozvanim neonskim lampama, u kojima se neon pomoću električnog pražnjenja dovodi do isijavanja tipične narandžasto-crvene svetlosti.
Istorija[uredi | uredi izvor]

Prvi plemeniti gas koji je otkriven bio je argon, koga su 1894. otkrili Džon Vilijam Strat i Vilijam Remzi. Remzi je godinu kasnije, 1895. je uspeo da izoluje helijum iz uranijeve rude, gas koji je ranije bio poznat samo u Sunčevom spektru. Iz pravilnosti periodnog sistema, zaključio je da bi između helijuma i argona trebao da postoji neki element sa atomskom masom od oko 20 u. Stoga je on od 1896. počeo da proučava različite minerale i meteorite, te gasove koji se otpuštaju pri njihovim zagrejavanu ili rastvaranjem. Remzi, zajedno sa svojim saradnikom Traversom, nije bio uspešan u potrazi, međutim oni su uspeli da izoluju helijum i retki gas argon. Takođe, ni ispitivanja vrelih gasova iz Kotreta u Francuskoj i sa Islanda, nisu dovela do rezultata.[12]
Napokon, nakon što je iz tečnog vazduha izolovao 15 litara sirovog argona, počeo je da ga ispituje, te nakon što ga je preveo u tečno stanje, počeo je da izdvaja druge supstance putem frakcijske destilacije. Pri tom postupku, prvo je izdvojio kripton, koji je dokazao u spektru plamena, a zatim 13. juna 1898. godine napokon su uspeli da izoluju lakše elemente iz frakcije sa nižom tačkom ključanja sirovog argona. Remzi i Travers su taj element nazvali neon, iz grčkog naziva νέος neos „nov“. Ubrzo nakon tog otkrića, uspelo im je iz frakcije koja je sadržavala kripton, izdvojiti još jedan element, ksenon.[12]
Prvi vid upotrebe novootkrivenih gasova razvio je 1910. godine Francuz Žorž Klod, koji je razvio neonsku lampu, napunivši staklenu cev neonom te je propuštajući električnu struju visokog napona kroz nju, doveo neon do emitovanja svetlosti.[13]
Osobine[uredi | uredi izvor]
Fizičke[uredi | uredi izvor]
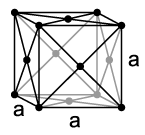

Pri normalnim uslovima, neon je jednoatomni, bezbojni gas, bez ukusa i mirisa. Pri temperaturi od 27 K (−246 °C) se kondenzuje, a pri temperaturi od 24,57 K (−248,59 °C) prelazi u čvrsto stanje, što znači da on ima najuži temperaturni opseg od svih elemenata u kojem je u tečnom stanju. Kao i drugi plemeniti gasovi, osim helija, neon se kristalizuje u kubičnom gusto pakovanom kuglastom sistemu sa parametrom rešetke od a = 443 pm.[14]
Kao i svi drugi plemeniti gasovi, neon takođe ima popunjene sve elektronske ljuske (konfiguracija plemenitog gasa). Zbog toga se može objasniti njegovo prisustvo kao jednoatomnog elementa i odsustvo bilo kakve reaktivnosti. Sa gustinom od oko 0,9 kg/m3 pri temperaturi od 0 °C i pritisku 1013 hPa, neon je nešto lakši od vazduha, te se diže gore. U faznom dijagramu trojna tačka se nalazi na 24,56 K i 43,37 kPa,[15] a kritična tačka na 44,4 K, 265,4 kPa, dok kritična gustina iznosi 0,483 g/cm3.[16]
U vodi, neon je vrlo slabo rastvorljiv. U jednoj litri vode pri temperaturi od 20 °C može se rastvoriti najviše 10,5 ml neona.[16] Kao i drugi plemeniti gasovi, pri električnom pražnjenju neon takođe pokazuje karakteristične spektarske linije. Pošto su te linije u vidljivom delu spektra pretežno u crvenom i žutom području, pri takvom pražnjenju gas emituje tipičnu crveno-narandžastu boju.
Hemijske[uredi | uredi izvor]
Kao tipičan plemeniti gas, neon je izrazito nereaktivan, kao i helijum, do danas nisu poznata njegova jedinjenja. Čak i klatrati, koji su kod drugih plemenitih gasova fizički uklopljeni u druga jedinjenja, nisu poznati kod neona. Prema teoretskim proračunima, neon je najmanje reaktivan element. Tako izračunata entalpija disocijacije za jedinjenja tipa NgBeO (gde je Ng plemeniti gas), kod jedinjenja neona je najmanja. Utvrđeno je da, i pored najstabilnijeg jedinjenja helijuma HHeF, koji je najbliži analog neona, nije potvrđeno postojanje sličnog jedinjenja kod neona. Moguće objašnjenje za ovaj rezultat je da se između fluora i vodonika nalazi najveći razmak u vezi te se stoga javlja vrlo slaba veza privlačenja jona HNe+ za razliku od helijumovog jona, ili se javlja sila odbijanja u neonovim katjonima zbog p-π izmeničnog delovanja.[17]
Iz ispitivanja masenom spektrometrijom, poznati su neki joni u kojima je zastupljen neon. U njih spadaju jon Ne+ i neki joni elemenata poput ArNe+, HeNe+ i HNe+.[18]
Izotopi[uredi | uredi izvor]
Postoji ukupno 18 poznatih izotopa neona između 16Ne i 34Ne. Među njima, tri su stabilna: 20Ne, 21Ne i 22Ne i javljaju se u prirodi. Najčešći izotop je 20Ne i ima udeo u prirodnom neonu od 90,48%. Izotop 21Ne sa udelom od 0,27% je najređi na Zemlji, a na izotop 22Ne u prirodnoj smesi izotopa na Zemlji otpada 9,25%. Svi ostali izotopi imaju veoma kratka vremena poluraspada, od najviše 3,38 minuta kod izotopa 24Ne.[19]
S obzirom na gubljenje neona sa Zemlje u svemir i formiranje u nuklearnim reakcijama, izotopski odnos između neona 20Ne/22Ne i 21Ne/22Ne, koji je zarobljen u stenama i nema kontakt sa atmosferom, nije isti. Iz tog izotopskog odnosa mogu se izvući zaključci o njegovom poreklu i nastanku. Tako je udeo neona 21Ne u stenama, u kojima je on nastao u reakcijama spalacije, nešto povećan. U primordijalnom neonu, koji je bio zarobljen u stenama i dijamantima pre gubitka većeg dela neona, s druge strane, veći udeo čini izotop 20Ne.[20]
Rasprostranjenost[uredi | uredi izvor]
U svemiru, neon se ubraja među najčešće i najrasprostranjenije elemente, samo su vodonik, helijum, kiseonik, ugljenik i azot više rasprostranjeni od njega. Međutim, na Zemlji, poput helijuma, je relativno redak, a njegov ukupan udeo u Zemljinoj kori iznosi samo oko 0,005 delova na milion (ppm) (0,0000005%).[21] Najveći deo neona nalazi se u atmosferi, sa prosečnim udelom od oko 18,18 ppm, te je posle argona, najčešći plemeniti gas na Zemlji.[22] Na osnovu različitog udela lakših i težih izotopa neona na Zemlji i na Suncu može se zaključiti da je od postanka Zemlje najveći deo neona napustio njenu atmosferu te su ostali teži izotopi 21Ne i 22Ne.
U vrlo malim količinama, neon se javlja i u sastavu stena. Dokazan je u sastavu granita, bazaltnih stena, dijamanta i vulkanskih gasova. Zbog različitog udela njegovih izotopa smatra se da ovaj neon ima tri različita izvora nastanka: primordijalni neon, čiji izotopni sastav odgovara onom na Suncu te je zarobljen u dijamantima ili u Zemljinom plaštu bez kontakta sa atmosferom, zatim atmosferski neon, te neon koji je nastao putem reakcija spalacije kosmičkim zračenjem.[20]
Na gasovitim planetama poput Jupitera, neon ne može pobeći u svemiru zbog velike gravitacije, tako da tamo izotopski sastav neona odgovara onom iz vremena stvaranja planeta. Prema podacima sa svemirske sonde Galileo, odnos udela izotopa 20Ne prema 22Ne odgovara onom na Suncu, što daje naznake o uslovima pri kojima su nastale planete.[23]
Reference[uredi | uredi izvor]
- ^ Meija, J.; et al. (2016). „Atomic weights of the elements 2013 (IUPAC Technical Report)”. Pure and Applied Chemistry. 88 (3): 265—291. doi:10.1515/pac-2015-0305.
- ^ Hammond, C. R. (2000). The Elements, in Handbook of Chemistry and Physics 81st edition (PDF). CRC press. str. 19. ISBN 0849304814.
- ^ Preston-Thomas, H. (1990). „The International Temperature Scale of 1990 (ITS-90)”. Metrologia. 27 (1): 3—10. Bibcode:1990Metro..27....3P. doi:10.1088/0026-1394/27/1/002.
- ^ a b Haynes, William M., ur. (2011). CRC Handbook of Chemistry and Physics (92nd izd.). Boca Raton, FL: CRC Press. str. 4.122. ISBN 1439855110.
- ^ Shuen-Chen Hwang, Robert D. Lein, Daniel A. Morgan (2005). "Noble Gases". in Kirk Othmer Encyclopedia of Chemical Technology, pages 343–383. Wiley. . doi:10.1002/0471238961.0701190508230114.a01.pub2. Nedostaje ili je prazan parametar
|title=(pomoć) - ^ Magnetic susceptibility of the elements and inorganic compounds Arhivirano na sajtu Wayback Machine (28. март 2014), in Lide, D. R., ур. (2005). CRC Handbook of Chemistry and Physics (86th изд.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. стр. E110. ISBN 0-8493-0464-4.
- ^ Ramsay, William; Travers, Morris W. (1898). „On the Companions of Argon”. Proceedings of the Royal Society of London. 63 (1): 437—440. doi:10.1098/rspl.1898.0057.
- ^ „Neon: History”. Softciências. Архивирано из оригинала 14. 03. 2007. г. Приступљено 2007-02-27.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Parkes, G.D. & Phil, D. (1973). Melorova moderna neorganska hemija. Beograd: Naučna knjiga.
- ^ а б William Ramsay: The Rare Gases of the Atmosphere. govor povodom dodjele Nobelove nagrade, 12. decembar 1904.
- ^ Patent US1125476 Архивирано 2012-02-16 на сајту Wayback Machine System of illuminating by luminescent tubes. prijavljen 8. oktobra 1911, objavljen 19. januara 1915, izumitelj: Georges Claude.
- ^ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. u: Acta Crystallographica. 1974, 30, str. 193–204, . doi:10.1107/S0567740874002469. Nedostaje ili je prazan parametar
|title=(pomoć) - ^ J. Ancsin: Vapor Pressure and Triple Point of Neon and the Influence of Impurities on these Properties. u: Metrologica. 1978, 4, 1, str. 1 (NIST webbook).
- ^ a b RömppOnline: Neon, 19. juni 2014
- ^ Errol G. Lewars: Modeling Marvels: Computational Anticipation of Novel Molecules. Springer Verlag, 2008, ISBN 978-1-4020-6972-7, str. 69–80.
- ^ Weast, Robert C. (gl. ur.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990. str. E-129 do E-145. ISBN 0-8493-0470-9.
- ^ G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties Arhivirano na sajtu Wayback Machine (23. септембар 2008) (PDF). u: Nuclear Physics. 2003, Bd. A 729, str. 3–128.
- ^ а б Alan P. Dickin: Radiogenic isotope geology. 2. izd., Cambridge University Press, 2005, ISBN 978-0-521-82316-6, str. 303–307.
- ^ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ^ David R. Williams: Earth Fact Sheet. NASA, Greenbelt, stanje 20. maj 2009.
- ^ P. R. Mahaffy, H. B. Niemann, A. Alpert, S. K. Atreya, J. Demick, T. M. Donahue, D. N. Harpold, T. C. Owen: Noble gas abundance and isotope ratios in the atmosphere of Jupiter from the Galileo Probe Mass Spectrometer. u: J. Geophys. Res. 2000, 105, str. 15061–15071 (Abstract).
Spoljašnje veze[uredi | uredi izvor]
- Neon at The Periodic Table of Videos (University of Nottingham)
- WebElements.com – Neon.
- It's Elemental – Neon
- USGS Periodic Table – Neon
- Atomic Spectrum of Neon
- Neon Museum, Las Vegas


