Organska hemija

Organska hemija je oblast hemije koja se bavi naučnim istraživanjem strukture, svojstava, kompozicije, reakcija, i pripreme (putem sinteze ili drugih sredstava) jedinjenja baziranih na ugljeniku (ugljovodonika) i njihovih derivata.[1] Ta jedinjenja mogu da sadrže znatan broj drugih elementa, uključujući vodonik, azot, kiseonik, halogene kao i fosfor, silicijum, i sumpor.[2][3][4] Organska jedinjenja formiraju bazu svih formi života na Zemlji. Ona su strukturno veoma raznovrsna. Opseg primena organskih jedinjenja je enorman. Ona su bilo baza, ili važan konstituent, mnogih proizvoda, neki od kojih su plastika, lekovi, petrohemikalije, hrana, eksplozivni materijali, i boje.
Organska hemija je u početku označavala deo hemije koja se bavila sistematikom hemijskih jedinjenja, koja se kako se verovalo ne mogu dobiti putem sinteze u laboratoriji, jedino preko živih organizama.[5] Fridrih Veler, nastavnik srednje tehničke škole i doktor medicinskih nauka u Berlinu, napravio je 1828. godine prvo sintetičko jedinjenje karbamid (organsku materiju koja se nalazi u urinu). To je prva sintetska organska materija proizvedena u laboratoriji, tj. van organizma. Zanimljivo je da je ovaj nastavnik ovu organsku materiju napravio u nameri da proizvede neku drugu so.[6] Kasnije se ipak pokazalo, da se skoro sva organska jedinjenja mogu veštački dobiti. Dobijeno je i mnogo jedinjenja koja se u prirodi ne javljaju, ali koja imaju slične osobine onima koji se nalaze u živim organizmima, kao i onda koja se ubrajaju u organska a nisu slična jedinjenjima koja se nalaze u živim organizmima.
Sa druge strane pokazalo se da sva organska jedinjenja u sebi sadrže ugljenik koji je četvorovalentan. Odatle potiče trenutna definicija organske hemije da je ona hemija ugljenikovih jedinjenja. Izuzetak predstavljaju ugljen-monoksid, ugljen-dioksid, ugljena kiselina i njene soli karbonati, cijanidi, metalni karbonili (koji spadaju u koordinacione komplekse) i alotropske modifikacije ugljenika kao što je dijamant i grafit koji se ubrajaju u neorganska jedinjenja.
Karakterizacija[uredi | uredi izvor]
Organska jedinjenja se često javljaju kao smeše, te je stoga razvijen niz tehnika za određivanje čistoće. Među njima su posebno važne hromatografske tehnike: HPLC i gasna hromatografija. Tradicionalni metodi separacije obuhvataju destilaciju, kristalizaciju, i ekstrakciju rastvaračem.
Organska jedinjenja su tradicionalno bila karakterisana putem niz hemijskih testova, zvanih „vlažne metode“, ali su takve analize u znatnoj meri zamenjene spektroskopskim i drugim računarski intenzivnim metodama analize.[7] Dati u približnom poretku značaja, glavni analitički metodi su:
- Spektroskopija nuklearne magnetne rezonance (NMR) je najšire korišćena tehnika. Ona često omogućava kompletno određivanje povezanosti atoma, pa čak i stereohemije koristeći korelacionu spektroskopiju. Glavni gradivni atomi u organskoj hemiji - vodonik i ugljenik - prirodno postoje sa NMR-odzivnim izotopima, respektivno 1H i 13C.
- Elementalna analiza je destruktivni metod koji se koristi za određivanje elementalne kompozicije molekula.
- Masena spektrometrija daje indikaciju o molekulskoj masi jedinjenja. Podaci o strukturi se dobijaju iz analize obrazaca fragmentacije. Masena spektroskopija visoke rezolucije može obično da identifikuje tačnu formulu jedinjenja i koristi se kao zamena elementalne analize. U prošlosti je primena masene spektrometrije bila ograničena na neutralne molekule koji su isparljivi, ali je napredak jonizacionih tehnika omogućio dobijanje masenih spektra virtualno svih organskih jedinjenja.
- Kristalografija je nedvosmislen metod za određivanja molekularne geometrije. Ograničavajuće svojstvo je da kristal materijal mora da bude dostupan, i da kristal mora da reprezentacija uzorka. Visoko automatizovani softver omogućava određivanje strukture nakon nekoliko časova analize difrakcionog obrasca.
Tradicionalne spektroskopske metode kao što su infracrvena spektroskopija, optička rotacija i UV/VIS spektroskopija pružaju relativno nespecifične strukturne informacije ali ostaju u upotrebi za specifične klase jedinjenja.
Osobine[uredi | uredi izvor]
Tipično su od interesa kvalitativne i kvantitativne fizičke osobine organskih jedinjenja. Primeri kvantitativnih informacija su tačka topljenja, tačka ključanja, i indeks refrakcije. U kvalitativne osobine spadaju miris, konzistencija, rastvorljivost, i boja.
Tačka topljenja i ključanja[uredi | uredi izvor]
U kontrastu sa većinom neorganskih materijala, organska jedinjenja se tipično tope i ključaju na umerenim temperaturama. U prošlosti su tačka topljenja i ključanja pružali presudne informacije o čistoći i identitetu organskih jedinjenja. Tačke topljenja i ključanja su u korelaciji sa polarnošću molekula i njegovom molekulskom masom. Neka organska jedinjenja, a posebno simetrična, sublimiraju, drugim rečima isparavaju bez topljenja. Dobro poznat primer organskog jedinjenja koje sublimira je para-dihlorobenzen, mirisni sastojak modernih kugli protiv moljaca. Organska jedinjenja obično nisu veoma stabilna na temperaturama iznad 300 °C, mada postoje neki izuzeci.
Rastvorljivost[uredi | uredi izvor]
Neutralna organska jedinjenja su često hidrofobna, drugim rečima ona su manje rastvorna u vodi nego u organskim rastvaračima. U izuzetke spadaju organska jedinjenja koja sadrže jonizabilne grupe kao i alkohole, amine, i karboksilne kiseline niske molekulske mase kod kojih dolazi do vodoničnog vezivanja. Organska jedinjenja su obično rastvorna u organskim rastvaračima. Rastvarači mogu da budu bilo čiste supstance poput etra i etil alkohola, ili smeše, kao što su parafinski rastvarači, npr. razni petroletri i benzini, ili opseg čistih ili pomešanih aromatičnih rastvarača dobijenih iz nafte ili katranskih frakcija putem fizičke separacije ili hemijske konverzije. Rastvorljivost u različitim rastvaračima zavisi od tipa rastvarača i hemijske strukture organskog jedinjenja.
Osobine čvrstog stanja[uredi | uredi izvor]
Razna specijalizovana svojstva molekulskih kristala i organskih polimera sa konjugovanim sistemima su od interesa u zavisnosti od primene, e. g. termo-mehaničke i elektro-mehaničke kao što je piezoelektricitet, električna provodljivost, i elektro-optičke osobine.
Nomenklatura[uredi | uredi izvor]

Imena organskih jedinjenja su bilo sistemska, u kom slučaju logično slede iz skupa pravila, ili nesistemska, u kom slučaju proističu iz raznih tradicija. Sistematska nomenklatura je određena specifikacijama definisanim od strane IUPAC organizacije. Sistematska nomenklatura počinje sa imenom roditeljske strukture unutar molekula od interesa. To roditeljsko ime se zatim modifikuje prefiksima, sufiksima, i brojevima tako da nedvosmisleno odražava strukturu. Imajući na umu da su desetine miliona organskih jedinjenja poznate, rigorozna upotreba sistematskih imena može da bude nezgrapna. Stoga se IUPAC preporuke doslovno slede za jednostavnija jedinjenja, a u manjoj meri za kompleksne molekule. Da bi se napisalo sistematsko ime, struktura jedinjenja mora biti poznata, kao i imena roditeljskih struktura. Roditeljske strukture obuhvataju nesupstituisane ugljovodonike, heterociklična jedinjenja, i njihove monofunkcionalizovane derivate.
Nesistematska nomenklatura je jednostavnija i nedvosmislenija. Nesistematska imena ne sadrže indikacije od strukturi jedinjenja. Ona se često koriste za imenovanje kompleksnih molekula, što obuhvata većinu prirodnih proizvoda. Na primer, neformalno imenovani dietilamid lizerginske kiseline ima sistematsko ime: (6aR,9R)-N,N-dietil-7-metil-4,6,6a,7,8,9-heksahidroindolo-[4,3-fg] hinolin-9-karboksamid.
Sa povećanom primenom računara, drugi metodi imenovanja su evoluirali s ciljem efikasne interpretacije od strane mašina. Dva popularna formata su: SMILES i InChI.
Strukturni prikazi[uredi | uredi izvor]
Organski molekuli se obično opisuju putem crteža ili strukturnih formula, kombinacija crteža i hemijskih simbola. Skeletalna formula je jednostavna i nedvosmislena. U ovom sistemu, krajnje tačke i preseci svake linije predstavljaju ugljenik, dok se atomi vodonika bilo eksplicitno pišu, ili se njihovo prisustvo implicitno pretpostavlja iz tetravalentnosti ugljenika. Opis organskih jedinjenja pomoću crteža je znatno pojednostavljen činjenicom da ugljenik u skoro svim organskim jedinjenjima ima četiri veze, azot tri, kiseonik dve, i vodonik jednu.
Klasifikacija organskih jedinjenja[uredi | uredi izvor]
Funkcionalne grupe[uredi | uredi izvor]

Koncept funkcionalnih grupa je centralan u organskoj hemiji kao način klasifikacije struktura i vid predviđanja osobina. Funkcionalna grupa je deo molekula, i reaktivnost funkcionalne grupe se podrazumeva da je slična za većinu molekula. Funkcionalne grupe mogu da imaju odlučnu ulogu u hemijskim i fizičkim svojstvima jedinjenja. Molekuli se klasifikuju na bazi njihovih funkcionalnih grupa. Alkoholi, na primer imaju podjedinicu C-O-H. Svi alkoholi su donekle hidrofilni, obično formiraju estre, i mogu da se konvertuju do odgovarajućih halida. Većina funkcionalnih grupa sadrži heteroatome (atome osim C i H).
Primeri funkcionalnih grupa:
Alifatična jedinjenja[uredi | uredi izvor]
Alifatični ugljovodonici se dele u tri grupe homolognih redova na osnovu njihovog stepena zasićenosti:
- parafini ili alkani su ugljovodonici bez dvostruki ili trostrukih veza
- olefini ili alkeni sadrže jednu ili više dvostrukih veza, npr. diolefini (dieni) ili poliolefini
- alkini sadrže jednu ili više trostruke veze.
Ostatak grupe se klasifikuje na osnovu funkcionalnih grupa. Takva jedinjenja mogu da imaju prav lanac, razgranat lanac ili da budu ciklična. Stepen grananja utiče na svojstva jedinjenja, kao što je oktanski broj ili cetanski broj u hemiji nafte.
Ciklična jedinjenja mogu da budu zasićena i nezasićena. Najstabilniji prsteni sadrže pet ili šest atoma ugljenika, mada su veliki prsteni (makrociklična jedinjenja) i manji prsteni često sreću. Najmanja cikloalkanska familija je tročlani ciklopropan ((CH2)3). Zasićena ciklična jedinjenja (cikloalkani) sadrže samo jednostruke veze. Cikloalkeni i cikloalkini sadrže dvostruke i trostruke veze, respektivno.
Aromatična jedinjenja[uredi | uredi izvor]
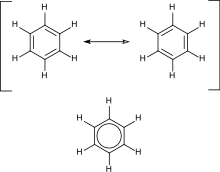
Aromatični ugljovodonici sadrže konjugovane dvostruke veze. Najvažniji primer je benzen. Njegovu strukturu je formulisao Kekule koji je prvi predložio princip delokalizacije ili rezonancije radi objašnjavanja strukture. Za „konvencionalna“ ciklična jedinjenja, aromatičnost je određena prisustvom 4n + 2 delokalizovana pi elektrona, gde je n ceo broj. Posebnu nestabilnost (antiaromatičnost) manifestuju jedinjenja sa 4n konjugovana pi elektrona.
Heterociklična jedinjenja[uredi | uredi izvor]
Karakteristike cikličnih ugljovodonika se znatno razlikuju ako su prisutni heteroatomi, koji mogu da postoje bilo kao supstituenti vezani spolja za prsten ili kao članovi samih prstena. U kasnijem slučaju prsten se naziva heterocikličnim. Piridin i furan su primeri aromatičnih heterocikličnih jedinjenja, dok su piperidin i tetrahidrofuran odgovarajući aliciklični prsteni. Heteroatom heterocikličnih molekula je generalno kiseonik, sumpor, ili azot. Azot je posebno čest u biohemijskim sistemima.
Primeri grupa među heterocikličnim prstenovima su anilinske boje, većina jedinjenja kojima se bavi biohemija, npr. alkaloidi, mnoga jedinjenja vezana za vitamine, steroide, nukleinske kiseline (npr. DNK, RNK), kao i brojni lekovi. Primeri heterocikličnih jedinjenja sa relativno jednostavnim strukturama su pirol i indol.
Prsteni mogu da budu međusobno kondenzovani u policiklična jedinjenja. Purinske nukleozidne baze su primer policikličnih aromatičnih heteroprstena. Prsteni mogu da budu kondenzovani na uglju tako da jedan atom ima dve veza u jednom prstenu i dve veze u drugom. To su spiro jedinjenja. Ona su važna u brojnim prirodnim proizvodima.
Polimeri[uredi | uredi izvor]
Jedno važno svojstvo ugljenika je da lako formira lance ili mreže, koje su povezane vezama između ugljenika. Proces povezivanja se naziva polimerizacija, dok su lanci polimeri. Povezane molekulske jedinice su monomeri.
Postoje dve glavne grupe polimera: sintetički polimeri i biopolimeri. Sintetički polimeri se proizvode veštački, i nazivaju se industrijskim polimerima.[8] Biopolimeri se javljaju u prirodi, ili bez ljudske intervencije.
Biomolekuli[uredi | uredi izvor]

Biomolekulska hemija je jedna od glavnih kategorija u organskoj hemiji koju često izučavaju biohemičari. Mnoge kompleksne multifunkcionalne grupe molekula su važne za žive organizme. Neke su dugolančani biopolimeri, u koje se ubrajaju peptidi, DNK, RNK i polisaharidi poput skroba i celuloze. Druga značajna klasa su aminokiseline (monomerni gradivni blokovi peptida i proteina), ugljeni hidrati (koji obuhvataju polisaharide), nukleinske kiseline (od kojih se formiraju DNK i RNA), i lipidi. Pored toga, životinjska biohemija sadrži mnoge male molekule koji pomažu u produkciji energije putem Krebsovog ciklusa, kao i formiranju izoprena, najrasprostranjenijeg ugljovodonika u životinjama. Izopreni u životinjama formiraju strukturne steroide (holesterol) i steroidne hormone. Iz izoprena se u biljkama formiraju terpeni, terpenoidi, pojedini alkaloidi, i jedinstvena grupa ugljovodonika zvanih biopolimerni poliizoprenoidi. Oni su prisutni u lateksnom soku, koji je baza za pravljenje gume.
Mali molekuli[uredi | uredi izvor]
U farmakologiji su mali molekuli važna grupa organskih jedinjenja. Oni se takođe nazivaju mala organska jedinjenja. U tom kontekstu, a mali molekul je malo organsko jedinjenje koje je biološki aktivno, ali nije polimer. U praksi, mali molekuli imaju molarnu masu manju od oko 1000 g/mol.

Fulerani[uredi | uredi izvor]
Fulereni i ugljenične nanocevi su jedinjenja ugljenika sa sferoidnim i cevastim strukturama. Ta jedinjenja su značajna za nauku o materijalima.
Drugi[uredi | uredi izvor]
Organska jedinjenja koja sadrže ugljenik vezan za azot, kiseonik i halogene se normalno zasebno grupišu. Druga jedinjenja se ponekad stavljaju u podgrupe i razmatraju kao organosumporna hemija, organometalna hemija, organofosforna hemija i organosilikonska hemija.
Organske reakcije[uredi | uredi izvor]
Hemijske reakcije[uredi | uredi izvor]
Većina molekula je stabilna. Boce vode, acetona ili metil jodida se mogu čuvati godinama bez promena hemijske kompozicije molekula. Međutim kada se dodaju hemijski reagensi, npr. HCl u vodu, natrijum cijanid (NaCN) u aceton, ili natrijum hidroksid u metil jodid, dolazi do hemijskih reakcija.
Molekuli reaguju zato što se konstantno kreću kroz prostor sudarajući se sa drugim molekulima i zidovima suda u kome se nalaze, kao i sa rastvaračem, ako su u rastvoru. Atomi se isto tako kreću unutar molekula, dužine njihovih veza i uglovi između veza osciluju, veze se savijaju. Kad je dužina veze u molekulu znatno povećana, ona može da se prekine i pri tome dolazi do hemijske reakcije. Kad se dva molekula sudare, oni mogu da se kombinuju formiranjem nove veze.
Svi organski molekuli imaju spoljašnji sloj sa znatnim brojem elektrona, koji zauzimaju popunjene orbitale, vezujuće i nevezujuće. Odbijanje naelektrisanja između tih elektrona osigurava da se molekuli međusobno odbijaju. Do reakcije dolazi jedino ako molekuli imaju dovoljno energije (energija aktivacije) da nadjačaju odbojne sile i priđu dovoljno blizu jedan drugog. Ako dva molekula nemaju neophodnu energiju aktivacije oni se jednostavno sudaraju, odbijaju, i razmenjuju energiju, ali ostaju hemijski nepromenjeni.
- Privlačenje orbitala
Pored univerzalne odbojne sile, takođe su važne sile privlačenja između molekula ako su naelektrisani. Katjoni i anjoni se međusobno elektrostatički privlače i to privlačenje je u nekim slučajevima dovoljno do dođe do reakcije. Kad alkil hlorid (RCl) reaguje sa natrijum jodidom (NaI) u acetonskom (Me2C=O) rastvoru formira se precipitat natrijum hlorida. Joni natrijuma (Na+) i hlorida (Cl-) se privlače u rastvoru i formiraju kristalnu rešetku od naizmeničnih katjona i anjona - talog kristalnog natrijum hlorida.
Neorganski stil privlačenja je redak u organskim reakcijama. Znatno češći uzrok organskih reakcija je privlačenje između naelektrisanog reagensa (katjona ili anjona) i organskog jedinjenja koje ima dipol. Primer takve reakcije je reakcija između natrijum cijanida (soli NaCN) i karbonilnog jedinjenja poput acetona. Natrijum cijanid se u rastvoru sastoji od katjona natrijuma (Na+) i cijanatnih anjona (CN-). Aceton ima karbonilnu grupu, C=O dvostruku vezu, koja je polarizovana jer je kiseonik elektronegativniji od ugljenika. Negativni cijanidni jon privlači pozitivni kraj karbonilne grupe dipola. Nije uvek neophodno da reagens bude naelektrisan. Amonijak takođe reaguje sa acetonom i u ovom slučaju slobodni elektronski par - par koji ne učestvuje u vezivanje i koji je koncentrisan na atomu azota nenaelektrisanog molekula amonijaka - je privučen pozitivnim krajem karbonilnog dipola.
Polarnost može da proistekne i iz σ veza. Najelektronegativniji element periodnog sistema je fluor i tri atoma fluora na elektropozitivnom boru proizvode parcijalno pozitivno naelektrisani atom bora putem polarizacije σ veze. Negativni kraj acetonskog dipola (atom kiseonika) privlači atom bora u BF3. Bor je u III grupi periodnog sistema i stoga ima šest elektrona oko sebe u svojim trovalentnim jedinjenjima. Prazna orbitala atoma ne odbija elektronima bogate oblasti drugih molekula, tako da atom kiseonika aceton elektrostatički privučen ka parcijalno pozitivnom naelektrisanju i jedan od slobodnih elektronskih parova kiseonika može da formira vezujuću interakciju sa praznom orbitalom.
- Preklapanje orbitala
Druge organske reakcije se odvijaju između potpuno nenaelektrisanih molekula koji nemaju dipole. Jedan od starih testova za nezasićenost je tretiranje jedinjenja bromiranom (Br2) vodom. Ako nestane smeđe boje, molekul je nezasićen. Razvoj spektroskopije je učinio takve testove zastarelim, ali je reakcija još uvek važna. Jednostavni simetrični alken se kombinuje sa simetričnim bromom u jednostavnoj reakciji adicije. Jedini elektroni koji mogu da budu korisni u molekulskom privlačenju su slobodni elektroni broma. Privlačenje između molekula nije elektrostatičko. Do reakcije dolazi jer molekul broma ima slobodnu orbitalu koja može da primi elektrone. To nije lokalizovana atomska orbitala poput one u BF3 molekulu. To je antivezujuća orbitala koja pripada Br-Br σ vezi. U ovom slučaju postoji privlačenje između pune orbitale (π veze) i prazne orbitale (σ* orbitale Br-Br veze). Molekuli se međusobno privlače zbog ove interakcije prazne i pune orbitale, i to dovodi do vezivanja, za razliku od svih drugih odbojnih interakcija između popunjenih orbitala.
Mnoge organske reakcije su posledica interakcija punih i praznih orbitala. Mnoge takođe obuhvataju interakcije naelektrisanja. Nezavisno od tipa privlačenja između organskih molekula, u reakcijama dolazi do kretanja elektrona, koji se kreću sa jednog mesta na drugo. Detalji tog procesa se nazivaju mehanizmom reakcije.
- Protok elektrona
Većina organskih reakcija su polarne prirode. Elektroni prelaze sa jednog molekula na drugi tokom reakcije. Elektronski donor se naziva nukleofil, dok je akceptor elektrona elektrofil. Ti termini proizilaze iz ideje da je privlačenje naelektrisanja dominirajuća sila u reakcijama. Nukleofili ne reaguju sa nukleusom, nego sa praznim elektronskim orbitalama. Uprkos tome, elektrostatičko privlačenje i odbijanje mogu da imaju presudnu ulogu u određivanju toka procesa. Ako molekul ima pozitivno naelektrisanje, to je zbog toga što ima više protona u jezgrima nego elektrona oko njih.
Vidi još[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Logos 2017, str. 228. "Od sredine XIX veka organskim materijama nazvane su one koje sadrže ugljenik (C), izuzimajući neke jednostavne poput ugljen-dioksida".
- ^ Morrison Robert Thornton; Boyd Robert Neilson (2006). Organic chemistry. Engelwood Cliffs, New Jersey: Prentice Hall. ISBN 8120307658.
- ^ Roberts, John D.; Caserio, Marjorie C. (1964). Basic Principles of Organic Chemistry. W. A. Benjamin, Inc.
- ^ Richard F. & Daley, Sally J. Organic Chemistry, Online organic chemistry textbook.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I izd.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Friedrich Wöhler (1828). „Ueber künstliche Bildung des Harnstoffs”. Annalen der Physik und Chemie. 88 (2): 253—256. Bibcode:1828AnP....88..253W. doi:10.1002/andp.18280880206. Available in English at: Chem Team
- ^ R.L. Shriner; C.K.F. Hermann; T.C. Morrill; D.Y. Curtin & R.C. Fuson John (1997). The Systematic Identification of Organic Compounds. Wiley & Sons. ISBN 978-0-471-59748-3.
- ^ "Industrial polymers, chemistry of." Encyclopædia Britannica. 2006
Literatura[uredi | uredi izvor]
- R.L. Shriner; C.K.F. Hermann; T.C. Morrill; D.Y. Curtin & R.C. Fuson John (1997). The Systematic Identification of Organic Compounds. Wiley & Sons. ISBN 978-0-471-59748-3.
- Richard F. & Daley, Sally J. Organic Chemistry, Online organic chemistry textbook.
- Roberts, John D.; Caserio, Marjorie C. (1964). Basic Principles of Organic Chemistry. W. A. Benjamin, Inc.
- Logos, Aleksandar A. (2017). Putovanje misli : uvod u potragu za istinom. Beograd.
Spoljašnje veze[uredi | uredi izvor]
- MIT.edu, OpenCourseWare: Organic Chemistry I
- HaverFord.edu, Organic Chemistry Lectures, Videos and Text
- Organic-Chemistry.org, Organic Chemistry Portal - Recent Abstracts and (Name) Reactions
