Hemijska supstanca

Hemijska supstanca, supstancija ili tvar[1] je oblik postojanja materije.[2] To je čulima dostupan oblik materije.[3][4] Neke reference dodaju da se hemijska supstanca ne može razdvojiti na sastavne elemente fizičkim metodama razdvajanja, tj. bez prekidanja hemijskih veza.[5]
Karakteriše je masa mirovanja. Sastoji se od veoma sitnih čestica — atoma.[6] Danas je poznato oko 17 miliona različitih supstanci. Od tolikog broja supstanci, oko 100 hiljada ima praktičnu primenu. Neke supstance nalaze se u prirodi, dok se druge proizvode veštačkim putem.
Svaka supstanca ima karakteristična svojstva po kojima se razlikuje od drugih supstanci, na primer: boju, miris, gustinu, temperaturu topljenja, temperaturu ključanja. Navedena svojstva supstanci, koja se određuju pomoću naših čula ili instrumenata, nazivaju se fizička svojstva. Hemijska svojstva supstanci ispoljavaju se pri njihovim reakcijama sa drugim supstancama. Osnovni zadatak hemije je izučavanje supstanci — njihove strukture, svojstava, kao i promena koje dovode do pretvaranja jednih supstanci u druge.[7]
Sva materijalna tela su izgrađena od supstance. Još u vreme starih Grka smatralo se da postoje osnovni delići, čestice supstance, od kojih su sagrađena sva tela. Razmatrano je sledeće pitanje: Ukoliko bi se neko telo delilo na sve manje i manje delove, da li bi se to moglo raditi beskonačno? Izneta je pretpostavka da bi u jednom momentu došli do dela koji ne možemo dalje podeliti. Na taj način je nastala ideja o najmanjim česticama od kojih se sva tela sastoje — atoma.
Definicija[uredi | uredi izvor]

Hemijska supstanca se u uvodnom udžbeniku opšte hemije može definisati kao „bilo koji materijal sa određenim hemijskim sastavom“.[7] Prema ovoj definiciji, hemijska supstanca može biti ili čisti hemijski element ili čisto hemijsko jedinjenje. Međutim, postoje izuzeci od ove definicije; čista supstanca se takođe može definisati kao oblik materije koji ima i određeni sastav i različita svojstva.[8] Indeks hemijskih supstanci koji je objavio CAS takođe uključuje nekoliko legura neizvesnog sastava.[9] Nestehiometrijska jedinjenja su poseban slučaj (u neorganskoj hemiji) koji krši zakon stalnog sastava i za njih je ponekad teško povući granicu između smeše i jedinjenja, kao u slučaju paladijum hidrida. Šire definicije hemikalija ili hemijskih supstanci su isto tako dostupne, na primer: „izraz hemijska supstanca označava bilo koju organsku ili neorgansku supstancu određenog molekularnog identiteta, uključujući - (i) bilo koju kombinaciju takvih supstanci koja se u celini ili delimično javlja kao rezultat hemijske reakcije ili nastaje u prirodi”.[10]
Istorija[uredi | uredi izvor]
Početno širenje univerzuma u Velikom prasku, od pre oko 13,8 milijardi godina, rezultiralo je zvezdama koje su tokom vremena stvorile niz hemijskih elemenata u svojim supstancama, u rasponu od vodonika do oganesona.
Koncept „hemijske supstance“ čvrsto se uspostavio krajem osamnaestog veka nakon rada hemičara Žozefa Prusta[11] na sastavu nekih čistih hemijskih jedinjenja kao što je bazni bakar karbonat.[12] On je zaključio da „Svi uzorci jedinjenja imaju isti sastav; to jest, svi uzorci imaju iste proporcije, po masi, elemenata prisutnih u jedinjenju.” Ovo je sada poznato kao zakon stalnog sastava.[13] Kasnije sa napretkom metoda za hemijsku sintezu, posebno u oblasti organske hemije; otkrićem mnogo više hemijskih elemenata i novih tehnika u oblasti analitičke hemije[14] koji se koriste za izolaciju i prečišćavanje elemenata i jedinjenja došlo do uspostavljanja savremene hemije, koncept je definisan onako kako se nalazi u većini udžbenika hemije. Međutim, postojale su neke kontroverze u vezi sa ovom definicijom, uglavnom zato što je veliki broj hemijskih supstanci prijavljenih u hemijskoj literaturi trebalo indeksirati.
Hemijski elementi[uredi | uredi izvor]

Element je hemijska supstanca sačinjena od određene vrste atoma i stoga se ne može razgraditi ili transformisati hemijskom reakcijom u drugi element, iako se može pretvoriti u drugi element nuklearnom reakcijom. To je zato što svi atomi u uzorku elementa imaju isti broj protona, iako mogu postojati različiti izotopi, sa različitim brojem neutrona.
Prema podacima od 2019. godine postoji 118 poznatih elemenata, od kojih je oko 80 stabilno - to jest, oni se ne menjaju radioaktivnim raspadom u druge elemente. Neki elementi se mogu pojaviti kao više od jedne hemijske supstance (alotropi). Na primer, kiseonik postoji i kao dvoatomni kiseonik (O2) i kao ozon (O3). Većina elemenata je klasifikovana kao metali. To su elementi sa karakterističnim sjajem poput gvožđa, bakra i zlata. Metali obično dobro provode električnu energiju i toplotu, a kovani su i duktilni.[15] Otprilike desetak elemenata,[16] poput ugljenika, azota i kiseonika, klasifikovano je kao nemetali. Nemetali nemaju gore opisana metalna svojstva, takođe imaju visoku elektronegativnost i sklonost stvaranju negativnih jona. Određeni elementi, poput silicijuma, ponekad podsećaju na metale, a ponekad na nemetale, i poznati su kao metaloidi.
Hemikalije u odnosu na hemijske supstance[uredi | uredi izvor]

Dok je izraz hemijska supstanca precizan tehnički izraz koji je sinonim za hemikalije za hemičare, reč hemikalija se u opštoj upotrebi u koristi za označavanje (čistih) hemijskih supstanci i smeša (često nazivanih jedinjenja),[17] a posebno kada se proizvode ili prečišćavaju u laboratoriji ili industrijskom procesu.[18][19][20] Drugim rečima, hemijske supstance od kojih je na primer voće i povrće prirodno sastavljeno, čak i kada raste u divljini, generalno se ne nazivaju „hemikalijama“. U zemljama koje zahtevaju listu sastojaka u proizvodima, navedene „hemikalije“ su industrijski proizvedene „hemijske supstance“. Reč „hemikalija” se takođe često koristi za označavanje droga koje izazivaju zavisnost, opojne droge ili lekovi koji menjaju um.[18][19]
Imenovanje i indeksiranje[uredi | uredi izvor]
Hemičari se često pozivaju na hemijska jedinjenja koristeći hemijske formule ili molekularnu strukturu jedinjenja. Došlo je do fenomenalnog porasta broja hemijskih jedinjenja koja su sintetisana (ili izolovana), a zatim su o njima izveštili u naučnoj literaturi profesionalni hemičari širom sveta.[21] Ogroman broj hemijskih jedinjenja moguć je hemijskom kombinacijom poznatih hemijskih elemenata. Prema podacima iz februara 2021. godine, oko „177 miliona organskih i neorganskih supstanci” (uključujući 68 miliona biopolimera definisanog niza) nalazi se u naučnoj literaturi i registrovano je u javnim bazama podataka.[22] Imena mnogih ovih jedinjenja često su netrivijalna i stoga ih nije lako zapamtiti, mada postoji više načina preciznog imenovanja jedinjenje u oblicima razumljivim za ljude, kao i u oblicima podesnim za računarsku obradu. Nekoliko međunarodnih organizacija, poput IUPAC-a i CAS-a, pokrenule su korake za olakšavanje takvih zadataka. CAS pruža usluge sakupljanja hemijske literature i obezbeđuje numerički identifikator, poznat kao CAS registarski broj, za svaku hemijsku supstancu koja je prijavljena u hemijskoj literaturi (kao što su časopisi za hemiju i patenti). Ovi podaci su sastavljeni kao baza podataka i popularno su poznati kao indeks hemijskih supstanci. Drugi kompjuterski prilagođeni sistemi koji su razvijeni za dobijanje informacija o supstanci su: SMILES i Međunarodni hemijski identifikator ili InChI.
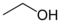
| Ustaljeni naziv | Sistematski naziv | Hemijska formula | Hemijska struktura | CAS registarski broj | InChI |
|---|---|---|---|---|---|
| Alkohol, ili etil alkohol |
Etanol | C2H5OH | [64-17-5] | 1/C2H6O/c1-2-3/h3H,2H2,1H3 |
Izvori[uredi | uredi izvor]
- ^ „Šta znači Supstanca”. staznaci.com. Pristupljeno 2021-12-16.
- ^ IUPAC. „Chemical Substance”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Hale, Bob (2013-09-19). Necessary Beings: An Essay on Ontology, Modality, and the Relations Between Them (na jeziku: engleski). Oxford: Oxford University Press. ISBN 9780191648342. Arhivirano iz originala 2018-01-13. g.
- ^ IUPAC. „Chemical Substance”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Hunter, Lawrence E. (2012-01-13). The Processes of Life: An Introduction to Molecular Biology (na jeziku: engleski). MIT Press. ISBN 9780262299947. Arhivirano iz originala 2018-01-13. g.
- ^ Scerri, Eric (2005). „Simples and Compounds”. www.iupac.org. Pristupljeno 15. 5. 2018.
- ^ a b Hill, J. W.; Petrucci, R. H.; McCreary, T. W.; Perry, S. S. General Chemistry, 4th ed., pp. 5, Pearson Prentice Hall, Upper Saddle River, New Jersey, 2005
- ^ „Pure Substance – DiracDelta Science & Engineering Encyclopedia”. Diracdelta.co.uk. Arhivirano iz originala 2013-05-11. g. Pristupljeno 2013-06-06.
- ^ Appendix IV: Chemical Substance Index Names Arhivirano 2007-12-03 na sajtu Wayback Machine
- ^ „What is the TSCA Chemical Substance Inventory?”. US Environmental Protection Agency. Arhivirano iz originala 2009-06-05. g. Pristupljeno 2009-10-19.
- ^ Chisholm, Hugh, ur. (1911). „Proust, Joseph Louis”. Encyclopædia Britannica (na jeziku: engleski). 22 (11 izd.). Cambridge University Press.
- ^ Hill, J. W.; Petrucci, R. H.; McCreary, T. W.; Perry, S. S. General Chemistry, 4th ed., pp. 37, Pearson Prentice Hall, Upper Saddle River, New Jersey, 2005.
- ^ Law of Definite Proportions Arhivirano 2007-11-18 na sajtu Wayback Machine
- ^ Skoog, Douglas A.; West, Donald M.; Holler, F. James; Crouch, Stanley R. (2014). Fundamentals of Analytical Chemistry. Belmont: Brooks/Cole, Cengage Learning. str. 1. ISBN 978-0-495-55832-3.
- ^ Hill, J. W.; Petrucci, R. H.; McCreary, T. W.; Perry, S. S. General Chemistry, 4th ed., pp 45–46, Pearson Prentice Hall, Upper Saddle River, New Jersey, 2005.
- ^ The boundary between metalloids and non-metals is imprecise, as explained in the previous reference.
- ^ compound Arhivirano 2017-11-07 na sajtu Wayback Machine in Oxford Online Dictionaries
- ^ a b chemical Arhivirano 2017-11-07 na sajtu Wayback Machine in Oxford Online Dictionaries
- ^ a b Random House Unabridged Dictionary Arhivirano 2017-11-07 na sajtu Wayback Machine, 1997
- ^ „What is a chemical”. Nicnas.gov.au. 2005-06-01. Arhivirano iz originala 2013-06-16. g. Pristupljeno 2013-06-06.
- ^ Schummer, Joachim. „Coping with the Growth of Chemical Knowledge: Challenges for Chemistry Documentation, Education, and Working Chemists”. Rz.uni-karlsruhe.de. Arhivirano iz originala 2013-09-17. g. Pristupljeno 2013-06-06.
- ^ „Chemical Abstracts substance count”. Cas.org. Pristupljeno 15. 2. 2021.
Literatura[uredi | uredi izvor]
- Skoog, Douglas A.; West, Donald M.; Holler, F. James; Crouch, Stanley R. (2014). Fundamentals of Analytical Chemistry. Belmont: Brooks/Cole, Cengage Learning. str. 1. ISBN 978-0-495-55832-3.
- Oerter, Robert (2006). The Theory of Almost Everything: The Standard Model, the Unsung Triumph of Modern Physics. Penguin. str. 223. ISBN 978-0-452-28786-0.
- Ball, P (2004). The Elements: A Very Short Introduction. Oxford University Press. ISBN 978-0-19-284099-8.
- Emsley, J (2003). Nature's Building Blocks: An A-Z Guide to the Elements. Oxford University Press. ISBN 978-0-19-850340-8.
- Gray, T (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. Black Dog & Leventhal Publishers Inc. ISBN 978-1-57912-814-2.
- Pauling, Linus (1988). General chemistry. Mineola, NY: Dover Publications, Inc. ISBN 978-0-486-65622-9.
- Scerri, ER (2007). The Periodic Table, Its Story and Its Significance. Oxford University Press.
- Strathern, P (2000). Mendeleyev's Dream: The Quest for the Elements. Hamish Hamilton Ltd. ISBN 978-0-241-14065-9.
- Kean, Sam (2011). The Disappearing Spoon: And Other True Tales of Madness, Love, and the History of the World from the Periodic Table of the Elements. Back Bay Books.
- Gray, Theodore: Die Elemente, Fackelträger-Verlag, Köln. 2009. ISBN 978-3771644352.
- Ulf von Rauchhaupt: Die Ordnung der Stoffe. Ein Streifzug durch die Welt der chemischen Elemente. Fischer Taschenbuch Verlag, Frankfurt am Main. 2009. ISBN 978-3-596-18590-0.
- Binder, Harry H. (1999). Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. Stuttgart. ISBN 978-3-7776-0736-8.
- Trueb, Lucien F. (2005). Die chemischen Elemente – Ein Streifzug durch das Periodensystem. Stuttgart: S. Hirzel Verlag. ISBN 978-3-7776-1356-7.
- Wimmer, Alexander C. (2011). Die chemischen Elemente. Leoben: SMT. ISBN 978-3-2000-2434-2.
- Mendeleev D. I.,. Эlementы himičeskie // Эnciklopedičeskiй slovarь Brokgauza i Efrona: V 86 tomah (82 t. i 4 dop.). — SPb., 1890—1907.
- Černobelьskaя G. M. Metodika obučeniя himii v sredneй škole. — M.: Gumanitarnый izdatelьskiй centr VLADOS, — 336 s. 2000. ISBN 5-691-00492- nevažeći ISBN.
Spoljašnje veze[uredi | uredi izvor]
 Mediji vezani za članak Hemijska supstanca na Vikimedijinoj ostavi
Mediji vezani za članak Hemijska supstanca na Vikimedijinoj ostavi