Hemijska formula


Hemijska formula ili molekulska formula je formula koja pokazuje vrstu i broj atoma koji čine neki molekul. Molekulske formule su oznake hemijskih jedinjenja, oblik prikazivanja njihovih molekula; pored kvalitativnog sastava, one pokazuju i kvantitativni odnos atoma koji sačinjavaju molekul hemijskog jedinjenja. Formule se izražavaju hemijskim znacima; npr. molekul hemijskog jedinjenja vode sastavljen je od dva atoma vodonika i jednog atoma kiseonik, pa je molekulska formula vode H2O. Pored toga, molekulske formule, na osnovu poznatih atomskih masa i valentnosti, pokazuju odnos masa atoma koji izgrađuju jedinjenja (u ovom slučaju 18 grama vode sastoji se od 2 grama vodonika i 16 grama kiseonika).
Molekulske formule ne pokazuju unutrašnju strukturu molekula, pa se zato, naročito u organskoj hemiji, primenjuju racionalne formule i strukturne formule. Racionalnim formulama se, u stvari, skraćenim načinom pokazuje kako su povezani atomi u molekulu npr. molekulska formula etil-alkohola je C2H6O, dok će njegova racionalna formula biti C2H5OH. Strukturne hemijske formule pokazuju, pored kvalitativnog i kvantitativnog sastava molekula jednog hemijskog jedinjenja, još i način na koji su atomi i atomske grupe u molekulima međusobno povezani. Strukturna formula etil-alkohola izgleda ovako:
Pregled[uredi | uredi izvor]
Hemijska formula je jedan od načina predstavljanja informacija o hemijskim proporcijama atoma koji čine određeno hemijsko jedinjenje ili molekul, koristeći simbole hemijskih elemenata, brojeve, a ponekad i druge simbole, poput umetanja, crtica, zagrada, zareza i znakova plus (+) i minus (–). Oni su ograničeni na jednu tipografsku liniju simbola, koja može uključivati indekse i natpise. Hemijska formula nije hemijski naziv i ne sadrži reči. Iako hemijska formula može podrazumevati određene jednostavne hemijske strukture, to nije isto što i puna hemijska strukturna formula. Hemijske formule mogu u potpunosti odrediti strukturu samo najjednostavnijih molekula i hemijskih supstanci, i uglavnom su ograničenije snage od hemijskih imena i strukturnih formula.
Najjednostavnije vrste hemijskih formula nazivaju se empirijske formule, koje koriste slova i brojeve koji označavaju numeričke proporcije atoma svake vrste. Molekulske formule označavaju jednostavne brojeve svake vrste atoma u molekulu, bez podataka o strukturi. Na primer, empirijska formula za glukozu je CH2O (dvostruko više atoma vodonika od ugljenika i kiseonika), dok je njegova molekulska formula.
Hemijska formula je zapis sastava hemijskog jedinjenja pomoću hemijskih simbola. Hemijska formula može biti:
- Empirijska formula, koja navodi elemente jedinjenja u njihovom međusobnom odnosu. Primer: CnH2n; u jedinjenju označava odnos vodonika i ugljenika 1:2. Jedinjenja s takvim sastavom su obično velika, npr. svi alkeni ili cikloalkani.
- Strukturna formula, koja uz odnos pojedinog jedinjenja navodi valenciju i raspored atoma u molekulu.
- Molekulska formula, koja navodi broj atoma elementa u pojedinom jedinjenju. Primer: butan - C4H10
Definicija[uredi | uredi izvor]
| Aluminijum sulfat ima hemijsku formulu Al2(SO4)3. Oblik aluminijum-sulfat heksadekahidrata je Al2(SO4)3·16 H2O. |
Hemijska formula je jedan od načina predstavljanja informacija o hemijskim proporcijama atoma koji čine određeno hemijsko jedinjenje ili molekul, koristeći simbole hemijskih elemenata, brojeve, a ponekad i druge simbole, poput umetanja, crtica, zagrada, zareza i znakova plus (+) i minus (–). Oni su ograničeni na jednu tipografsku liniju simbola, koja može uključivati indekse i natpise. Hemijska formula nije hemijski naziv i ne sadrži reči. Iako hemijska formula može podrazumevati određene jednostavne hemijske strukture, to nije isto što i puna hemijska strukturna formula. Hemijske formule mogu u potpunosti odrediti strukturu samo najjednostavnijih molekula i hemijskih supstanci, i uglavnom su ograničenije snage hemijskih imena i strukturnih formula.[1][2]
Najjednostavnije vrste hemijskih formula nazivaju se empirijske formule, koje koriste slova i brojeve koji označavaju numeričke proporcije atoma svake vrste. Molekulske formule označavaju jednostavne brojeve svake vrste atoma u molekulu, bez podataka o strukturi. Na primer, empirijska formula za glukozu je CH2O (dvostruko više atoma vodonika od ugljenika i kiseonika), dok je njegova molekulska formula.
Tako npr. formula H2O označava molekul vode, koja se sastoji od dvaju atoma vodonika (H) i jednog atoma kiseonika (O).
| Jedinjenje | Empirijska formula | Molekulska formula | Sažeta strukturna formula | Strukturna formula | Projekcijska formula |
|---|---|---|---|---|---|
| Hlorovodonik | HCl | HCl | HCl | HCl | |
| Acetatna kiselina | CH2O | C2H4O2 | CH3-CO-OH |  |
|
| Etin | CH | C2H2 | HCΞCH | H-CΞC-H | |
| Benzen | CH | C6H6 | 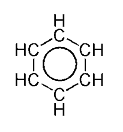 |
 |
|
| Etanol | C2H6O | C2H6O | CH3-CH2-OH |  |
|
| Metoksimetan | C2H6O | C2H6O | CH3-O-CH3 |  |
|
| Mlečna kiselina | CH2O | C3H6O3 | CH3-CH(OH)-COOH |  |
|
| Glukoza | CH2O | C6H12O6 | HOCH2-[CH(OH)]4-CHO | 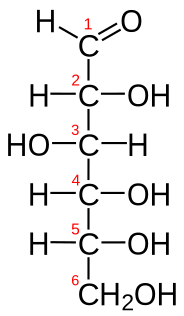 Fischerova Fischerova |

|
Formulska jedinica[uredi | uredi izvor]
Formulsku jedinica je najmanji odnos broja anjona i katjona u jonskom jedinjenju koji se prikazuje formulom jedinjenja. Jonska materija je ogroman skup anjona i katjona koji su povezani jonskom vezom (elektrostatskom). U jonskoj materiji naizmenično su raspoređeni anjoni i katjoni, odnosno svaki anjon je okružen određenim brojem katjona i obrnuto. Ne postoji molekul jonskog jedinjenja već je celo jedinjenje jedan „veliki molekul”. Zato formula jonskog jedinjenja ima samo najmanji odnos broja anjona i katjona u jedinjenju, odnosno prikazuje formulsku jedinku. Formula CaCl2 govori da se u kalcijum hloridu katjoni (Ca2+) i anjoni (Cl–) nalaze u odnosu 1:2 te je CaCl2 formulska jedinka kalcijum hlorida.[3][4]
U najširem smislu svaka formula predstavlja formulsku jedinku.
Formule hidratnih soli[uredi | uredi izvor]
Kristali hidratnih soli imaju u sastavu vezanu kristalnu vodu. Formula jedinjenja se piše, na primer: CuSO4∙5H2O. Tačka u formuli ne predstavlja znak množenja već je znak sabiranja (plus). Voda je uklopljena u kristalnu strukturu jedinjenja. Napisana formula je sažeti oblik pisanja. Zapravo formulu bi pravilnije trebalo pisati kao: [Cu(H2O)4]SO4∙H2O. Četiri molekula vode se koordiniraju s jonom bakra, dok je peti molekul vode povezan sa sulfatnim jonom. Takođe, MgSO4∙7H2O zapravo je [Mg(H2O)6]SO4∙H2O. Uglaste zagrade u pisanju koriste se za kreiranje formula kompleksnih jedinjenja.
Formule kompleksnih jedinjenja[uredi | uredi izvor]
Formule kompleksnih jedinjenja, sažeto se pišu kao u prethodnim primerima, ali najprizornije je formulu prikazati „trodimenziono”.
-
Bakar tetraaminosulfat hidtat [Cu(NH3)4]SO4·H2O
-
Rodijum pentaminotrihlorid [Rh(NH3)5Cl]Cl2
Tipovi hemijskih formula[uredi | uredi izvor]
Hemijske formule razlikuju se prema informacijama koje pružaju.
- Formula elementarne materije predočava molekul odnosno skup istovrsnih atoma koji se nalaze u molekulu elementarne materije (H2, P4, S8)
- Empirijska formula pokazuje samo relativne odnose broja pojedinih atoma u jedinki, a određuje se na temelju masenih udela pojedinih elemenata u spoju dobivenih elementarnom analizom.
- Molekulska formula pokazuje tačan broj atoma u jedinjenju (molekuli), a određuje se iz empirijske formule i poznate molekulske mase.
- Strukturna formula prikazuje način povezivanja atoma u molekulu, a određuje se nakon identifikacije funkcionalnih grupa molekula (alkoholna, aldehidna, kiselinska, aminska i drugo), najčešće spektroskopskim tehnikama.
- Sažeta strukturna formula je strukturna formula napisana jednostavnije, često u jednom redu, prikazane su atomske grupe i atomi ali način njihovog povezivanja nije potpuno jasan.
- Stereohemijska formula prikazuje prostornu orijentaciju atoma u molekulu različitim tipovima projekcija koje uključuju mnoge dodatne konvencije. Prostorni raspored atoma neposredno se određuje difrakcijskim metodima strukturne analize.
Zakon o kompoziciji[uredi | uredi izvor]
U bilo kom datom hemijskom jedinjenju, elementi se uvek međusobno kombinuju u istoj proporciji. Ovo je zakon stalnih odnosa masa.
Zakon konstantnog sastava navodi da će se u bilo kom određenom hemijskom jedinjenju svi uzorci tog jedinjenja sastojati od istih elemenata u istoj proporciji ili odnosu. Na primer, bilo koji molekul vode se uvek sastoji od dva atoma vodonika i jednog atoma kiseonika u odnosu 2: 1. Ako se pogledaju relativne mase kiseonika i vodonika u molekulu vode, vidi se da 94% mase molekula vode čini kiseonik, a preostalih 6% je masa vodonika. Ova masena proporcija biće ista za bilo koji molekul vode.[5]
Hemijska imena kao odgovor na ograničenja hemijskih formula[uredi | uredi izvor]
Alken zvan but-2-en ima dva izomera, koje hemijska formula CH3CH=CHCH3 ne identifikuje. Relativni položaj dve metilne grupe mora biti naznačen dodatnim zapisom koji označava da li su metilne grupe na istoj strani dvostruke veze (cis ili Z) ili na suprotnim stranama jedna od druge (trans ili E).[6]
Kao što je gore pomenuto, da bi se predstavile pune strukturne formule mnogih složenih organskih i neorganskih jedinjenja, moguće je da je potrebna hemijska nomenklatura koja prevazilazi raspoložive resurse koji su gore korišćeni u jednostavnim kondenzovanim formulama. Primeri se mogu videti u IUPAC nomenklaturi organske hemije i IUPAC nomenklaturi neorganske hemije 2005. Pored toga, linearni sistemi imenovanja, poput Međunarodnog hemijskog identifikatora (InChI), omogućavaju računaru da konstruiše strukturnu formulu, a pojednostavljeni sistem za linijski unos molekula (SMILES) omogućava ASCII unos čitljiviji čoveku. Međutim, svi ovi sistemi nomenklature prevazilaze standarde hemijskih formula, i tehnički su sistemi imenovanja hemikalija, a ne sistemi formula.
Polimeri u kondenzovanom formulama[uredi | uredi izvor]
Za polimere u kondenzovanim hemijskim formulama, zagrade se postavljaju oko jedinice koja se ponavlja. Na primer, molekul ugljovodonika koji je opisan kao CH3(CH2)50CH3, molekul je sa pedeset ponavljajućih jedinica. Ako je broj ponavljajućih jedinica nepoznat ili promenljiv, slovo n se može koristiti za označavanje ove formule: CH3(CH2)nCH3.
Joni u kondenzovanim formulama[uredi | uredi izvor]
Za jone, naelektrisanje na određenom atomu može se označiti natpisom sa desne strane. Na primer, Na+ ili Cu2+. Na ovaj način može se prikazati i ukupan naboj na naelektrisanom molekulu ili poliatomskom jonu. Na primer: H3O+ ili SO42−. Treba imati na umu da se + i - koriste umesto +1 i -1, respektivno.
Za složenije jone, zagrade [ ] se često koriste za zatvaranje jonske formule, kao u [B12H12]2−, koja se nalazi u jedinjenjima kao što je Cs2[B12H12]. Zagrade ( ) se mogu ugnezditi u zagrade da označe ponavljajuću jedinicu, kao u [Co(NH3)6]3+Cl3−. Ovde, (NH3)6 ukazuje da jon sadrži šest NH3 grupa vezanih za kobalt i [ ] obuhvata celu formulu jona sa naelektrisanjem +3.
Ovo je strogo opciono; hemijska formula je važeća sa ili bez informacija o jonizaciji, a heksaminkobalt(III) hlorid se može zapisati kao [Co(NH3)6]3+Cl3− ili [Co(NH3)6]Cl3. Ugaone zagrade se, poput zagrada, ponašaju u hemiji kao u matematici, grupišući pojmove - one nisu posebno primenjeni samo za stanja jonizacije. U ovom poslednjem slučaju, zagrade ukazuju na 6 grupa svih istog oblika, vezanih za drugu grupu veličine 1 (atom kobalta), a zatim je ceo snop, kao grupa, vezan za 3 atoma hlora. U prvom slučaju je jasnije da je veza koja povezuje atome hlore jonska, a ne kovalentna.
Vidi još[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Burrows, Andrew (2013-03-21). Chemistry : introducing inorganic, organic and physical chemistry (Second izd.). Oxford. ISBN 978-0-19-969185-2. OCLC 818450212.
- ^ Chai, Yan; Guo, Ting; Jin, Changming; Haufler, Robert E.; Chibante, L. P. Felipe; Fure, Jan; Wang, Lihong; Alford, J. Michael; Smalley, Richard E. (1991). „Fullerenes wlth Metals Inside”. Journal of Physical Chemistry. 95 (20): 7564—7568. doi:10.1021/j100173a002.
- ^ Edwin A. Hill (1900). „On a system of indexing chemical literature; Adopted by the Classification Division of the U.S. Patent Office”. J. Am. Chem. Soc. 22 (8): 478—494. doi:10.1021/ja02046a005. hdl:2027/uiug.30112063986233.
- ^ Wiggins, Gary. (1991). Chemical Information Sources. New York: McGraw Hill. p. 120.
- ^ „Law of Constant Composition”. Everything Math and Science. SIYAVULA. Pristupljeno 31. 3. 2016.
 This material is available under a Creative Commons Attribution-Share Alike 3.0 license.
This material is available under a Creative Commons Attribution-Share Alike 3.0 license.
- ^ Burrows, Andrew (2013-03-21). Chemistry³ : introducing inorganic, organic and physical chemistry (Second izd.). Oxford. ISBN 978-0-19-969185-2. OCLC 818450212.
Literatura[uredi | uredi izvor]
- Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). „3”. General chemistry: principles and modern applications (8th izd.). Upper Saddle River, N.J: Prentice Hall. ISBN 978-0-13-014329-7. LCCN 2001032331. OCLC 46872308.
Spoljašnje veze[uredi | uredi izvor]
- Hill notation example, from the University of Massachusetts Lowell libraries, including how to sort into Hill system order
- Molecular formula calculation applying Hill notation. The library calculating Hill notation is available on npm.

![Bakar tetraaminosulfat hidtat [Cu(NH3)4]SO4·H2O](http://upload.wikimedia.org/wikipedia/commons/thumb/2/2f/Tetraminkupfersulfathydrat.png/120px-Tetraminkupfersulfathydrat.png)
![Rodijum pentaminotrihlorid [Rh(NH3)5Cl]Cl2](http://upload.wikimedia.org/wikipedia/commons/thumb/8/8d/%28RhA5Cl%29Cl2.png/120px-%28RhA5Cl%29Cl2.png)
