Циклоалкан

Циклоалкани су засићени циклични угљоводоници код којих су сви угљеникови атоми везани једноструким везама. Општа формула ових једињења је CnH2n (циклоалкани садрже два атома водоника мање од алкана због тога што граде прстен).[1][2][3]
Величина прстена код циклоалкана може бити доста различита. Величина прстена зависи од броја угљеникових атома. Данас су позната једињења са преко 40 угљеникових атома.
Номенклатура циклоалкана[уреди | уреди извор]
Циклоалкани добијају имена тако што се испред имена алкана са истим бројем угљеникових атома дода префикс -цикло. Циклоалкани се упрошћено могу преказивати преко геометријских слика. Тако да се циклопропан представља једнакостраничним троуглом, циклобутан квадратом, циклопентан петоуглом, итд. Обично се приказује само скелет угљеникових атома и подразумева се да су на сваком углу везана по два водоникова атома.
CH2 H2C-CH2 H2C-CH2
/ \ | | / \
H2C-CH2 H2C-CH2 H2C CH2
\ /
CH2

|
|---|
| циклохексан | метилциклопентан | 1,2-диетилциклохексан |
|---|
Налажење и добијање[уреди | уреди извор]
Циклопентан, циклохексан, метилциклопентан и метилциклохексан се налазе у нафти и због тога су у индустрији нафте познати под називом нафтени. У природи су најраспрострањенија једињења са петочланим и шесточланим прстеновима.
Циклоалкани се лабораторијски добијају елиминацијом халогена из дихалогеноалкана
CH2-CH2
Cl-CH2-CH2-CH2-Cl + Zn → \ /
CH2
Физичке особине[уреди | уреди извор]
Физичке особине циклоалкана су веома сличне физичким особинама алкана. Температура кључања расте са повећањем броја угљеникових атома.
| име | температура кључања | температура топљења |
| циклопропан | 33°C | -127°C |
| циклобутан | 13°C | - 90°C |
| циклопентан | 49°C | -94°C |
| циклохексан | 81°C | 7°C |
Хемијске особине[уреди | уреди извор]
Циклоалкани показују идентичне хемијске особине као и алкани с том разликом што су циклоалкани са малим прстеном (циклопропан, циклобутан) доста реактивнији од осталих.
Тако нпр. циклопропан реагује са водоником у присуству катализатора (Ni) и даје пропан.
На исти начин он реагује са бромом и бромоводоником
→ CH2CH2CH2 | | Br Br
Општи тип адиционих реакција изгледа овако:
R-CH=CH-R' + CH2N2 → R-CH---CH-R
\ /
CH2
Циклобутан је стабилнији од циклопропана али је такође доста реактиван и подлеже адиционим реакцијама.
Циклопентан и циклохексан су веома постојани тако да не реагују са водоником ни на високим температурама (преко 200°C).
Cis и trans изомерија[уреди | уреди извор]
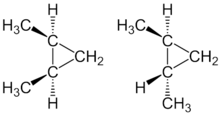
Cis-trans изомерија је могућа код дисуституисаних циклоалкана јер је услед затварања прстена створана доста крута структура од две С-Н везе. Тако диметилциклопропан постоји у два просторна изомера. Као Cis изомер и као trans изомер.
Овај тип изомерије се јавља и код алкена с тим што се сви супституенти налазе у равни, само различито оријентисани на двоструку везу, а код циклоалкана супституенти се налазе испод и изнад равни.
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ Хемија за 3 разред гимназије природно математичког смера, медицинске, ветеринарске и школе за негу лепоте - Александра Стојиљковић
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.




