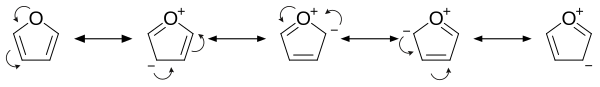Furan
| |||

| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
Furan
| |||
| Drugi nazivi | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.003.390 | ||
| KEGG[2] | |||
| |||
| Svojstva | |||
| C4H4O | |||
| Molarna masa | 68,07 g/mol | ||
| Agregatno stanje | bezbojna, isparljiva tečnost | ||
| Gustina | 0,936 g/mL | ||
| Tačka topljenja | -85.6 °C | ||
| Tačka ključanja | 31.4 °C | ||
| Opasnosti | |||
| Tačka paljenja | -35 °C | ||
| Srodna jedinjenja | |||
Srodne heterociklično jedinjenje
|
Pirol Tiofen | ||
Srodna jedinjenja
|
Tetrahidrofuran (THF) 2,5-Dimetilfuran Benzofuran Dibenzofuran | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Furan je heterociklično organsko jedinjenje, koje se sastoji od petočlanog aromatičnog prstena sa četiri ugljenika i jednim kiseonikom. Klasa jedinjenja koje sadrži ovaj prsten se nazivaju furanima.[5][6]
Furan je bezbojna, zapaljiva, visoko isparljiva tečnost sa tačkom ključanja blizo sobne temperature. On je toksičan i karcinogen. Furan se koristi kao početni materijal za sintezu drugih hemikalija.[7]
Proizvodnja[уреди | уреди извор]
Furan se industrijski proizvodi paladijum-katalizovanom dekarboksilacijom furfurala, ili bakrom-katalizovanom oksidacijom 1,3-butadiena.[7]
U laboratoriji se furan može dobiti iz furfurala oksidacijom do furan-2-karboksilne kiseline, i naknadnom dekarboksilacijom.[8]. On se takođe može pripremiti direktno termalnom dekompozicijom materijala koji sadrži pentozu, celuloznu masu, posebno drvo bora
Hemijske osobine[уреди | уреди извор]
Furan je aromatičan jer je jedan od slobodnih parova elektrona na atomu kiseonika delokalizovan u prstenu, čime se formira 4n+2 aromatični sistem (po Hukelovom pravilu) slično benzenu. Zbog aromatičnosti molekul je ravan i nema diskretne dvostruke veze. Drugi slobodni elektronski par atoma kiseonika je u ravni prstena. sp2 hibridizacija omogućava jednom slobodnom paru kiseonika da se nalazi u p orbitali i da stoga interaguje unutar pi-sistema.
Kao posledica aromatičnosti, furanovo ponašanje se veoma razlikuje od tipičnih heterocikličnih etara kao što je tetrahidrofuran.
- On je znatno reaktivniji od benzena u reakcijama elektrofilne supstitucije zbog elektron-donirajućih efekata kiseonikovog heteroatoma. Pregled rezonantnih doprinosa ukazuje na povećanu elektronsku gustinu prstena, što dovodi do povećane elektrofilne supstitucije.[9]
- Furan služi kao dien u Diels-Alderovim reakcijama sa elektron-deficitarnim dienofilima kao što je etil (E)-3-nitroacrilat.[10] Reakcioni produkt je mešavina izomera sa preferencijom za endo izomer:
- Hidrogenacija furana proizvodi dihidrofurane i tetrahidrofurane
- U Achmatowicz reakciji, furani se konvertuju u dihidropirane.
Vidi još[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ „Webster's Online Dictionary”. Архивирано из оригинала 09. 06. 2011. г. Приступљено 06. 08. 2011.
- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Katritzky A.R.; Pozharskii A.F. (2000). Handbook of Heterocyclic Chemistry (Second изд.). Academic Press. ISBN 0080429882.
- ^ а б H. E. Hoydonckx, W. M. Van Rhijn, W. Van Rhijn, D. E. De Vos, P. A. Jacobs (2005). „Furfural and Derivatives”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a12_119.pub2.
- ^ Wilson, W.C. (1941). „Furan”. Org. Synth.; Coll. Vol., 1, стр. 274
- ^ Bruice, Paula Y. (2007). Organic Chemistry (Fifth изд.). Upper Saddle River, NJ: Pearson Prentice Hall. ISBN 978-0-13-196316-0.
- ^ Masesane I, Batsanov A, Howard J, Modal R, Steel P (2006). „The oxanorbornene approach to 3-hydroxy, 3,4-dihydroxy and 3,4,5-trihydroxy derivatives of 2-aminocyclohexanecarboxylic acid”. Beilstein Journal of Organic Chemistry. 2 (9): 9. PMC 1524792
 . PMID 16674802. doi:10.1186/1860-5397-2-9.
. PMID 16674802. doi:10.1186/1860-5397-2-9.
Литература[уреди | уреди извор]
- Bruice, Paula Y. (2007). Organic Chemistry (Fifth изд.). Upper Saddle River, NJ: Pearson Prentice Hall. ISBN 978-0-13-196316-0.