Карбоксилна киселина

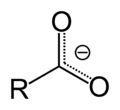

Карбоксилна киселина је органско једињење које у себи садржи функционалну карбоксилну групу (-COOH).[1] То је велика и разнолика група хемијских једињења, а други назив за њих су и органске киселине. Општа формула свих карбоксилних киселина је R-COOH, где R представља алкил групу, CnH2n. Најпростије карбоксилне киселине су тзв. алканске киселине код којих је радикал алкил група. Соли органских киселина се називају карбоксилати.[2][3]
Карбоксилна група је приближно тригонално-планарна. Изузетак су врло разблажени раствори када услед водоничног везивања, настају димери карбоксилних киселина.
Карбоксилне киселине реагују у многим процесима живих бића, међу којима је значајна и естерификација. У том процесу карбоксилне киселине реагују са органским једињењима које садрже хидроксилну групу (-ОН), односно алкохолима. Свакако најпознатији естри карбоксилних (масних) киселина су липиди.
Номенклатура[уреди | уреди извор]
Карбоксилне киселине се именују као алканске киселине, додатком наставка -ска киселина на назив алкана. Тако на пример од метана настаје метанска киселина.[4] Бројем 1 се обележава карбонилни угљеник најдужег низа у коме се налази карбоксилна група. Дикарбоксилне киселине се именују као алкан-дикиселине. Циклични и ароматични системи називају се циклоалканкарбоксилне и бензоеве киселине. Код ових система угљениковом атому за који је везана карбоксилна група приписује се број 1.
Иако постоји IUPAC-ова номенклатура, чешће се користе тривијални називи. На пример, бутаноична киселина се углавном назива бутерна киселина (C3H7CO2H).
Карбоксилни јон R-COO− се именује додавањем суфикса -ате, па од сирћетне киселине настаје ацетатни јон.
| Број угљеникових атома | Тривијални назив | Име по IUPAC-у | Структурна формула | Место налажења или употреба |
|---|---|---|---|---|
| 1 | Мравља киселина | Метанска киселина | HCOOH | Убод мрава |
| 2 | Сирћетна киселина | Етанска киселина | CH3COOH | Сирће |
| 3 | Пропионска киселина | Пропанска киселина | CH3CH2COOH | Презерватив |
| 4 | Бутерна киселина | Бутанска киселина | CH3(CH2)2COOH | Путер |
| 5 | Валеринска киселина | Пентанска киселина | CH3(CH2)3COOH | биљка Валеријана |
| 6 | Капронска киселина | Хексанска киселина | CH3(CH2)4COOH | Козја маст |
| 7 | Енантинска киселина | Хептанска киселина | CH3(CH2)5COOH | Мирис |
| 8 | Каприлна киселина | Октанска киселина | CH3(CH2)6COOH | Кокосова палма |
| 9 | Пеларгонска киселина | Нонанска киселина | CH3(CH2)7COOH | Биљка мушкатла |
| 10 | Капринска киселина | Деканска киселина | CH3(CH2)8COOH | Кокосово и уље палминих коштица |
| 11 | Ундеканска киселина | Ундеканска киселина | CH3(CH2)9COOH | Средство против гљивица |
| 12 | Лауринска киселина | Додеканска киселина | CH3(CH2)10COOH | Кокосово уље и сапуни за прање руку |
| 13 | Тридеканска киселина | Тридеканска киселина | CH3(CH2)11COOH | Биљни метаболит |
| 14 | Миристинска киселина | Тетрадеканска киселина | CH3(CH2)12COOH | Мушкатни орашчић |
| 15 | Пентадецилна киселина | Пентадеканска киселина | CH3(CH2)13COOH | Млечна маст |
| 16 | Палмитинска киселина | Хексадеканска киселина | CH3(CH2)14COOH | Палмино уље |
| 17 | Маргаринска киселина | Хептадеканска киселина | CH3(CH2)15COOH | Феромони разних животиња |
| 18 | Стеаринска киселина | Октадеканска киселина | CH3(CH2)16COOH | Чоколада, масти, сапуни и уља |
| 19 | Нонадесилна киселина | Нонадеканска киселина | CH3(CH2)17COOH | Масти, биљна уља, феромони |
| 20 | Арахидинска киселина | Икосаноинска киселина | CH3(CH2)18COOH | Уље од кикирикија |
| Класа једињења | Чланови |
|---|---|
| незасићене монокарбоксилне киселине | акрилна киселина (2-пропенска киселина) – CH2=CHCOOH, користи се у синтези полимера |
| Масне киселине | засићене и незасићене монокарбоксилне киселине са средњим до дугим ланцем, са парним бројем угљеника; примери: докозахексаеноинска киселина и еикозапентаеноинска киселина (прехрамбени суплементи) |
| Аминокиселине | градивни блокови протеина |
| Кето киселине | киселине са биохемијским значајем које садрже кетонске групе; примери: ацетосирћетна киселина и пирувинска киселина |
| Ароматичне карбоксилне киселине | садрже најмање један ароматични прстен; примери: бензојева киселина - натријумова со бензојеве киселине се користи као конзерванс за храну, салицилна киселина - бета-хидроксилни тип који се налази у многим производима за негу коже, фенил алканске киселине - класа једињења где је фенил група везана за карбоксилне киселине |
| Дикарбоксилне киселине | садрже две карбоксилне групе; примери: мономер адипинске киселине који се користи за производњу најлона и алдарне киселине – фамилија шећерних киселина |
| Трикарбоксилне киселине | садрже три карбоксилне групе; примери: лимунска киселина – присутна у цитрусном воћу и изолимунска киселина |
| Алфа хидроксилне киселине | садрже хидроксилну групу на првој позицији; примери: глицеринска киселина, гликолна киселина и млечна киселина (2-хидроксипропанска киселина) – присутна у киселом млеку, винска киселина – присутна у вину |
| Бета хидроксилне киселине | садрже хидроксилну групу на другој позицији |
| Омега хидроксилне киселине | садрже хидроксилну групу изван прве и друге позиције |
| Дивинилетарске масне киселине | садрже двоструко незасићени угљенични ланац везан етарском везом за масну киселину. Ове киселине су присутне у неким биљкама |
Физичка својства[уреди | уреди извор]
Растворљивост[уреди | уреди извор]
Карбоксилне киселине су поларне. Будући да су оне акцептори водоничне везе (карбонил –C=O) и донори водоничне везе (хидроксил –OH), оне такође учествују у водоничном везивању. Заједно, хидроксилна и карбонилна група творе функционалну карбоксилну групу. Карбоксилне киселине обично постоје као димери у неполарним медијима због њихове склоности да се „самоасоцирају”. Лакше карбоксилне киселине (1 до 5 угљеника) су растворљиве у води, док теже карбоксилне киселине имају ограничену растворљивост због повећане хидрофобне природе алкилног ланца. Ове киселине дужег ланца имају тенденцију да буду растворљиве у мање поларним растварачима као што су етри и алкохоли.[5] Водени натријум хидроксид и карбоксилне киселине, чак и хидрофобне, реагују дајући натријумове соли растворљиве у води. На пример, хептанска киселина има ниску растворљивост у води (0,2 g/L), али је њена натријумова со веома растворљива у води.

Тачке кључања[уреди | уреди извор]
Карбоксилне киселине имају тенденцију да имају веће тачке кључања од воде, због веће површине и склоности стварања стабилизованих димера путем водоничних веза. Да би дошло до кључања, било се везе димера морају прекинути или цео димеризовани аранжман мора испарити, чиме се значајно повећава неопхона енталпија испаравања.

Киселост[уреди | уреди извор]
Карбоксилне киселине су Бренстед-Лауријеве киселине, јер су донатори протона (H+). Оне су најчешћи тип органске киселине.
Карбоксилне киселине су типично слабе киселине, што значи да се само делимично дисоцирају на H3O+ катјоне и RCOO− анјоне у неутралном воденом раствору. На пример, на собној температури, у 1-моларном раствору сирћетне киселине, дисоцира се само 0,4% киселине. Супституенти који повлаче електроне, попут -CF3 групе, дају јаче киселине (pKa мравље киселине је 3,75, док трифлуоросирћетна киселина, са трифлуорометил супституентом, има pKa 0,23). Супституенти који донирају електроне дају слабије киселине (pKa мравље киселине је 3,75, док сирћетна киселина, са метил супституентом, има pKa 4,76)
| Карбоксилна киселина[6] | pKa |
|---|---|
| Сирћетна киселина (CH3CO2H) | 4,76 |
| Бензојева киселина (C6H5CO2H) | 4,2 |
| Мравља киселина (HCOOH) | 3,75 |
| Хлоросирћетна киселина (CH2ClCO2H) | 2,86 |
| Дихлороасирћетна киселина (CHCl2CO2H) | 1,29 |
| Оксална киселина (HO2CCO2H)
(прва дисоцијација) |
1,27 |
| Оксална киселина (HO2CCO2−)
(друга дисоцијација) |
4,14 |
| Трихлоросирћетна киселина (CCl3CO2H) | 0,65 |
| Трифлуоросирћетна киселина (CF3CO2H) | 0,23 |
Депротонизација карбоксилних киселина даје карбоксилатне анионе; они су резонантно стабилизовани, јер се негативни набој делокализује преко два атома кисеоника, повећавајући стабилност аниона. Свака од веза угљеник-кисеоник у карбоксилатном анјону има парцијални карактер двоструке везе. Парцијални позитивни набој карбонилног угљеника такође је ослабљен -1/2 негативним наелектрисањем на 2 атома кисеоника.
Мирис[уреди | уреди извор]
Карбоксилне киселине често имају јаке киселе мирисе. Естри карбоксилних киселина имају угодан мирис, а многи се користе у парфемима.
Карактеризација[уреди | уреди извор]
Карбоксилне киселине се лако идентификују као такве инфрацрвеном спектроскопијом. Оне показују оштар појас повезан са вибрацијом C–O вибрационе везе (νC=O) између 1680 и 1725 cm−1. Карактеристична νO–H трака појављује се као широки врх у региону од 2500 до 3000 cm−1.[5] Помоћу 1H NMR спектрометрије, хидроксилни водоник се појављује у региону 10–13 ppm, иако је често проширен или се не примећује због размене са траговима воде.
Појава и примене[уреди | уреди извор]
Многе карбоксилне киселине се индустријски производе у великим количинама. Такође се често налазе у природи. Естри масних киселина су главне компоненте липида, а полиамиди аминокарбоксилних киселина су главне компоненте протеина.
Карбоксилне киселине се користе у производњи полимера, фармацеутских производа, растварача и адитива за храну. Индустријски важне карбоксилне киселине укључују сирћетну киселину (компонента сирћета, прекурзор растварача и премаза), акрилну и метакрилну киселину (прекурсори полимера, лепкова), адипинску киселину (полимери), лимунску киселину (арома и конзерванс у храни и пићима), етилендиаминтетрасирћетна киселина (хелирајући агенс), масне киселине (превлаке), малеинска киселина (полимери), пропионска киселина (конзерванс за храну), терефтална киселина (полимери). Важне соли карбоксилата су сапуни.
Синтеза[уреди | уреди извор]
Индустријске руте[уреди | уреди извор]
Генерално, индустријски путеви до карбоксилних киселина разликују се од оних који се користе у мањем обиму, јер захтевају специјализовану опрему.
- Карбонилација алкохола како је илустровано Катива процесом за производњу сирћетне киселине. Мравља киселина се добија различитим путем карбонилације, такође почевши од метанола.
- Оксидација алдехида ваздухом помоћу катализатора кобалта и мангана. Потребни алдехиди се лако добијају из алкена хидроформилацијом.
- Оксидација угљоводоника ваздухом. За једноставне алкане, ова метода је јефтина, али није довољно селективна да би била корисна. Алилна и бензилна једињења подлежу селективнијој оксидацији. Алкилне групе на бензенском прстену оксидирају се у карбоксилну киселину, без обзира на дужину њеног ланца. Бензојева киселина из толуена, терефтална киселина из пара-ксилена и фтална киселина из орто-ксилена су илустративни примери конверзије на великим скалама. Акрилна киселина настаје из пропена.[7]
- Оксидација етена помоћу катализатора силиковолфрамске киселине.
- Дехидрогенизација алкохола катализована базом.
- Карбонилација повезана са додатком воде. Ова метода је ефикасна и свестрана за алкене који стварају секундарне и терцијарне карбокатјоне, нпр. изобутилена до пивалинске киселине. У Кошовој реакцији, додавање воде и угљен-моноксида у алкене катализују јаке киселине. Хидрокарбоксилације укључују истовремени додатак воде и CO. Такве реакције се понекад називају „Репеова хемија”.
- HCCH + CO + H2O → CH2=CHCO2H
- Хидролиза триглицерида добијених из биљних или животињских уља. Ове методе синтезе неких дуголанчаних карбоксилних киселина повезане су са производњом сапуна.
- Ферментација етанола. Ова метода се користи у производњи сирћета.
- Колбе–Шмитова реакција обезбеђује пут до салицилне киселине, претече до аспирина.
Лабораторијске методе[уреди | уреди извор]
Припремне методе за реакције малих размера за истраживање или производњу финих хемикалија често користе скупе потрошне реагенсе.
- Оксидација примарних алкохола или алдехида јаким оксидантима као што су калијум-дихромат, Јонесов реагенс, калијум-перманганат или натријум-хлорит.
- Оксидативно цепање олефина озонолизом, калијум перманганатом или калијум дихроматом.
- Хидролиза нитрила, естара или амида, обично са киселом или базном катализом.
- Карбонизација Грињаровог реагенса и органолитијумских реагенса:
- RLi + CO2 → RCO2Li
- RCO2Li + HCl → RCO2H + LiCl
- Халогенизација праћена хидролизом метил кетона у реакцији халоформа
- Базно катализовано цепање неенолизабилних кетона, посебно арил кетона:[8]
- RC(O)Ar + H2O → RCO2H + ArH
Референце[уреди | уреди извор]
- ^ IUPAC. „carboxylic acids”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ IUPAC, Плава књига, http://www.acdlabs.com/iupac/nomenclature/93/r93_480.htm
- ^ а б Morrison, R.T.; Boyd, R.N. (1992). Organic Chemistry (6th изд.). ISBN 0-13-643669-2.
- ^ Haynes, William M., ур. (2011). CRC Handbook of Chemistry and Physics (92nd изд.). CRC Press. стр. 5–94 to 5–98. ISBN 978-1439855119.
- ^ Riemenschneider, Wilhelm (2002). „Carboxylic Acids, Aliphatic”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 3527306730. doi:10.1002/14356007.a05_235..
- ^ Perry C. Reeves (1977). „Carboxylation Of Aromatic Compounds: Ferrocenecarboxylic Acid”. Org. Synth. 56: 28. doi:10.15227/orgsyn.056.0028.
Спољашње везе[уреди | уреди извор]
- Carboxylic acids synthesis — Collection of links pertaining to synthesis of Carboxylic acid
- Carboxylic acids pH and titration — freeware for calculations, data analysis, simulation, and distribution diagram generation
