Алотропске модификације фосфора
Елементарни фосфор може да постоји у облику неколико алотропских модификација. Најраспрострањеније међу њима су бели и црвени фосфор. Љубичасти и црни алотропи су такође познати. Гасовити фосфор постоји као дифосфор, или као атомски фосфор.[1]
Бели фосфор[уреди | уреди извор]

Бели фосфор, жути фосфор, или тетрафосфор (P4) је молекул са четири атома везана са шест једноструких P-P веза. Његова тетраедрална структура доводи до напрезања прстена и нестабилности. Познате су две кристалне форме. α форма, која је стабилна под стандардним условима, има тесерална кристалну структуру. Она се реверзибилно трансформише у β форму на 195.2 К. Сматра се да β форма има хексагоналну кристалну структуру.[1]
Бели фосфор је транспарентни воштани материјал који брзо пожути кад је изложен светлости. Из тог разлога он се такође назива жутим фосфором. Он производи зеленкасти сјај у мраку (кад је изложен кисеонику), високо је запаљив и пирофоричан (само-запаљив) након контакта са ваздухом, као и токсичан (узрокује озбиљно оштећење јетре ако се прогута, а услед хронични унос трагова белог фосфора кроз уста или удисањем изазива фосфорну некрозу вилице). Мирис дима при сагоревању овог облика фосфора подсећа на бели лук, а узорци су обично прекривени белим (ди) фосфор пентоксидом, који се састоји од P4O10 тетраедра са кисеоником уметнутим између атома фосфора и на њиховим теменима. Бели фосфор је незнатно растворан у води и, може се чувати испод слоја воде. Он је растворан у бензену, уљима, угљен дисулфиду и дисумпор дихлориду.
Производња и примена[уреди | уреди извор]
Постоји неколико метода за производњу белог алотропа. У једном од процеса, калцијум фосфат, који се добија из фосфатних стена, се греје у пећима у присуству угљеника и силицијум-диоксида.[2] Елементарни фосфор се ослобађа као пара која може да се сакупи испод фосфорне киселине.

Бели фосфор има знатан напон паре на обичним температурама. Из густине паре проистиче да се пара састоји од P4 молекула до око 800 °C. Изнад те температуре, долази до дисоцијације у P2 молекуле.
Он се спонтано пали на ваздуху на око 50 °Ц. До паљења може доћи и на много нижим температурама, ако је бели фосфор фино уситњен. Његовим сагоревањем настаје фосфор(V)-оксид:
Због ове особине, бели фосфор се користи као оружје.
Непостојање кубног-P8[уреди | уреди извор]
Мада се бели фосфор конвертује у термодинамички стабилнији црвени алотроп, до формирања кубног P8 не долази у кондензованој фази. Деривати овог хипотетичног молекула су, међутим, били припремљени из фосфаалкина.[3]
Црвени фосфор[уреди | уреди извор]


Црвени фосфор се може формирати загревањем белог фосфора до 250 °Ц (482 °F), или излагањем белог фосфора сунчевој светлости. Црвени фосфор постоји као аморфна мрежа. Након даљег загревања, аморфни црвени фосфор се кристалише. Црвени фосфор се не пали у ваздуху на температурама испод 240 °Ц, док се бели фосфор пали на око 30 °Ц. Црвени фосфор се може конвертовати у бели загревањам на 260 °Ц.
Хиторфов љубичасти фосфор[уреди | уреди извор]


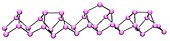
Моноклинични фосфор, или љубичасти фосфор, је такође познат као Хиторфов металични фосфор.[4][5] Хиторф је (1865. године) загревао црвени у затвореној цеви на 530 °C. Горњи део цеви је одржаван на 444 °C. Сјајни непрозирни моноклинични, или ромбоедарски, кристали су се сублимирали. Љубичасти фосфор се такође може припремити растварањем белог фосфора у растопљеном олову у затвореној цеви на 500 °C током 18 часова. Након спорог хлађења, Хиторфови алотропи се кристалишу. Кристали се могу одвојити растварањем олова у разблаженој азотној киселини, и накнадним кључањем у концентованој хлороводоничној киселини.[6] Хиторф је открио да црвено/љубичаста форма настаје кад се фосфор рекристалише из растопљеног олова. Поред тога, постоји и влакнаста форма са сличним фосфорним структурама.
Реакције љубичастог фосфора[уреди | уреди извор]
Он се не пали на ваздуху док се не загреје до 300 °Ц. Овај алотроп није нерастворан ни у једном растварачу. Он је отпоран на алкалије, и само у малој мери реагује са халогенима. Он се може оксидовати азотном киселином до фосфорне киселине.
Ако се загреје у атмосфери инертног гаса, на пример у азоту или угљен-диоксиду, он сублимира и пара се кондензује као бели фосфор. Ако се, међутим, он загрева у вакууму и пара се рапидно кондензује, настаје љубичасти фосфор. Љубичасти фосфор је полимер високе релативне молекулске масе, који се загревањем разлаже до P2 молекула. Хлађењем, ови молекули би се нормално димеризовали у P4 молекуле (и.е. бели фосфор), али у вакууму се они поново везују и формирају полимерни љубичасти алотроп.
Црни фосфор[уреди | уреди извор]
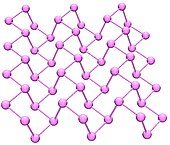

Црни фосфори су термодинамички стабилне форме фосфора на собној температури и притиску. Он се добија загревањем белог фосфора под високим притиском (12,000 атмосфера). Његов изглед, особине и структура су веома слични графиту, јер је црне боје и пахуљаст, проводи струју, и садржи наборане листове везаних атома.
Црни фосфор има орторомбичну структуру. Он је најмање реактиван алотроп, јер се састоји од многобројних међусобно везаних шесточланих прстенова. Сваки атом је везан за три друга атома.[7][8] Недавно је било објављено да се синтеза црног фосфора може извести користећи металне соли као катализаторе.[9]
Један од облика црвеног/црног фосфора је кубни чврсти материјал.[10]
Дифосфор[уреди | уреди извор]
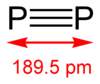
Дифосфорни алотроп (P2) се може добити само под екстремним условима (на пример, из P4 на 1100 К). Ипак, известан напредак је остварен у формирању диатомских молекула у хомогеним растворима, под нормалним условима уз употребу комплекса прелазних метала (базираних на пример на тунгстену и ниобијуму).[11]
Дифосфор је гасовити облик фосфора, и термодинамички је стабилна форма изнад 1200 °C, и све до 2000 °C. Дисоцијација тетрафосфора (P4) почиње на нижим температурама: проценат P2 на 800 °C је ≈ 1%. На температури од око 2000 °C, молекули дифосфора почињу да се дисоцирају у атомски фосфор.
Фосфорни наноштапови[уреди | уреди извор]
Фосфорни наноштапови се синтетишу као P12- полимери у две модификације.[12] Црвено-смеђа фаза се разликује од црвеног фосфора и такође је стабилна у ваздуху недељама. Електронским микроскопом је показано да се црвено-смеђа форма састоји од дугачких, паралелних наноштапова да пречником између 0.34 nm и 0.47 nm.
| Форма | бели (α) | бели (β) | љубичасти | црни |
|---|---|---|---|---|
| Симетрија | Тесерална | Триклинична | Моноклинична | Ромбична |
| Пеарсонов симбол | аП24 | мП84 | оС8 | |
| Просторна група | I43м | П1 Но.2 | П2/ц Но.13 | Цмца Но.64 |
| Густина (g/cm³) | 1.828 | 1.88 | 2.36 | 2.69 |
| Енергетски размак (eV) | 2.1 | 1.5 | 0.34 | |
| Индекс рефракције | 1.8244 | 2.6 | 2.4 |
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ а б Марие-Тхéрèсе Авербуцх-Поуцхот; А. Дуриф. (1996). Топицс ин Пхоспхате Цхемистрy. Wорлд Сциентифиц. стр. 3. ИСБН 978-981-02-2634-3.
- ^ Тхрелфалл, Р.Е., (1951). 100 yеарс оф Пхоспхорус Макинг: 1851–1951. Олдбурy: Албригхт анд Wилсон Лтд
- ^ Стреубел, Раинер (1995). „Пхоспхаалкyне Цyцлоолигомерс: Фром Димерс то Хеxамерс—Фирст Степс он тхе Wаy то Пхоспхорус–Царбон Цаге Цомпоундс”. Ангеwандте Цхемие Интернатионал Едитион ин Енглисх. 34: 436. дои:10.1002/ание.199504361.
- ^ „Латерал Сциенце – Пхоспхорус Топицс”. Архивирано из оригинала 21. 2. 2009. г. Приступљено 20. 1. 2011.
- ^ Моноцлиниц пхоспхорус формед фром вапор ин тхе пресенце оф ан алкали метал У.С. Патент 4.620.968
- ^ Хитторф, W. (1865). „Зур Кеннтнисс дес Пхоспхорс”. Аннален дер Пхyсик. 202 (10): 193—228. дои:10.1002/андп.18652021002.
- ^ Броwн, А.; Рундqвист, С. (1965). „Рефинемент оф тхе црyстал струцтуре оф блацк пхоспхорус”. Ацта Црyсталлограпхица. 19: 684. дои:10.1107/С0365110X65004140.
- ^ Цартз, L.; Сриниваса, С. Р.; Риеднер, Р. Ј.; Јоргенсен, Ј. D.; Wорлтон, Т. Г. (1979). „Еффецт оф прессуре он бондинг ин блацк пхоспхорус”. Тхе Јоурнал оф Цхемицал Пхyсицс. 71: 1718. дои:10.1063/1.438523.
- ^ Ланге, Стефан; Сцхмидт, Пеер; Нилгес, Том (2007). „Ау3СнП7@Блацк Пхоспхорус: Ан Еасy Аццесс то Блацк Пхоспхорус”. Инорганиц Цхемистрy. 46 (10): 4028—35. ПМИД 17439206. дои:10.1021/иц062192q.
- ^ Ахуја, Рајеев (2003). „Цалцулатед хигх прессуре црyстал струцтуре трансформатионс фор пхоспхорус”. Пхyсица статус солиди (б). 235: 282. дои:10.1002/пссб.200301569.
- ^ Пиро, На; Фигуероа, Јс; Мцкеллар, Јт; Цумминс, Цц (2006). „Трипле-бонд реацтивитy оф дипхоспхорус молецулес.”. Сциенце. 313 (5791): 1276—9. ПМИД 16946068. дои:10.1126/сциенце.1129630.
- ^ Пфитзнер, А; Брäу, Мф; Зwецк, Ј; Брунклаус, Г; Ецкерт, Х (2004). „Пхоспхорус нанородс – тwо аллотропиц модифицатионс оф а лонг-кноwн елемент.”. Ангеwандте Цхемие (Интернатионал ед. ин Енглисх). 43 (32): 4228—31. ПМИД 15307095. дои:10.1002/ание.200460244.
- ^ Холлеман, А.; Wиберг, Н. (1985). „XВ 2.1.3”. Лехрбуцх дер Анорганисцхен Цхемие (33 изд.). де Груyтер. ИСБН 978-3-11-012641-9.
- ^ Бергер, L. I. (1996). Семицондуцтор материалс. ЦРЦ Пресс. стр. 84. ИСБН 978-0-8493-8912-2.
Литература[уреди | уреди извор]
- Бергер, L. I. (1996). Семицондуцтор материалс. ЦРЦ Пресс. стр. 84. ИСБН 978-0-8493-8912-2.
- Холлеман, А.; Wиберг, Н. (1985). „XВ 2.1.3”. Лехрбуцх дер Анорганисцхен Цхемие (33 изд.). де Груyтер. ИСБН 978-3-11-012641-9.
- Марие-Тхéрèсе Авербуцх-Поуцхот; А. Дуриф. (1996). Топицс ин Пхоспхате Цхемистрy. Wорлд Сциентифиц. стр. 3. ИСБН 978-981-02-2634-3.

