Ароматично једињење
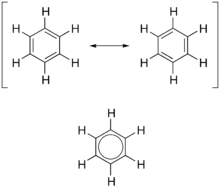
У органској хемији, структуре ароматичних једињења су неуобичајено стабилне. Ароматичност је хемијска особина којом конјуговани прстен незасићених веза, слободних парова, или празних орбитала показује стабилизацију јачу него што би се очекивало као последица саме конјугације. То се такође сматра манифестацијом цикличне делокализације и резонанце.[1][2][3]
Обично се сматра да је то зато што су електрони слободни да се крећу око кружног аранжмана атома који су алтернативно једноструко- и двоструко-везани један за другог. На те везе се може гледати као хибрид једноструких и двоструких веза, где је све веза у прстену идентичне. Овај уобичајени модел ароматичног прстена, заправо идеју да је бензен формиран од шесточланог угленичног прстена са наизменичним једноструким и двоструким везама (циклохексатриен), је развио Фридрих Кекуле. Модел бензена се састоји од две резонантне форме. Бензен је стабилнији молекул него што би се очекивало без узимања у обзир делокализације наелектрисања.
Теорија[уреди | уреди извор]
Као што је стандардно за резонантне дијаграме, двоглава стрела се користи да се укаже да две структуре нису дистинктни ентитети, него само хипотетичне могућности. Ниједна од њих није прецизна репрезентација стварног једињења, које је најбоље приказано као хибрид (просек) тих структура, што се може видети са леве стране. C=C је краћа од C−C везе, док је бензен перфектно хексагоналан — свих шест угљеник-угљеник веза имају исту дужину, која је између једноструке и двоструке везе.[4][5]
Боља репрезентација је та са циркуларном π везом (Армстронгов унутрашњи круг), у којој је електронска густина равномерно дистрибуирана кроз π-везе изнад и испод прстена. Ова модел коректније представља локацију електронске густине унутар ароматичног прстена.
Једноструке везе су формиране са електронима у линији између два угљеника. Оне се називају σ-везама. Двоструке везе се састоје оф σ-везе и π-везе. π-везе се формирају преклапањем атомских п-орбитала изнад и испод равни прстена. Следећи дијаграм показује позиције тих п-орбитала:

Пошто су оне ван равни атома, те орбитале могу слободно да интерагују једна с другом, и да постану делокализоване. То значи да уместо да су везени за један атом угљеника, сви електрони се дели између свих шест атома у прстену. Пошто, нема довољно електрона да се формирају двоструке везе на свим угљениковим атомима, него "екстра" електрони појачавају све везе прстена подједнако. Резултујућа молекуларска орбитала има π симетрију.
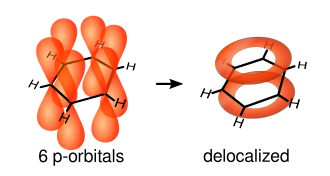
Историја[уреди | уреди извор]
Термин „ароматичан”[уреди | уреди извор]
Прва позанта употреба речи „ароматичан” као хемијског термина, за означавање једињења која садрже фенил групу, јавила се у чланку који је објавио Аугуст Вилхелм Хофман 1855. године.[6][7] Ако је ово заиста најраније увођење термина, занимљиво је да Хофман не каже ниште о разлогу из ког је увео овај придев који указује на мирисно својство за описивање групе хемијских супстанци од којих само неке имају приметне ароме. Исто тако, многе од органских супстанци јаког мириса познатих као терпени, нису ароматична у хемијском смислу. Терпени и бензеноидне супстанце додуше имају заједничке хемијске карактеристике, као што је виши степен незасићености од већине алифатичних једињења, и могуће је да је Хофман желео да направи разлику између те две категорије. Многа рано позната ароматична једињења, као што су бензен и толуен, имала су препознатљиве пријатне мирисе. Ово својство је вероватно довело до тога да се термин „ароматичан” користи за ову класу једињења, и стога термин „ароматичност” за електронско својство које је касније откривено.[8]
Структура бензенског прстена[уреди | уреди извор]
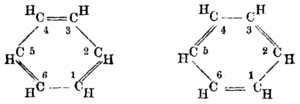

У 19. веку хемичари су сматрали да је збуњујуће да бензен може бити тако неактиван у погледу реакције адиције, имајући у виду његов претпостављени високи ступањ незасићености. Циклохексатриенску структуру бензена је први предложио Фридрих Кекуле 1865. године.[10][11] Већина хемичара је брзо прихватила ову структуру, јер је она задовољавала већину познатих изомерних односа ароматичне хемије. Хексагонална структура објашњава зашто постоји само један изомер бензена и зашто дисупституисана једињења имају три изомера.[7]
Између 1897. и 1906, Џ. Џ. Томсон, проналазач електрона је предложио три еквивалентна електрона између сваког пара атома угљеника у бензену. Заслуге за објашњавање изузетне стабилности бензена се конвенционално приписују Сер Роберту Робинсону, који је први (1925. године)[12] сковао термин ароматични секстет за групу од шест електрона отпорних на поремећаје.
Заправо, овај концепт се може пратити даље у прошлост, преко Ернеста Крокера из 1922,[13] до Хенрија Едварда Армстронга, који је 1890. године писао „(шест) центричних афинитета делују унутар круга ... бензен се може представити са двоструким прстеном (sic) ... и кад се адитивно једињење формира, унутарњи круг афинитета трпи поремећај, суседни атоми угљика на које ништа није везано нужно стичу етиленско стање”.[14] Овде је Армстронг описивао бар четири модерна концепта. Прво, његов „афинитет” је у данашње време познатији као електрон, којег је открио само седам година касније Џ. Џ. Томсон. Друго, он описује електрофилну ароматичну супституцију, пролазећи (треће) кроз Веландов интермедијар, у коме је (четврто) конјугација прстена нарушена. Он је увео симбол C центриран на прстену као ознаку за унутрашњи круг, тако антиципирајући нотацију Ериха Клара. Тврди се да је он такође предвидео природу таласне механике, будући да је препознао да његови афинитети имају смер, да нису само тачкасте честице, и да колективно имају дистрибуцију која се може променити увођењем супституената на бензенски прстен (као што се дистрибуција електричног набоја у телу мења кад му се приближава друго тело).
Квантно механичко порекло ове стабилности, или ароматичности, први је моделовао Хикел 1931. године. Он је први раздвојио везујуће електроне у сигма и пи електроне.
Ароматичност једног произвољног ароматичног једињења се може квантитативно мерити помоћу рачунарског метода хемијског померања независног од језгра (енгл. Nucleus-Independent Chemical Shift - NICS)[15] и метода процента ароматичности.[16]
Типови ароматичних једињења[уреди | уреди извор]
Велика већина ароматичних једињења су једињења угљеника, мада та једињења не морају да буди угљоводоници.
Хетероциклична једињења[уреди | уреди извор]
Код хетероцикличних ароматичних једињења (хетероаромата), један или више атома у ароматичном прстену није угљеник. То може да умањи ароматичност прстена, и тако (као што је то случај са фураном) повећа његову реактивност. Други примери су пиридин, пиразин, имидазол, пиразол, оксазол, тиофен, и њихови бензанилисани аналози (нпр. бензимидазол). Ароматаска хретероциклична једињења су хетероциклуси који испуњавају критериј ароматичности:имају планарну структуру, непрекинути низ п електрона, те непаран број парова п електрона у циклусу(двоструке везе и усамљени електронски парови. Најзначајнији су они са 5 или 6 атома у циклусу.
Полициклична једињења[уреди | уреди извор]
Полициклични ароматични угљоводоници су молекули који садрже два или више једноставна ароматична прстена везан путем заједничке везе, и.е. прстени деле два атома. Примери су нафтален, антрацен и фенантрен.
Супституисани ароматици[уреди | уреди извор]
Постоји велики број хемијских једињења која су ароматични прстенови са једним или више везаних супституената. Примери су тринитротолуен (ТНТ), ацетилсалицилна киселина (аспирин), парацетамол, и ДНК нуклеотиди.
Атипична ароматична једињења[уреди | уреди извор]
Ароматичност је исто тако нађена код јона: циклопропенилни катјон (2е систем), циклопентадиенилни ањон (6е систем), тропилијумски јон (6е) и циклооктатетраенски диањон (10е). Ароматичне особине су биле приписане не-бензеноидним једињењима као што је тропон. Гранични случај ароматичних особина поседује класа једињења званих циклофани.
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ Сцхлеyер, Паул вон Рагуé (2001). „Интродуцтион: Ароматицитy”. Цхемицал Ревиеwс. 101 (5): 1115. ПМИД 11749368. дои:10.1021/цр0103221.
- ^ А. Т. Балабан, П. в. Р. Сцхлеyер анд Х. С. Рзепа (2005). „Цроцкер, Нот Армит анд Робинсон, Бегат тхе Сиx Ароматиц Елецтронс”. Цхемицал Ревиеwс. 105: 3436—3447. дои:10.1021/цр0300946.
- ^ Сцхлеyер, Паул вон Рагуé (2005). „Интродуцтион: ДелоцализатионПи анд Сигма”. Цхемицал Ревиеwс. 105: 3433. дои:10.1021/цр030095y.
- ^ „Бондинг ин бензене – тхе Кекулé струцтуре”. www.цхемгуиде.цо.ук. Приступљено 25. 12. 2015.
- ^ „Цхемицал Реацтивитy”. www2.цхемистрy.мсу.еду. Приступљено 25. 12. 2015.
- ^ Хофманн, А. W. (1855). „Он Инсолиниц Ацид”. Процеедингс оф тхе Роyал Социетy. 8: 1—3. дои:10.1098/рспл.1856.0002.
- ^ а б Роцке, А. Ј. (2015). „Ит Беган wитх а Даyдреам: Тхе 150тх Анниверсарy оф тхе Кекулé Бензене Струцтуре”. Ангеw. Цхем. Инт. Ед. 54: 46—50. ПМИД 25257125. дои:10.1002/ание.201408034.
- ^ МцМуррy, Јохн (2007). Органиц Цхемистрy (7тх изд.). Броокс-Цоле. стр. 515. ИСБН 978-0-495-11258-7.
- ^ Кекулé, Ф. А. (1872). „Уебер еиниге Цонденсатионспродуцте дес Алдехyдс”. Лиебигс Анн. Цхем. 162 (1): 77—124. дои:10.1002/јлац.18721620110.
- ^ Кекулé, Ф. А. (1865). „Сур ла цонститутион дес субстанцес ароматиqуес”. Буллетин де ла Социете Цхимиqуе де Парис. 3: 98—110.
- ^ Кекулé, Ф. А. (1866). „Унтерсуцхунген üбер ароматисцхе Вербиндунген Уебер дие Цонститутион дер ароматисцхен Вербиндунген. I. Уебер дие Цонститутион дер ароматисцхен Вербиндунген”. Лиебигс Анн. Цхем. 137 (2): 129—196. дои:10.1002/јлац.18661370202.
- ^ Армит, Јамес Wилсон; Робинсон, Роберт (1925). „ЦЦXИ. Полyнуцлеар хетероцyцлиц ароматиц тyпес. Парт II. Соме анхyдрониум басес”. Ј. Цхем. Соц. Транс. 127: 1604—1618. дои:10.1039/ЦТ9252701604.
- ^ Цроцкер, Ернест C. (1922). „Апплицатион Оф Тхе Оцтет Тхеорy То Сингле-Ринг Ароматиц Цомпоундс”. Ј. Ам. Цхем. Соц. 44 (8): 1618—1630. дои:10.1021/ја01429а002.
- ^ Армстронг, Хенрy Едwард (1890). „Тхе струцтуре оф цyцлоид хyдроцарбон”. Проц. Цхем. Соц. 6 (85): 95—106. дои:10.1039/ПЛ8900600095.
- ^ Сцхлеyер, Паул вон Рагуé; Маеркер, Цхристопх; Дрансфелд, Алк; Јиао, Хаијун; Ван Еикема Хоммес, Ницолаас Ј. Р. (1996). „Нуцлеус-Индепендент Цхемицал Схифтс: А Симпле анд Еффициент Ароматицитy Пробе”. Ј. Ам. Цхем. Соц. 118 (26): 6317—6318. дои:10.1021/ја960582д.
- ^ Муцси, З.; Висколцз, Б.; Цсизмадиа, I. Г. (2007). „А Qуантитативе Сцале фор тхе Дегрее оф Ароматицитy анд Антиароматицитy”. Ј. Пхyс. Цхем. А. 111 (6): 1123—1132. Бибцоде:2007ЈПЦА..111.1123М. ПМИД 17286363. дои:10.1021/јп0657686.
Литература[уреди | уреди извор]
- Р.L. Схринер; C.К.Ф. Херманн; Т.C. Моррилл; D.Y. Цуртин & Р.C. Фусон Јохн (1997). Тхе Сyстематиц Идентифицатион оф Органиц Цомпоундс. Wилеy & Сонс. ИСБН 978-0-471-59748-3.
- Рицхард Ф. & Далеy, Саллy Ј. Органиц Цхемистрy, Онлине органиц цхемистрy теxтбоок.
- Робертс, Јохн D.; Цасерио, Марјорие C. (1964). Басиц Принциплес оф Органиц Цхемистрy. W. А. Бењамин, Инц.
- Стреитwиесер, Андреw; Хеатхцоцк, Цлаyтон Х.; Косоwер, Едwард M. (2017). Интродуцтион то Органиц Цхемистрy. Неw Делхипагес=3–4: Медтецх (Сциентифиц Интернатионал, репринт оф ревисед 4тх едитион, Мацмиллан, 1998). ИСБН 978-93-85998-89-8.
- Хенрy Марсхалл Леицестер; Херберт С. Клицкстеин (1951). А Соурце Боок ин Цхемистрy, 1400-1900. Харвард Университy Пресс. стр. 309.
- Ницолаоу, К.C.; Соренсен, Е.Ј. (1996). Цлассицс ин Тотал Сyнтхесис: Таргетс, Стратегиес, Метходс. Wилеy. ИСБН 978-3-527-29231-8.
Спољашње везе[уреди | уреди извор]
- MIT.edu, OpenCourseWare: Organic Chemistry I
- HaverFord.edu, Organic Chemistry Lectures, Videos and Text
- Organic-Chemistry.org, Organic Chemistry Portal – Recent Abstracts and (Name)Reactions
- Orgsyn.org, Organic Chemistry synthesis journal
- Khanacademy.org, Khan Academy - Organic Chemistry
