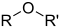
Функционална група
Функционална група у хемији представља групе атома у органским једињењима које дају карактеристичне особине тим једињењима и њиховим реакцијама. Хемијска једињења која имају исту функционалну групу се због сличних особина систематизују у заједничке групе.[1][2] Иста функционална група ће проћи исте или сличне хемијске реакције без обзира на остатак молекулског састава.[3][4] То омогућава систематско предвиђање хемијских реакција и понашања хемијских једињења и дизајн хемијске синтезе. Реактивност функционалне групе могу модификовати друге функционалне групе у близини. Интерконверзија функционалне групе може се користити у ретросинтетичкој анализи за планирање органске синтезе.
Функционалне групе се могу поделити на: хетерогене (са различитим атомима унутар групе) и хомогене (са истим атомима). Хомогене функционалне групе се могу сматрати потпуним функционалним групама, пошто су оне само структурне везе који са другим атомима и молекулима готово да и не ступају у хемијске реакције. У случајевима анорганских и металорганских спојева, једноставним функционалним групама се сматрају и алкил- и арил- функционалне групе. Све органске везе и функционалне групе се могу сврстати у органске групе. У зависности у функционалне групе, већина примарних органских једињења мења своје особине. Тако на приер ако се алкану бутану додају одређене функционалне групе, он прелази у своје деривате.
Функционална група је група атома у молекулу са карактеристичним хемијским својствима, без обзира на остале атоме у молекулу. Атоми у функционалној групи повезани су међусобно и са остатком молекула ковалентним везама. За понављајуће јединице полимера, функционалне групе се вежу за њихова неполарна језгра атома угљеника и тако додају хемијски карактер ланцима угљеника. Функционалне групе такође могу бити наелектирсане, нпр. у карбоксилатним солима (–COO−), чиме се молекул претвара у полатомски јон или комплексни јон. Функционалне групе које се везују за централни атом у координационом комплексу називају се лиганди. Комплексација и солватација су такође узроковане специфичним интеракцијама функционалних група. У уобичајеном правилу „слично се раствара слично“, заједничке или међусобно добро интерагујуће функционалне групе омогућавају растворљивост. На пример, шећер се раствара у води, јер обоје деле хидроксилну функционалну групу (–OH), а хидроксили формирају снажне међусобн интеракције. Плус, када су функционалне групе електронегативније од атома за које се везују, функционалне групе постају поларне, а иначе неполарни молекули који садрже ове функционалне групе постају поларни и тако постају растворљиви у неком воденом окружењу.
Комбиновање имена функционалних група са именима матичних алкана ствара оно што се назива систематском номенклатуром за именовање органских једињења. У традиционалној номенклатури, први атом угљеника после угљеника који се везује за функционалну групу назива се алфа угљеник; други, бета угљеник, трећи, гама угљеник, итд. Ако на угљенику постоји још једна функционална група, она може се назвати грчким словом, нпр. гама-амин у гама-аминобутерној киселини налази се на трећем угљенику угљеничног ланца везаног за групу карбоксилне киселине. ИУПАЦ конвенције захтевају нумеричко означавање положаја, нпр. 4-аминобутанска киселина. У традиционалним именима за означавање изомера користе се различити квалификатори, на пример, изопропанол (ИУПАЦ назив: пропан-2-ол) је изомер n-пропанола (пропан-1-ол). Термин остатак се преклапа са термином „функционална група“. Међутим, остатак је читава „половина“ молекула, која може бити само једна функционална група, али и већа јединица која се састоји од више функционалних група. На пример, „арилни део“ може бити било која група која садржи ароматични прстен, без обзира на то колико функционалних група поменути арил има.
Табела уобичајених функционалних група[уреди | уреди извор]
Следи листа уобичајених функционалних група.[5] У формулама симболи R и R' обично означавају везани водоник, или бочни ланац угљоводоника било које дужине, али се понекад могу односити на било коју групу атома.
Угљоводоници[уреди | уреди извор]
Угљоводоници су класа молекула која је дефинисана функционалним групама названим хидрокарбил које садрже само угљеник и водоник, али се разликују у броју и редоследу двоструких веза. Свака се разликује по типу (и обиму) реактивности.
| Хемијска класа | Група | Формула | Структурна формула Формула | Префикс | Суфикс | Пример |
|---|---|---|---|---|---|---|
| Алкан | Алкил | R(CH2)nH | алкил- | -ан |  Етан | |
| Алкен | Алкенил | R2C=CR2 | 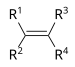
|
алкенил- | -ен | 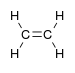 Етилен (Етен) |
| Алкин | Алкинил | РЦ≡ЦР' | алкинил- | -ин | Ацетилен (Етин) | |
| Деривати бензена | Фенил | RC6H5 RPh |
фенил- | -бензен | 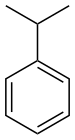 Кумен (Исопропилбензен) |
Такође постоји велики број разгранатих или прстенастих алкана који имају специфична имена, нпр. терц-бутил, борнил, циклохексил итд. Угљоводоници могу формирати наелектрисане структуре: позитивно наелектрисане карбокатјоне или негативн карбањоне. Карбокатјони се често називају -ум. Примери су тропилијум и трифенилметил катјони и циклопентадиенил ањон.
Групе које садрже халоген[уреди | уреди извор]
Халоалкани су класа молекула која је дефинисана везом угљеник-халоген. Ова веза може бити релативно слаба (у случају јодоалкана) или прилично стабилна (као у случају флуороалкана). Генерално, са изузетком флуорисаних једињења, халоалкани лако подлежу реакцијама нуклеофилне супституције или елиминације. Супституција на угљенику зависи од киселости суседног протона, услова растварача итд.
| Хемијска класа | Група | Формула | Структурна формула Формула | Префикс | Суфикс | Пример |
|---|---|---|---|---|---|---|
| халоалкан | хало | RX | хало- | алкил халид | Хлороетан (Етил хлорид) | |
| флуороалкан | флуоро | RF | флуоро- | алкил флуорид |  Флуорометан (Метил флуорид) | |
| цхлороалкане | хлоро | RCl | хлоро- | алкил хлорид |  Хлорометан (Метил хлорид) | |
| бромоалкан | бромо | RBr | бромо- | алкил бромид | 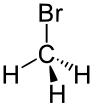 Бромометан (Метил бромид) | |
| иодоалкане | јодо | RI | јодо- | алкил јодид |  Јодометан (Метил јодид) |
Групе које садрже кисеоник[уреди | уреди извор]
Једињења која садрже C-O везе поседују различиту реактивност на основу локације и хибридизације C-O везе, захваљујући ефекту повлачења електронском sp-хибридизованог кисеоника (карбонилне групе) и донирајућег ефекта sp2-хибридизованог кисеоника (алкохолне групе).
| Хемијска класа | Група | Формула | Структурна формула Формула | Префикс | Суфикс | Пример |
|---|---|---|---|---|---|---|
| Алкохол | Хидроксил | ROH | хидрокси- | -ол | 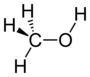 Метанол | |
| Кетон | Карбонил | RCOR' | 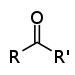
|
-оил- (-COR') или оксо- (=O) |
-он | 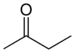 Бутанон (Метил етил кетон) |
| Алдехид | Алдехид | RCHO | 
|
формил- (-COH) или оксо- (=O) |
-ал |  Ацеталдехид (Етанал) |
| Ацил халид | Халоформил | RCOX | 
|
карбонофлуоридоил- карбонохлоридоил- карбонобромидоил- карбонојодидоил- |
-оил халид |  Ацетил хлорид (Етаноил хлорид) |
| Карбонат | Карбонатни естар | ROCOOR' | (алкоксикарбонил)окси- | алкил карбонат | Трифосген (бис(трихлорометил) карбонат) | |
| Карбоксилат | Карбоксилат | RCOO− | 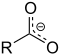
|
карбокси- | -оат | Натријум ацетат (Натријум етаноат) |
| Карбоксилна киселина | Карбоксил | RCOOH | 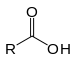
|
карбокси- | -оинска киселина |  Сирћетна киселина (Етаноинска киселина) |
| Естар | Карбоалкокси | RCOOR' | алканоилокси- или алкоксикарбонил |
алкил алканоат | Етил бутират (Етил бутаноат) | |
| Метокси | Метокси | ROCH3 | метокси- | Анизол (Метоксибензен) | ||
| Хидропероксид | Хидроперокси | ROOH | хидроперокси- | алкил хидропероксид | терц-Бутил хидропероксид | |
| Пероксид | Перокси | ROOR' | перокси- | алкил пероксид | Ди-терт-бутил пероксид | |
| Етар | Етар | ROR' | алкокси- | алкил етар | Диетил етар (Етоксиетан) | |
| Хемиацетал | Хемиацетал | R2CH(OR1)(OH) | 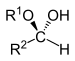
|
алкокси -ол | -ал алкил хемиацетал | |
| Хемикетал | Хемикетал | RC(ORʺ)(OH)R' | 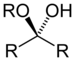
|
алкокси -ол | -он алкил хемикетал | |
| Ацетал | Ацетал | RCH(OR')(OR") | 
|
диалкокси- | -ал диалкил ацетал | |
| Кетал (или Ацетал) | Кетал (или Ацетал) | RC(OR")(OR‴)R' | 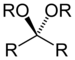
|
диалкокси- | -он диалкил кетал | |
| Ортоестар | Ортоестар | RC(OR')(OR")(OR‴) | 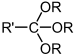
|
триалкокси- | ||
| Хетероцикл (ако је цикличан) |
Метилендиокси | (–OCH2O–) | 
|
метилендиокси- | -диоксол | 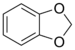 1,2-Метилендиоксибензен (1,3-Бензодиоксол) |
| Ортокарбонатни естар | Ортокарбонатни естар | C(OR)(OR')(OR")(OR‴) | тетралкокси- | тетраалкил ортокарбонат |  Тетраметоксиметан | |
| Органски киселински анхидрид | Карбоксилни анхидрид | R1(CO)O(CO)R2 | анхидрид | Бутирински анхидрид |
Групе које садрже азот[уреди | уреди извор]
Једињења која садрже азот у овој категорији могу садржати C-O везе, као у случају амида.
| Хемијска класа | Група | Формула | Структурна формула Формула | Префикс | Суфикс | Пример |
|---|---|---|---|---|---|---|
| Амид | Карбоксамид | RCONR'R" | 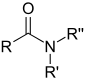
|
карбоксамид- или царбамоyл- |
-амид |  Ацетамид (Етанамид) |
| Амини | Примарни амин | RNH2 | амино- | -амин | 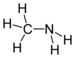 Метиламин (Метанамин) | |
| Секундарни амин | R'R"NH | 
|
амино- | -амин | Диметиламин | |
| Терцијарни амин | R3N | 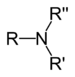
|
амино- | -амин | 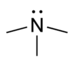 Триметиламин | |
| 4° амонијум јон | R4N+ | 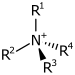
|
амонио- | -амонијум | 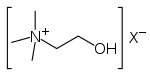 Холин | |
| Имин | Примарни кетимин | RC(=NH)R' | 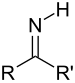
|
имино- | -имин | |
| Секундарни кетимин | 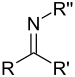
|
имино- | -имин | |||
| Примарни алдимин | RC(=NH)H | 
|
имино- | -имин | Етанимин | |
| Секундарни алдимин | RC(=NR')H | 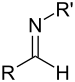
|
имино- | -имин | ||
| Имид | Имид | (RCO)2NR' | 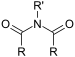
|
имидо- | -имид |  Сукцинимид (Пиролидин-2,5-дион) |
| Азид | Азид | RN3 | азидо- | алкил азид |  Фенил азид (Азидобензен) | |
| Азо једињење | Азо (Диимид) |
RN2R' | азо- | -диазен | 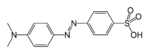 Метил оранж (п-диметиламино-азобензенсулфонска киселина) | |
| Цијанати | Цијанат | ROCN | цијанато- | алкил цијанат | Метил цијанат | |
| Изоцијанат | RNCO | изоцијанато- | алкил изоцијанат | Метил изоцијанат | ||
| Нитрат | Нитрат | RONO2 | нитроокси-, нитрокси- | алкил нитрат |  Амил нитрат (1-нитрооксипентан) | |
| Нитрил | Нитрил | RCN | цијано- | алканнитрил алкил цијанид |
 Бензонитрил (Фенил цијанид) | |
| Изонитрил | RNC | исоцијано- | алканизонитрил алкил изоцијанид |
Метил изоцијанид | ||
| Нитрит | Нитрозоокси | RONO | нитрозоокси- | алкил нитрит |  Изоамил нитрит (3-метил-1-нитрозооксибутан) | |
| Нитро једињење | Нитро | RNO2 | 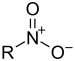
|
нитро- | 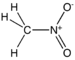 Нитрометан | |
| Нитрозо једињење | Нитрозо | RNO | нитрозо- (Нитрозил-) | Нитрозобензен | ||
| Оксим | Оксим | RCH=NOH | 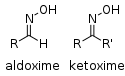
|
Оксим | 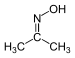 Ацетон оксим (2-Пропанон оксим) | |
| Пиридин дериват | Пиридил | RC5H4N |
4-пиридил 3-пиридил 2-пиридил |
-пиридини |  Никотин | |
| Карбаматни естар | Карбамат | RO(C=O)NR2 | 
|
(-карбамоил)окси- | -карбамат | Хлорпрофам (Изопропил (3-хлорофенил)карбамат) |
Референце[уреди | уреди извор]
- ^ Dieter Hellwinkel: Die systematische Nomenklatur der organischen Chemie: Eine Gebrauchsanweisung, 4. издање, Springer. . Berlin. 1998. ISBN 978-3-540-63221-4.
- ^ Цлаyден, Јонатхан; Греевес, Ницк; Wаррен, Стуарт; Wотхерс, Петер (2001). Органиц Цхемистрy (I изд.). Оxфорд Университy Пресс. ИСБН 978-0-19-850346-0.
- ^ Цомпендиум оф Цхемицал Терминологy (ИУПАЦ "Голд Боок") фунцтионал гроуп
- ^ Марцх, Јеррy (1985), Адванцед Органиц Цхемистрy: Реацтионс, Мецханисмс, анд Струцтуре (3рд изд.), Неw Yорк: Wилеy, ИСБН 0-471-85472-7
- ^ Броwн, Тхеодоре (2002). Цхемистрy: тхе централ сциенце. Уппер Саддле Ривер, Њ: Прентице Халл. стр. 1001. ИСБН 0130669970.
Спољашње везе[уреди | уреди извор]
- IUPAC Blue Book (organic nomenclature)
- „IUPAC ligand abbreviations” (PDF). IUPAC. 2. 4. 2004. Архивирано из оригинала (PDF) 27. 9. 2007. г. Приступљено 25. 2. 2015.
- Functional group video
- Functional group synthesis Архивирано на сајту Wayback Machine (16. јул 2019) from organic-reaction.com