Изотиоцијанат

Изотиоцијанат је хемијска група –N=C=S, формирана супституцијом кисеоника у изоцијанатној групи сумпором.[1] Многи природни биљни изотиоцијнати се формирају ензимском конверзијом глукозинолата. Природини изотиоцијанати, попут алил изотиоцијаната, су такође познати као уље сенфа. Вештачки изотиоцијанат, фенил изотиоцијанат, се корисити за секвенцирање аминокиселина у Едмановој деградацији.[2]
Синтеза и реакције[уреди | уреди извор]
Општи метод за формирање изотиоцијаната се састоји од реакције између примарног амина (е.г. анилина) и угљен дисулфида у воденом раствору амонијака. Долази до преципитације амонијум дитиокарбаматне соли, која се затим треатира олово нитратом да би се формирао изотиоцијанат.[3] Један алтернативни метод је заснован на тосил хлоридом посредованој декомпозицији дитиокарбаматних соли које се страварају у првом кораку претходног поступка.[4]
Изотиоцијанати се такође могу формирати путем термички индукованих фрагментациних реакција 1,4,2-оксатиазола.[5] Ова синтетичка методологија је кориштена при полимерно подржаној синтези изотиоцијаната.[6]
Изотиоцијанати су слаби електрофили. Слично реакцијама угљен диоксида, нуклеофили нападају угљеник.
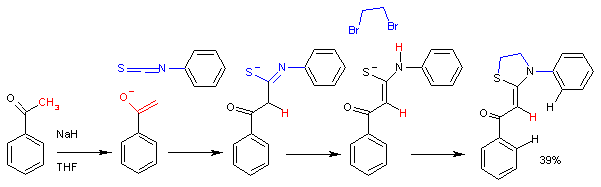
Реакција ацетофенон енолата са фенил изотиоцијанатом.
У овој синтези[7] ултиматни реакциони продукт је тиазолидин. Реакција је стереосективна, те се формира само Z-izomer.
Usled njihovog elektrofilnog karaktera, izotiocijanati su podložni hidrolizi.
Vidi još[уреди | уреди извор]
Reference[уреди | уреди извор]
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Edman, P.; Högfeldt, Erik; Sillén, Lars Gunnar; Kinell, Per-Olof (1950). „Method for determination of the amino acid sequence in peptides”. Acta Chem. Scand. 4: 283—293. doi:10.3891/acta.chem.scand.04-0283.
- ^ Dains FB; Brewster RQ; Olander CP (1926). „Phenyl Isothiocyanate”. Org. Synth. 6: 72.; Coll. Vol., 1, стр. 447
- ^ Wong, R; Dolman, SJ (2007). „Isothiocyanates from tosyl chloride mediated decomposition of in situ generated dithiocarbamic acid salts”. The Journal of Organic Chemistry. 72 (10): 3969—3971. PMID 17444687. doi:10.1021/jo070246n.
- ^ O’Reilly, RJ; Radom, L (2009). „Ab initio investigation of the fragmentation of 5,5-diamino-substituted 1,4,2-oxathiazoles”. Organic Letters. 11 (6): 1325—1328. PMID 19245242. doi:10.1021/ol900109b.
- ^ Burkett, BA; Kane-Barber, JM; O’Reilly, RJ; Shi, L (2007). „Polymer-supported thiobenzophenone : a self-indicating traceless 'catch and release' linker for the synthesis of isothiocyanates”. Tetrahedron Letters. 48 (31): 5355—5358. doi:10.1016/j.tetlet.2007.06.025.
- ^ Ortega-Alfaro, M. C.; López-Cortés, J. G.; Sánchez, H. R.; Toscano, R. A.; Carrillo, G. P.; Álvarez-Toledano, C. (2005). „Improved approaches in the synthesis of new 2-(1, 3-thiazolidin-2Z-ylidene)acetophenones”. Arkivoc. 2005 (6): 356—365. Архивирано из оригинала 26. 04. 2006. г. Приступљено 07. 10. 2013.


