Т помоћне ћелије


Т помоћне ћелије (такође познате као Th ћелије) су под-група лимфоцита (тип белих крвних зрнаца или леукоцита) које имају важну улогу у успостављању и максимизацији капацитета имунског система. Те ћелије су необичне по томе што оне немају цитотоксичну или фагоцитну активност; оне не могу да убију инфициране ћелије домаћина (такође познате као соматске ћелије), као ни патогене, и без других имунских ћелија оне не би биле корисне у борби против инфекције. Th ћелије учествују у активацији и усмеравању других имунских ћелија. Оне имају посебну важност у имунском систему. Оне су есенцијалне у одређивању промене класе антитела Б ћелија, у активацији и расту цитотоксичних Т ћелија, и у максимизацији бактерицидне активности фагоцита као што су макрофаге. Ова разноликост функција, и њихов утицај на друге ћелије, даје Т помоћним ћелијама њихово име.[1]
За зреле Th ћелије се сматра да увек изражавају на својој површини протеин CD4. Оне се називају CD4+ T ćelijama. CD4+ Т ћелије се генерално третирају као ћелије са улогом помоћних Т ћелија у оквиру имунског система, мада су познати изузеци. На пример, постоје под-групе регулаторних Т ћелија, природних убица Т ћелија, и цитотоксичних Т ћелија, за које се зна да изражавају CD4. Цитотоксични примери су примећени у изузетно ниским бројевима у специфичним стањима болести.
Важност помоћних Т ћелија се може видети из примера HIV инфекције, током које вирус инфицира ћелије које су CD4+ (укључујући Т ћелије). При крају HIV инфекције број функционалних CD4+ Т ћелија опадне, што доводи до симптоматског ступња инфекције познатог као синдром стеченог имунолошког дефицита (AIDS). Такође постоје неки ретки поремећаји који резултују у одсуству или дисфункцији CD4+ Т ћелија. Та обољења производе сличне симптоме, и многа од њих су фатална.
Активација наивних помоћних Т ћелија[уреди | уреди извор]
Након Т ћелијског развоја, зреле, наивне (у смислу да никад нису били изложене антигену на који оне могу да одговоре) Т ћелије напуштају тимус и почињу да се шире кроз тело, укључујући лимфне чворове. Попут свих Т ћелија, оне изражавају Т-ћелијски рецептор/CD3 комплекс. Т ћелијски рецептор (TcR) се састоји од константног и варијабилног региона. Варијабилни регион одређује на који антиген Т ћелија може да одговори. CD4+ Т ћелије имају TcR рецепторе са афинитетом за класа II MHC, и сматра се да CD4 учествује у детерминацији MHC афинитета током матурације у тимусу. Класа II MHC протеини се генерално само налазе на површини специјализованих антиген-презентујућих ћелија (APC). Специјализоване антиген презентујуће ћелије су примарно дендритске ћелије, макрофаге и Б ћелије, мада су Б ћелије једина група ћелија која изражава MHC класу II конститутивно (све време). Неке APC ћелије такође везују природне (или непроцесоване) антигене на својој површини, нпр. фоликуларне дендритске ћелије. Необрађени антигени не интерагују са Т ћелијама, и не учествују у њиховој активацији. Ти антигени који се везују за MHC протеине су увек кратки пептиди, 8-10 аминокиселина дугачки за MHC класу I, и до око 25 за MHC класу II.
[уреди | уреди извор]
Током имунског респонса, професионалне антиген-презентујуће ћелије (APC) врше ендоцитозу (апсорбују) страни материјал (типично бактерије или вирусе), које се подвргавају обради, и онда прелазе са места инфекције у лимфне чворове. Кад су једном у лимфним чворовима, APC почиње да презентира антиген пептиде везане за класу II MHC, то омогућава CD4+ Т ћелијама које изражавају специфичне TCR рецепторе са способношћу везивања за пептид/MHC комплексе да се активирају.
Кад се Th ћелије суоче и препознају антиген, на APC ћелијама, TCR-CD3 комплекс се везује за пептид-MHC комплекс на површини професионалних APC ћелија. CD4, корецептор TCR комплекса, се такође везује, али за различиту секцију MHC молекула. Те интеракције просторно групишу протеине, што омогућава интрацелуларним киназама присутним на TCR, CD3 и CD4 протеинима да се међусобно активирају путем фосфорилације. Уз помоћ фосфатазе присутне на интрацелуларном делу CD45 (која је распрострањени леукоцитни антиген), ти молекули активирају главне биохемијске путеве у цитосолу Th ћелија. Ти путеви су познати као Сигнал 1 Т ћелијске активације, јер је то први и примарни проактивациони сигнал у Th ћелије. При накнадним суочавањима са датим антигеном, меморијске Т ћелије се ре-активирају користећи исте TCR путеве.
Везивање антиген-MHC пара са TCR комплексом и CD4 такође помаже ћелијску адхезију APC и Th ћелија током Th ћелијске активације. Протеин интегрин LFA-1 на Т ћелијама и ICAM на APC ћелијама су примарни молекули адхезије те ћелијске интеракције.
Улога гломазног ектрацелуларног CD45 региона у ћелијској интеракцији није позната. CD45 има више изоформи које мењају величину у зависности од Th ћелијске активације и статуса матурације. На пример, CD45 дужина се смањује након Th активације (CD45RA+ у CD45RO+). Није познато да ли та промена дужине има утицаја на активацију. Било је предложено да дужи CD45RA+ могу да умање приступност Т ћелијским рецепторима за антиген-MHC молекуле, чиме се условљава потреба за порастом афинитета (и специфичности) Т ћелије да би дошло до активације. Кад једном дође до активације, CD45 се скраћује, што олакшава интеракције и активацију ефекторских Т помоћних ћелија.[2]
Верификација (Сигнал 2)[уреди | уреди извор]
Након првог TcR/CD3 сигнала, наивне Т ћелије могу да активирају други независни биохемијски пут, који је познат као Сигнал 2. Овај верификациони корак је заштитна мера којом се осигурава да Т ћелија одговара на страни антиген. Ако овај други сигнал није присутан током иницијалног излагања антигену, Т ћелија претпоставља да је ауто-реактивна. То резултује у њеној анергијској реакцији (до анергије доводе незаштићене биохемијске промене Сигнала 1). Анергијске ћелије нису респонзивне на антигене, чак и ако су оба сигнал касније присутна. За те ћелије се сматра да бесциљно циркулишу кроз тело до не подлегну апоптози на крају њиховог животног века.
Други сигнал обухвата интеракцију између CD28 на CD4+ Т ћелији и протеина CD80 (B7.1) или CD86 (B7.2) на професионалним APC ћелијама. Оба CD80 и CD86 активирају CD28 рецептор. Ти протеини су такође познати као костимулаторни молекули.
Мада је верификациони ступањ неопходан за активацију наивних помоћних Т ћелија, важност тог ступња је најбоље демонстрирана током сличног активационог механизма CD8+ цитотоксичних Т ћелија. Како наивне CD8+ Т ћелије немају урођену склоност према страним изворима, те Т ћелије су зависне од CD28 активације за потврду да оне препознају страни антиген (CD80/CD86 су само изражени на активним АПЦ ћелијама). CD28 игра важну улогу у умањењу ризика од Т ћелијске ауто-имуности против антиагената домаћина.
Кад су једном оба пута наивних Т ћелија активирана, биохемијске промене индуковане сигналом 1 се модификују, чиме се омогућава ћелијска активација уместо анергије. Други сигнал онда постаје неважан; само је први сигнал неопходан за будућу активацију. То такође важи за меморијске Т ћелије, што је један од примера стечене имуности. Бржи одговор се јавља након реинфекције зато што су меморијске Т ћелије већ прошле кроз потврдни ступањ и могу да произведу ефекторске ћелије много брже.
Пролиферација[уреди | уреди извор]
Кад је једном дво-сигнална активација комплетна Т помоћне ћелије (Th) се пролиферирају. То је омогућено ослобађањем потентног фактора раста Т ћелија интерлеукин 2 (IL-2), који дејствује у аутокрином маниру. Активиране Т ћелије такође производе алфа под-јединицу IL-2 рецептора (CD25 или IL-2R), чиме оспособљавају потпуно функционални рецептор који се може везати са IL-2.[3]
Матурација[уреди | уреди извор]
Након више ћелијских генерација, Th ћелијски прогенитори се диференцирају у ефекторске Th ћелије, меморијске Th ћелије, и регулаторне Th ћелије.
- Ефекторске Th ћелије излучују цитокине, протеини или пептиде који стимулишу или интерагују са другим леукоцитима, укључујуће Th ћелије.
- Меморијске Th ћелије задржавају антигенски афинитет оригинално активираних Т ћелија. Оне дејствују током другог имунског одговора (нпр. ако дође до накнадне реинфекције домаћина).
- Регулаторне Т ћелије не промовишу имунску функцију, него дејствује да је умање. Упркос њиховој ниској заступљености током инфекције, за њх се сматра да имају важну улогу у само-ограничавању имунског система. За њих је било показано да спречавају развој разних аутоимуних болести.
Продукција IL-2 од стране помоћних Т ћелија је такође неопходна за пролиферацију активираних CD8+ Т ћелија. Без интеракције са помоћним Т ћелијама, CD8+ Т ћелије не развијају ефекторску функцију, и евентуално подлежу апоптози. Ова узајамна зависност од помоћних Т ћелија је још један начин на који имунски систем покушава да спречи Т ћелијама посредоване аутоимуне болести.
Детерминација одговора ефекторских Т ћелија[уреди | уреди извор]
Помоћне Т ћелије имају способност вршења утицаја на низ имунских ћелија. Произведени Т ћелијски респонс (што обухвате екстрацелуларне сигнале као што су цитокини) може бити есенцијалан за успешни исход одговора на инфекцију. Да би биле ефективне помоћне Т ћелије морају да установе који цитокини ће омогућити имунском систему да буде најкористнији за домаћина. Детаљно разумевање начина на који помоћне Т ћелије одговарају на имунске изазове је један од главних интереса у имунолошким истраживањима. Разумевање њихових одговора може бити веома корисно у лечењу болести у повећању ефикасности вакцинације.
Th1/Th2 модел за помоћне Т ћелије[уреди | уреди извор]
Пролиферирајуће помоћне Т ћелије које могу да се развију у ефекторске Т ћелије се диференцирају у два главан подтипа ћелија позната као Th1 и Th2 ћелије (или Тип 1 и Тип 2 помоћне Т ћелије).
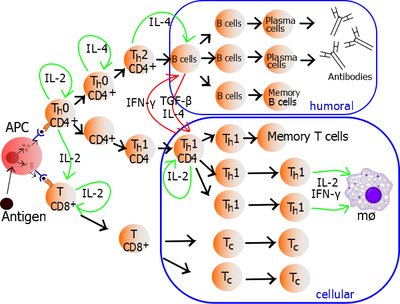
| Тип 1/ Th1 | Тип 2/ Th2 | |
| Ћелијски тип главног партнера | Макрофаг | Б ћелија |
| Произведени цитокини | интерферон-γ и фактор некрозе тумора-бета. (Интерлеукин 2 је био класично асоциран са Th1 ћелијама, али та асоцијација можда уноси забуну; IL-2 производе све помоћне Т ћелије у раном периоду њихове активације.) | интерлеукин 4, интерлеукин 5, интерлеукин 6, интерлеукин 10, интерлеукин 13 |
| Промовисана имунска стимулација | Ћелијски имунски систем. Максимизира ефикасност макрофагног убијања и пролиферацију цитотоксичних CD8+ Т ћелија. Такође производи опсонинска антитела | Хуморални имунски систем. Стимулише Б ћелије у пролиферацију, индукцију Б-ћелијске промене класе антитела, и повишење производње неутрализујућих антитела. |
| Друге функције | Тип 1 цитокин IFN-γ повишава продукцију интерлеукин-12 дендритских ћелија и макрофага, и путем позитивне повратне спреге, IL-12 стимулише продукцију IFN-γ у помоћним Т ћелијама, чиме се промовише Th1 профил. IFN-гама такође инхибира продукцију цитокина као што су интерлеукин-4, који је важан цитокин везан за Тип 2 респонс, и на тај начин ради на очувању сопственог респонса. | Тип 2 респонс промовише свој профил користећи два цитокина. Интерлеукин-4 дејствује на помоћне Т ћелије да промовише продукцију Th2 цитокина (што обухвата ауто-регулаторно дејство), док интерлеукин 10 (IL-10) инхибира низ цитокина укључујући интерлеукин 2 и IFN-γ у помоћним Т ћелијама и IL-12 у дендритским ћелијама и макрофагама. |
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ Тхомас Ј. Киндт; Рицхард А. Голдсбy; Барбара Анне Осборне; Јанис Кубy (2006). Кубy Иммунологy (6 изд.). Неw Yорк: W Х Фрееман анд цомпанy. ИСБН 1429202114.
- ^ де Јонг Р, Броуwер M, Миедема Ф, ван Лиер РА (1991). „Хуман ЦД8+ Т лyмпхоцyтес цан бе дивидед инто ЦД45РА+ анд ЦД45РО+ целлс wитх дифферент реqуирементс фор ацтиватион анд дифферентиатион”. Ј. Иммунол. 146 (7): 2088—94. ПМИД 1826015.
- ^ Мире-Слуис, Антхонy Р.; Тхорпе, Робин, ур. (1998). Цyтокинес (Хандбоок оф Иммунопхармацологy). Бостон: Ацадемиц Пресс. ИСБН 0-12-498340-5.
- ^ Ранг, Х. П. (2003). Пхармацологy. Единбургх: Цхурцхилл Ливингстоне. ISBN 978-0-443-07145-4. Паге 223
