Тиоцијанат

| |
| Називи | |
|---|---|
| IUPAC назив
cijanosulfanid
| |
| Други називи
сулфоцијанат, тиоцијанид
| |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| |
| Својства | |
| SCN- | |
| Моларна маса | 58,0824 |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
Тиоцијанат или роданид је ањон [SCN]−. Он је коњугована база тиоцијанске киселине. Примери једињења са овом групом су безбојне соли калијум тиоцијанат и натријум тиоцијанат. Жива(II) тиоцијанат је некад кориштена у пиротехничким смесама. Органска једињења која садрже ову функционалну групу се такође називају тиоцијанатима.
Тиоцијанат је аналоган цијанатном јону, [OCN]−, кисеоник је замењен сумпором. [SCN]− је један од псеудохалида, у смислу сличности његових реакција са халидним јонима. Тиоцијанат се формира реакцијом елементарног сумпора или тиосулфата са цијанидом:
- 8 CN− + S8 → 8 SCN−
- CN− + S2O32− → SCN− + SO32−
Другу реакцију катализује ензим сулфотрансфераза, познат као роданаза. Та реакција је релевантна за детоксификацију цијанида у телу.
Структура, везивање и координациона хемија[уреди | уреди извор]
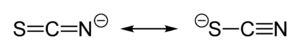
Тиоцијанат приближно једнако дели своје негативно наелектрисање између сумпора и азота. Консеквентно, тиоцијанат може да делује као нуклеофил на било сумпору или азоту. [SCN]− такође може да премоштава (M−SCN−M) или чак три метала (>SCN− или −SCN<). Експериментална евиденција доводи до општог закључка да класа А метала тежи да формира N-везане тиоцијанатне комплексе, док метали класе Б формирају S-везане тиоцијанатне комплексе. Други фактори, е.г. кинетика и растворљивост, понекад имају утицаја, те долази до изомеризма веза, на пример [Co(NH3)5(NCS)]Cl2 и [Co(NH3)5(SCN)]Cl2.[3]
Органски тиоцијанати[уреди | уреди извор]
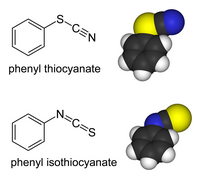
Тиоцијанатни деривати органиских једињења и прелазних метала могу да постоје као изомери веза. У тиоцијанатима, органска група (или метални јон) је везан за сумпор: R−S−C≡N има S-C једноструку везу и C-N троструку везу.[4] У изотиоцијанатима, супституент је везан за азот: R−N=C=S има S-C двоструку везу и C-N двоструку везу:
Органски тиоцијанати се могу хидролизовати до тиокарбамата.[5][6]
Референце[уреди | уреди извор]
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II изд.). Oxford: Butterworth-Heinemann. стр. 326. ISBN 0080379419.
- ^ Guy, R. G. (1977). „Syntheses and Preparative Applications of Thiocyanates”. Ур.: Patai, S. Chemistry of Cyanates and Their Derivatives. 2. New York: John Wiley.
- ^ Randolph Riemschneider; G. Orlick (1952). „Die Schmelzpunkte primärer Monothiocarbamidsäure-S-n-alkyl-ester Thiocarbamate. VI. Mitteilung”. Angewandte Chemie. 64 (15): 429. doi:10.1002/ange.19520641506.
- ^ R. Riemschneider; F. Wojahn & G. Orlick (1951). „Thiocarbamates. III.1 Aryl Thiocarbamates from Aryl Thiocyanates”. Journal of the American Chemical Society. 73 (12): 5905—5907. doi:10.1021/ja01156a552.