Волтаметрија


Волтаметрија је класа електроаналитичких метода која се користи у аналитичкој хемији и разним индустријским процесима. У волтаметрији се информација о аналиту добија мерењем струје док се потенцијал варира.[1][2]
Три електродни систем[уреди | уреди извор]
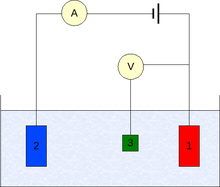
Волтаметријски експерименти испитује полу ћелијску реактивност аналита. Волтаметрија је студија струје у функцији примењеног потенцијала.
Криве I = f(E) се називају волтамограми. Потенцијал се арбитрарно варира било степен по степен или континуирано, и вредност струје се мери као зависна променљива. Супротан приступ, тзв. амперометрија, је такође могућ али није уобичајен.
Облик кривих зависи од брзине варијације потенцијала (природа покретачка снага) и од тога да ли се раствор меша или је у мировању (масени трансфер).
Већина експеримента контролише потенцијал (волт) електроде у контакту са аналитом, док се мери резултујућа струја (ампер).[3]
За извођење експеримента потребне су најмање две електроде. На радну електроду која долази у контакт са аналитом се мора применити жељени потенцијал на контролисани начин да би се омогућио пренос наелектрисања на и са аналита. Друга електрода је други део ћелије. Она мора да има познат потенцијал којим се подешава потенцијал радне електроде. Она исто тако балансира наелектрисање додато или уклоњено са радне електроде. Иако је ово одржива постава, она има низ недостатака. Најзначајнији од њих је да је веома тешко да се одржи константни потенцијал електроде.
Да би се решио овај проблем, улоге снабдевања електронима и референтног потенцијал су подељене између две засебне електроде. Референтна електрода је половина ћелије са познатим редукционим потенцијалом. Њена једина улога је да делује као референца у мерењу и контроли потенцијала радне електроде. Он не спроводи струју. Помоћна електрода спроводи струју неопходну за балансирање струје радне електроде. Да би се то остварило, помоћна електрода ће ћесто попримити екстремне потенцијала на границама опсега растварача, где она оксидише или редукује растварач или подржавајући електролит. Ове електроде, радна, референтна и помоћна сачињавају модерне три електродне системе.
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ Киссингер, Петер; Хеинеман, Wиллиам Р. (23. 1. 1996). Лабораторy Тецхниqуес ин Елецтроаналyтицал Цхемистрy, Сецонд Едитион, Ревисед анд Еxпандед (2 изд.). ЦРЦ. ИСБН 978-0-8247-9445-3.
- ^ Зоски, Цyнтхиа Г. (7. 2. 2007). Хандбоок оф Елецтроцхемистрy. Елсевиер Сциенце. ИСБН 978-0-444-51958-0.
- ^ Бард, Аллен Ј.; Фаулкнер, Ларрy Р. (18. 12. 2000). Елецтроцхемицал Метходс: Фундаменталс анд Апплицатионс (2 изд.). Wилеy. ИСБН 978-0-471-04372-0.
Литература[уреди | уреди извор]
- Реинмутх, W. Х. (1. 11. 1961). „Тхеорy оф Статионарy Елецтроде Поларограпхy”. Аналyтицал Цхемистрy. 33 (12): 1793—1794. дои:10.1021/ац60180а004.
- Скоог, Доуглас А.; Wест, Доналд M.; Ф. Јамес Холлер (1995). Фундаменталс оф Аналyтицал Цхемистрy (7тх изд.). Харцоурт Браце Цоллеге Публисхерс. ИСБН 978-0-03-005938-4.
- Занелло, П. (2003). Инорганиц Елецтроцхемистрy: Тхеорy, Працтице, анд Апплицатион (1 изд.). Роyал Социетy оф Цхемистрy. ИСБН 978-0-85404-661-4.
