Ajnštajnijum
 | ||||||||||||||||||||||||||||||||||||||||
| Opšta svojstva | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ime, simbol | ajnštajnijum, Es | |||||||||||||||||||||||||||||||||||||||
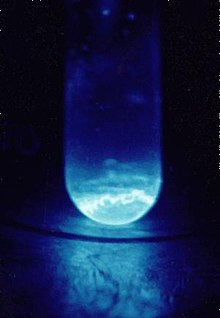
| Izgled | srebrnast; blista plavo u mraku | |||||||||||||||||||||||||||||||||||||||
| U periodnom sistemu | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Atomski broj (Z) | 99 | |||||||||||||||||||||||||||||||||||||||
| Grupa, perioda | grupa N/D, perioda 7 | |||||||||||||||||||||||||||||||||||||||
| Blok | f-blok | |||||||||||||||||||||||||||||||||||||||
| Kategorija | aktinoid | |||||||||||||||||||||||||||||||||||||||
| Rel. at. masa (Ar) | 252,082980(54)[1] | |||||||||||||||||||||||||||||||||||||||
| Maseni broj | 252 (najstabilniji izotop) | |||||||||||||||||||||||||||||||||||||||
| El. konfiguracija | ||||||||||||||||||||||||||||||||||||||||
po ljuskama | 2, 8, 18, 32, 29, 8, 2 | |||||||||||||||||||||||||||||||||||||||
| Fizička svojstva | ||||||||||||||||||||||||||||||||||||||||
| Tačka topljenja | 1133 K (860 °C, 1580 °F) | |||||||||||||||||||||||||||||||||||||||
| Tačka ključanja | 1269 K (996 °C, 1825 °F) (procenjeno) | |||||||||||||||||||||||||||||||||||||||
| Gustina pri s.t. | 8,84 g/cm3 | |||||||||||||||||||||||||||||||||||||||
| Atomska svojstva | ||||||||||||||||||||||||||||||||||||||||
| Elektronegativnost | 1,3 | |||||||||||||||||||||||||||||||||||||||
| Energije jonizacije | 1: 619 kJ/mol | |||||||||||||||||||||||||||||||||||||||
| Ostalo | ||||||||||||||||||||||||||||||||||||||||
| Kristalna struktura | postraničnocentr. kubična (FCC) | |||||||||||||||||||||||||||||||||||||||
| Magnetni raspored | paramagnetičan | |||||||||||||||||||||||||||||||||||||||
| CAS broj | 7429-92-7 | |||||||||||||||||||||||||||||||||||||||
| Istorija | ||||||||||||||||||||||||||||||||||||||||
| Imenovanje | po Albertu Ajnštajnu | |||||||||||||||||||||||||||||||||||||||
| Otkriće | Nacionalna laboratorija Lorens Berkli (1952) | |||||||||||||||||||||||||||||||||||||||
| Glavni izotopi | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
Ajnštajnijum (lat. einsteinium) jeste veštački hemijski element sa simbolom Es i atomskim brojem 99. U periodnom sistemu smješten je u grupu aktinoida (7. perioda, f-blok) te se prema tome ubraja u transuranijske elemente. Ajnštajnijum je radioaktivni metal, koji se u laboratoriji može dobiti u jedva merljivim količinama. Otkriven je nakon probe prve američke hidrogenske bombe 1952. godine, a dobio je ime u čast Alberta Ajnštajna, iako on lično nije učestvovao u otkriću niti u izučavanju ovog elementa. U vrlo malim količinama nastaje u nuklearnim reaktorima. Metalni ajnštajnijum kao i njegova jedinjenja sintetišu se u vrlo malim količinama, uglavnom u svrhu proučavanja.
Istorija[uredi | uredi izvor]

hromatografsko odvajanje elemenata Fm (100), Es (99), Cf, Bk, Cm, Am.
Ajnštajnijum, zajedno sa fermijumem, otkriven je nakon izvršene probe prve američke hidrogenske bombe, nazvane Ajvi Majk, 1. novembra 1952. godine na atolu Enivetok. Prvi uzorci ovog elementa pronađeni su na posebnim filter-papirima, zakačenim na avione koji su u svrhu istraživanja prolazili kroz oblak nastao pri eksploziji. Nešto veće količine ajnštajnijuma izolovane su naknadno iz koralnih grebena oko atola. Iz razloga vojne tajne, rezultati tog istraživanja nisu odmah objavljeni.[2]
Prva proučavanja ostataka nastalih nakon eksplozije, pokazali su nastanak novog izotopa plutonijuma 244Pu, a smatralo se da je on mogao nastati samo primanjem šest neutrona u jezgro uranijuma 238U, a nakon toga usledila su dva uzastopna β-raspada.
U to vreme, smatralo se da je apsorpcija neutrona u teško jezgro nekog atoma jedan vrlo redak proces. Identifikovanje izotopa 244Pu navelo je naučnike na zaključak da se u jezgro uranijuma mogu „hvatati” brojni neutroni, što bi ultimatno dovelo do sinteze nekog novog elementa.[2]
Odvajanje rastvorenih jona aktinoida uspelo je primenom jonsko-izmenjivačke tehnike u okruženju određenih bafera limunske kiseline i amonijum citrata u slabo kiselom mediju (pH ≈ 3,5) i povišenoj temperaturi. Element 99 (ajnštajnijum) vrlo brzo je dokazan; napre je dokazano prisustvo izotopa 253Es, koji je visokoenergetski α-emiter (6,6 MeV).[2] On nastaje iz uranijuma 238U zahvatom 15 neutrona, nakon čega sledi sedam β-raspada.[2]
Nastanak ovih izotopa putem nastavka zahvata neutrona bio je moguć zbog toga što je u trenutku detonacije bombe gustina toka neutrona bila tako visoka, tako da se većina, u međuvremenu nastalih radioaktivnih, atomskih jezgara nije stigla raspasti pre nego što je usledio sledeći zahvat neutrona. Tako pri izuzetno gustim tokom neutrona takođe značajno raste i maseni broj, bez da im se menja atomski broj. Tek tada nastali nestabilni nuklidi počinju da se raspadaju preko brojnih β-raspada do stabilnih ili nestabilnih nuklida sa visokim atomskim brojevima:
U septembru 1953. i dalje nije bilo naznaka kada bi se mogli objaviti rezultati istraživanja timova sa nacionalnih laboratorija Lovrenc Berkeli, Argon i Los Alamos. Odlučeno je da se novi elementi sintetišu putem eksperimenta bombardovanja atomskih jezgara, čime se istovremeno osiguralo da se rezultati tih otkrića ne drže kao vojne tajne, te su se zbog toga mogli i objaviti.[2] Ubrzo su u Radijacijskoj laboratoriji Univerziteta Kalifornije uspli da dobiju izotope ajnštajnijuma putem bombardovanja mete sačinjene od uranijuma (238U) atomima azota (14N). Međutim, kasnije su saznali da su već obavljena ispitivanja ovog elementa, ali su do tada važila za vojnu tajnu.[2][3] Izotopi oba novootkrivena elementa dobijeni su radijacijom izotopa 239Pu, a rezultati su objavljeni u pet naučnih časopisa u vrlo kratkom vremenskom intervalu.[4][5][6][7][8] Poslednje reakcije počev od kalifornijuma bile su:
Iz tih razloga, tim naučnika sa Berklija bio je zabrinut da bi druge grupe istraživača mogle bombardovanjem jonima otkriti i objaviti otkiće elementa 100, pre nego što se objave njihovi rezultati koji su do tada čuvani kao tajna.[2] Već krajem 1953. i početkom 1954. radna grupa Nobelovog instituta za fiziku u Stokholmu izvršila je eksperiment bombardovanja uranijumovih atomskih jezgara jezgrima azota. Nastao je izotop elementa 100 sa masenim brojem 250 (250Fm).[9] Tim iz Berklija je već tada objavio neke rezultate hemijskih osobina oba novootkrivena elementa.[10][11] Najzad, sa rezultata termonuklearne eksplozije iz 1955. je skinuta oznaka tajnosti pa su ubrzo i objavljeni.[12][13]
Vrlo brzo je bilo jasno da je tim iz Berkija bio prvi koji je otkrio elemente, a čijih pet radova je nadmašivalo rezultate iz švedskih žurnala, te bilo potkrepljeno ranijim tajnim rezultatima dobijenim iz termonuklearne eksplozije iz 1952. godine. To je bio osnovni razlog da se ovom timu dodeli čast predloga imena novog elementa. Oni su se odlučili da elementu daju ime po poznatom, već tada preminulom naučniku. Uskoro su se sporazumeli da bi to mogla biti imena naučnika Ajnštajna i Fermija, od kojih je Ajnštajn umro neposredno pre objave otkrića:[2] Predlažemo ime za novi element sa atomskim brojem 99, „ajnštajnijum” (simbol E) u čast Alberta Ajnštajna, a ime za element sa atomskim brojem 100, "fermijum" (simbol Fm), prema imenu Enrika Fermija.[12] Zvaničnu objavu otkrića oba novootkrivena elementa ajnštajnijuma i fermijuma dao je Albert Giorso na Prvoj konferenciji o mirnodopskoj upotrebi atomske energije, održanoj u Ženevi od 8. do 20. avgusta 1955. godine.[2] Simbol hemijskog elementa ajnštajnijuma je kasnije promijenjen iz E u današnje Es.[14]
Osobine[uredi | uredi izvor]
U periodnom sistemu, ajnštajnijum sa atomskim brojem 99 nalazi se u grupi aktinoida. Njegov prethodnik je kalifornijum, a nakon njega sledi element fermijum. Analog ajnštajnijuma u grupi lantanoida je holmijum.
Fizičke[uredi | uredi izvor]
Ajnštajnijum je veštački, veoma radioaktivni metal, koji se topi na oko 860 °C, a ključa na 996 °C. Njegova gustina je oko 8,84 g/cm3.[15] On se kristalizuje u kubnom kristalnom sistemu u prostornoj grupi Fmm sa parametrom rešetke a = 575 pm, što odgovara kubnoj površinski centriranoj rešeci (f.c.c.) odnosno kubnom najgušćem kuglastom pakovanju sa redosledom slojeva ABC. Radioaktivnost elementa je tako snažna da se zbog nje uništava metalna rešetka.[16] Metal je dvovalentan i ima značajno visoku volatilnost.[17] Smatra se velikom opasnošću za zdravlje u slučaju gutanja.[18]
Hemijske[uredi | uredi izvor]
Kao i svi drugi aktinoidi, i ajnštajnijum je izuzetno reaktivan. U vodenim rastvorima najstabilniji je u trovalentnom oksidacijskom stanju, a poznata su njegova jedinjenja i u dvo- i četvorovalentnom stanju. Dvovalentna jedinjenja se mogu dobiti u čvrstom stanju, dok se četvorovalentna jedinjenja mogu dobiti u količinama u tragovima pomoću tehnika hemijskog transporta, mada konačna potvrda za to još nije objavljena.[14] Vodeni rastvori jona Es3+ su svetlo ružičaste boje.[19]
Reference[uredi | uredi izvor]
- ^ Meija, J.; et al. (2016). „Atomic weights of the elements 2013 (IUPAC Technical Report)”. Pure and Applied Chemistry. 88 (3): 265—291. doi:10.1515/pac-2015-0305.
- ^ a b v g d đ e ž z Albert Ghiorso: Einsteinium and Fermium, Chemical & Engineering News, 2003.
- ^ Albert Ghiorso; et al. (1954). „Reactions of U238 with Cyclotron-Produced Nitrogen Ions”. Physical Review. 93 (1): 257–257. doi:10.1103/PhysRev.93.257.
- ^ S. G. Thompson; et al. (1954). „Transcurium Isotopes Produced in the Neutron Irradiation of Plutonium”. Physical Review. 93 (4): 908–908. doi:10.1103/PhysRev.93.908.
- ^ B. G. Harvey; et al. (1954). „Further Production of Transcurium Nuclides by Neutron Irradiation”. Physical Review. 93 (5): 1129–1129. doi:10.1103/PhysRev.93.1129.
- ^ M. H. Studier; et al. (1954). „Elements 99 and 100 from Pile-Irradiated Plutonium”. Physical Review. 93 (6): 1428–1428. doi:10.1103/PhysRev.93.1428.
- ^ P. R. Fields; et al. (1954). „Additional Properties of Isotopes of Elements 99 and 100”. Physical Review. 94 (1): 209–210. doi:10.1103/PhysRev.94.209.
- ^ G. R. Choppin; et al. (1954). „Nuclear Properties of Some Isotopes of Californium, Elements 99 and 100”. Physical Review. 94 (4): 1080–1081. doi:10.1103/PhysRev.94.1080.
- ^ Hugo Atterling; et al. (1954). „Element 100 Produced by Means of Cyclotron-Accelerated Oxygen Ions”. Physical Review. 95 (2): 585—586. doi:10.1103/PhysRev.95.585.2.
- ^ G. T. Seaborg; et al. (23. 7. 1954). „Chemical Properties of Elements 99 and 100”. Berkeley: Radiation Laboratory, University of California.
- ^ S. G. Thompson; et al. (1954). „Chemical Properties of Elements 99 and 100”. J. Am. Chem. Soc. 76 (24): 6229—6236. doi:10.1021/ja01653a004.
- ^ a b A. Ghiorso; S. G. Thompson; G. H. Higgins; G. T. Seaborg; M. H. Studier; P. R. Fields; S. M. Fried; H. Diamond; J. F. Mech; et al. (1955). „New Elements Einsteinium and Fermium, Atomic Numbers 99 and 100”. Physical Review. 99 (3): 1048—1049. doi:10.1103/PhysRev.99.1048.
- ^ P. R. Fields; M. H. Studier; H. Diamond; J. F. Mech; M. G. Inghram; G. L. Pyle; C. M. Stevens; S. Fried; W. M. Manning; A. Ghiorso; S. G. Thompson; G. H. Higgins; G. T. Seaborg (1956). „Transplutonium Elements in Thermonuclear Test Debris”. Physical Review. 102 (1): 180—182. doi:10.1103/PhysRev.102.180.
- ^ a b Richard G. Haire (2006). „Einsteinium”. Ur.: Lester R. Morss; Norman M. Edelstein; Jean Fuger. The Chemistry of the Actinide and Transactinide Elements (PDF). Dordrecht: Springer. str. 1577—1620. ISBN 1-4020-3555-1. Arhivirano iz originala (PDF) 17. 07. 2010. g. Pristupljeno 30. 12. 2020.
- ^ R. G. Haire (1990). „Properties of the Transplutonium Metals (Am-Fm)”. Metals Handbook. 2 (10 izd.). Ohio: ASM International, Materials Park. str. 1198—1201.
- ^ R. G. Haire; R. D. Baybarz (1979). „Studies of einsteinium metal” (PDF). Journal de Physique Colloques. 40 (C4): 101—102. doi:10.1051/jphyscol:1979431.
- ^ Phillip D. Kleinschmidt; et al. (1984). „Henry’s Law vaporization studies and thermodynamics of einsteinium‐253 metal dissolved in ytterbium”. Journal of Chemical Physics. 81: 473—477. doi:10.1063/1.447328.
- ^ Hoffman, Darleane C.; Ghiorso, Albert; Seaborg, Glenn Theodore (2000). The Transuranium People: The Inside Story. Imperial College Press. str. 190–191. ISBN 978-1-86094-087-3.
- ^ A. F. Holleman; E. Wiberg; N. Wiberg (2007). „XXXVI: Die Actinoide”. Lehrbuch der Anorganischen Chemie (102 izd.). Berlin: de Gruyter. str. 1956. ISBN 978-3-11-017770-1.
Literatura[uredi | uredi izvor]
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd izd.). Butterworth–Heinemann. ISBN 978-0080379418.
- Haire, Richard G. (2006). „Einsteinium”. Ur.: Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements (PDF). 3 (3rd izd.). Dordrecht, the Netherlands: Springer. str. 1577—1620. ISBN 978-1-4020-3555-5. doi:10.1007/1-4020-3598-5_12. Arhivirano iz originala (PDF) 2010-07-17. g.
- Holleman, Arnold F.; Wiberg, Nils (2007). Textbook of Inorganic Chemistry (102nd izd.). Berlin: de Gruyter. ISBN 978-3-11-017770-1.
- Seaborg, G.T., ur. (23. 1. 1978). Proceedings of the Symposium Commemorating the 25th Anniversary of Elements 99 and 100 (PDF). Report LBL-7701.
Spoljašnje veze[uredi | uredi izvor]
- Einsteinium at The Periodic Table of Videos (University of Nottingham)
- Age-related factors in radionuclide metabolism and dosimetry: Proceedings – contains several health related studies of einsteinium



![{\displaystyle \mathrm {^{238}_{\ 92}U\ {\xrightarrow[{-2\ \beta ^{-}}]{+\ 6\ (n,\gamma )}}\ _{\ 94}^{244}Pu} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c4b60ac4bf0d4ebf96b6a71fefa86f13dd5784e0)
![{\displaystyle \mathrm {^{238}_{\ 92}U\ {\xrightarrow[{-7\ \beta ^{-}}]{+\ 15,\ 16,\ 17\ (n,\gamma )}}\ _{\ \ \ \ \ \ \ \ \ \ \ 99}^{253,\ 254,\ 255}Es} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/40a621970bb60c515339d427edbe5018ca880d2c)
![{\displaystyle \mathrm {^{252}_{\ 98}Cf\ {\xrightarrow {(n,\gamma )}}\ _{\ 98}^{253}Cf\ {\xrightarrow[{17,81\ d}]{\beta ^{-}}}\ _{\ 99}^{253}Es\ {\xrightarrow {(n,\gamma )}}\ _{\ 99}^{254}Es\ {\xrightarrow[{}]{\beta ^{-}}}\ _{100}^{254}Fm} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2dcf5875c42aad904ed8c8a397de8fc552cf5f71)
