Vestern blot
Vestern blot je tehnika koja koja se koristi u molekularnoj biologiji za detekciju određenog proteina u različitim uzorcima. Ova tehnika pruža i mogućnost određivanja nivoa ekspresije određenih proteina u različitim tkivnim ili ćelijskim lizatima. Detekcija proteina se zasniva na razdvajanju proteina na osnovu molekulske mase(elektroforezom) i specifičnoj interakciji antigen - antitelo (zato se naziva i imunoblotom). Antitelo, koje specifično prepoznaje određene aminokiselinske sekvence (epitope) određenog proteina i vezuje se za njih, ima za sebe konjugovan enzim koji omogućava vizuelizaciju signala. Na osnovu analize jačine dobijenog signala dobijamo broj koji pokazuje nivo ekspresije određenog proteina u različitim uzorcima. Ova metoda otkrivena je 1979. godine i od tada se rutinski koristi u molekularno biološkim istraživanjima.

Priprema uzoraka[uredi | uredi izvor]
Uzorak za Vestern blot čini kompleksna smeša proteina izdvojenih iz ćelije (lizat) . Upotrebom diferencijalnog centrifugiranja mogu se razdvojiti nukleusni, citoplazmatski i celokupni ćelijski lizat. Ekstrahovanje proteina iz ćelije se vrši mehaničkim usitnjavanjem tkiva (homogenizacijom) u prisustvu različitih pufera koji pospešuju oslobađanje proteina iz ćelije. Nakon centrifugiranja u supernatantu se nalazi kompleksna smeša proteina (lizat), dok se u talogu nalaze ostaci neusitnjenih komponenti ćelija. Radi sprečavnja degradacije proteina tokom procesa izolovanja u pufer za izolovanje se dodaju dodaju inhibitori proteaza prisutnih u uzorku i uzorci se procesuiraju na ledu (4 °C). Kako se epitop za vezivanje antitela obično nalazi unutar 3D konformacije proteina potrebno je denaturisati proteine kako bi se antitelu omogućio pristup. Za denaturaciju proteina se koristi najčešće pufer koji sadrži SDS, DTT, beta-merkaptoetanol, glicerol i uzorci se inkubiraju na 95 °C (toplotna denaturacija).[1]
Elektroforeza na gelu[uredi | uredi izvor]
Elektroforeza se koristi za razdvajanje proteina iz uzorka po molekulskoj masi na gelu. Za elektroforezu se najčešće koristi SDS poliakrilamidni gel kao podloga. SDS uniformiše naelektrisanja proteina iz uzorka tako da se kretanje duž gela vrši samo na osnovu molekulske mase. Proteini manje molekulske mase će se kretati brže kroz gel, dok će proteini veće molekulske mase kretati sporije. Kretanje proteina duž gela se zasniva na privlačenju proteina koji nose negativno naelekrisanje (koje im daje SDS) ka anodi (+) pod uticajem struje. Polimerizacija akrilamida se vrši dodavanjem amonijumpersulfata u prisustvu tetrametilendiamida (TEMED), zajedno sa dimerom akrilamida (N,N-metilen bisakrilamid). Od količine bisakrilamida zavisi stepen povezivanja akrilamidnih lanaca, a time i veličina pora. Za bolje razdvajanje proteina veće molekulske mase potrebno je da pore budu veće, dok su za razdvajanje proteina manje mase potrebne manje pore, tj. veća količina bisakrilamida koji će omogućiti bolju polimerizaciju.[2]

Transfer proteina na membranu[uredi | uredi izvor]
Nakon elektroforeze neophodno je izvršiti transfer proteina sa gala na PVFD(polivinildenfluorid) ili nitroceluloznu membranu da bi se omogućilo specifično vezivanje antitela. Membrana se postavlja prema anodi (+) dok se prema gelu postavlja katoda (-). Pod uticajem električnog polja negativno naelektrisani proteini se kreću prema anodi i prelaze na membranu održavajući položaj koji su imali na gelu. Nakon prenosa proteina na membranu neophodno je proveriti kvalitet prenosa. Provera se vrši bojenjem membrane Pončo S bojom.[3]

Blokiranje nespecifičnog vezivanja antittela na membranu[uredi | uredi izvor]
Da bi se sprečilo nespecifično vezivanje antitela potrebno je blokirati membranu. Blokiranje podrazumeva inkubiranje membrane u mleku (5%), ili rastvoru albumina iz seruma govečeta (5%). Nakon blokiranja, membranu je neophodno isprati. Pranjem se uklanjaju nevezani i slabo vezani proteini.[4]
Inkubacija membrane primarnim i sekundarnim antitelima[uredi | uredi izvor]
Identifikacija proteina se zasniva na njegovoj specifičnoj interakciji sa antitelom. Antitelo se specifično vezuje samo za protein od interesa. Ostatak nevezanih antitela se ispira. Zatim se membrana inkubira sekundarnim antitelom koje za sebe ima konjugovan enzim. Sekundarno antitelo prepoznaje vezano primarno antitelo i vezuje se za njega. Zato je neophodno da primarno i sekundarno antitelo budu iz istog domaćina. Sekundarno antitelo je konjugovano sa enzimom: peroksidazom izolovanom iz rena - (HRP) ili alkalnom fosfatazom (AP).
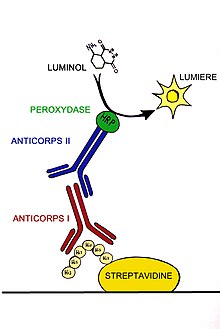
Detekcija signala[uredi | uredi izvor]
U zavisnosti od toga kako je sekundarno antitelo obeleženo detekcija signala može biti radioaktivna, fluorescentna, hemiluminiscentna. Hemiluminiscentna metoda detekcije podrazumeva vizuelizaciju hemiluminiscencije koja nastaje kao rezultat reakcije supstrata sa enzimom konjugovanim sa antitelom. Najčešća podloga za snimanje svetlosnog signala je X- ray film. X-ray film se postavlja direktno na membranu nakon reakcije izazvane enzimom vezanim za sekundarno antitelo. Dobijena slika se dezintometrijski skenira i u posebnom programu se analizira signal. Intenzitet specifičnog signala je u korelaciji sa nivoom ekspresije određenog proteina u datom uzorku. Da bismo bili sigurni da dobijeni signal zaista predstavljaju nivo ekspresije proteina od interesa u našim uzorcima, a ne posledicu nalivanja različitih količina uzoraka neophodno je uraditi poređenje detektovane ekspresije sa rezultatima endogene kontrole. Endogenu kontrolu čini neki od strukturnih proteina čija ekspresija je u svim uzorcima skoro identična (tubulin, aktin, GAPDH...). Ukoliko je nivo ekspresije proteina endogene kontrole isti u svim uzorcima onda se može pretpostaviti da detektovani signal zaista predstavlja nivo ekspresije datog proteina. Ukoliko nije, potrebno je prvo normalizovati ekspresiju proteina sa ekspresijom endogene kontrole.[5]
Reference[uredi | uredi izvor]
- ^ „Western Blot: Technique, Theory, and Trouble Shooting”.
- ^ Kurien, B.T.; Scofield, R.H. (2009). „Introduction to Protein Blotting”. Protein blotting and detection: methods and protocols. New York: Humana Press. str. 9—22.
- ^ „Protein atlas”.
- ^ „Western blot guide” (PDF).
- ^ „Termofisher”.
Literatura[uredi | uredi izvor]
- Kurien, B.T.; Scofield, R.H. (2009). „Introduction to Protein Blotting”. Protein blotting and detection: methods and protocols. New York: Humana Press. str. 9-22.
