Osmotski pritisak
Osmotski pritisak je hidrostatski pritisak potreban da bi se sprečio pomak vode izazvan osmolarnim gradijentom: što je veća razlika u osmolarnosti, veći je i osmotski pritisak.
Osmotski pritisak je pritisak rastvora na polupropusnu membranu kako bi se sprečilo da voda teče unutra kroz membranu. Toničnost je mera ovog pritiska. Ako je koncentracija rastvorenih supstanci na obe strane membrane jednaka, tada nema tendencije kretanja vode preko membrane i nema osmotskog pritiska. Rešenja su međusobno izotonična. Obično je na jednoj strani membrane veća koncentracija rastvorenih supstanci od druge.[1][2]
Rastvor koji sadrži više rastvorenih supstanci nego živa ćelija definiše se kao hipertonični; ako se ćelija nalazi u hipertoničnom rastvoru voda će izlaziti iz ćelije u okolinu i ćelija će se smanjiti. Hipotonični rastvor ima manju koncentraciju rastvorenih supstanci nego ćelija, pa ćelija u hipotoničnom okruženju nabubri, a ponekad se čak i raspadne od prekomernog bubrenja.
Difuzija naspram osmoze[uredi | uredi izvor]

Difuzija je kretanje čestica iz područja veće koncentracije u područje manje koncentracije. Na primer, ako dodate šećer u vodu, šećer će se difundirati kroz vodu sve dok koncentracija šećera u vodi ne bude konstantna u celom rastvoru. Još jedan primer difuzije je kako se miris parfema širi prostorijom.
Tokom osmoze, kao i kod difuzije, postoji tendencija čestica da traže istu koncentraciju kroz rastvor. Međutim, čestice mogu biti prevelike da pređu polupropusnu membranu koja razdvaja regione rastvora, pa se voda kreće preko membrane. Ako imate rastvor šećera na jednoj strani polupropusne membrane, a čistu vodu na drugoj strani membrane, uvek će biti pritiska na vodenoj strani membrane da pokuša razblažiti rastvor šećera.
Mali joni i molekuli mogu da pređu polupropusnu membranu, pa se rastvorene supstance poput malih jona (Na + , Cl - ) ponašaju slično kao kad bi se pojavila jednostavna difuzija.[1]
Hipertoničnost, izotoničnost i hipotoničnost[uredi | uredi izvor]
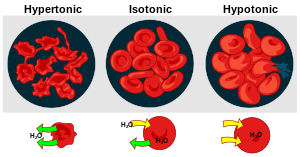
Toničnost rastvora u odnosu jedni na druge može se izraziti kao hipertonična, izotonična ili hipotonična. Efekat različitih spoljnih koncentracija rastvorenih supstanci na crvene krvne ćelije služi kao dobar primer za hipertonično, izotonično i hipotonično rešenje.[1]
Hipertonično rešenje ili hipertoničnost[uredi | uredi izvor]
Kada je osmotski pritisak rastvora izvan krvnih zrnaca veći od osmotskog pritiska unutar crvenih krvnih zrnaca, rastvor je hipertoničan . Voda unutar krvnih zrnaca izlazi iz ćelija u pokušaju da izjednači osmotski pritisak, što dovodi do smanjenja ili stvaranja ćelija.[1]
Izotonično rešenje ili izotoničnost[uredi | uredi izvor]
Kada je osmotski pritisak izvan crvenih krvnih zrnaca jednak pritisku unutar ćelija, rastvor je izotoničan u odnosu na citoplazmu. Ovo je uobičajeno stanje crvenih krvnih zrnaca u plazmi.[1]
Hipotonično rešenje ili hipotoničnost[uredi | uredi izvor]
Kada rešenje izvan crvenih krvnih zrnaca ima manju osmotski pritisak nego citoplazmi na crvenih krvnih zrnaca, rešenje je hipotonična u odnosu na ćelije. Ćelije uzimaju vodu u pokušaju da izjednače osmotski pritisak, uzrokujući da nabreknu i potencijalno puknu.[1]
Vidi još[uredi | uredi izvor]
Spoljašnje veze[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ a b v g d đ „Razumeti osmotski pritisak i toničnost”. Razumeti osmotski pritisak i toničnost (na jeziku: srpski). 2019-01-18. Pristupljeno 2021-11-10.
- ^ Voet, Donald (2002). Fundamentals of biochemistry upgrade. Judith G. Voet, Charlotte W. Pratt ([Rev. ed.] izd.). New York: Wiley. ISBN 0-471-41759-9. OCLC 46538398.
