Periodni sistem

| Deo serije članaka o |
| periodnom sistemu |
|---|
Periodni sistem je tabelarni prikaz hemijskih elemenata, raspoređenih na osnovu njihovog atomskog broja (broj protona), elektronske konfiguracije i ponavljajućih hemijskih osobina. Ovakav raspored pokazuje periodične zakone, a primer su elementi sa sličnim karakteristikama smešteni u istoj koloni. Takođe se razlikuju i četiri pravougaona bloka sa određenim, približno sličnim hemijskim osobinama. U principu, unutar jednog reda (periode) elemenata metali su na levoj, a nemetali na desnoj strani.
Redovi periodnog sistema nazivaju se periode, a kolone se nazivaju grupe. Šest grupa ima svoja imena, kao i brojeve; na primer: elementi 17. grupe su halogeni, dok su elementi 18. grupe plemeniti gasovi. Periodni sistem može da se koristi za izvođenje odnosa između svojstava različitih elemenata, te predviđanje svojstava novih elemenata koji se otkrivaju ili sintetišu. Periodni sistem pruža koristan okvir za analiziranje hemijskih karakteristika materije i široko se koristi u hemiji, fizici i drugim naukama.
Ruski hemičar Dmitrij Mendeljejev je 1869. godine objavio prvi opštepriznat periodni sistem. Svoj sistem razvio je da bi ilustrovao periodične zakone i svojstva tada poznatih elemenata. Mendeljejev je takođe predvidio neka svojstva tada nepoznatih elemenata, za koje se očekivalo da će da popune praznine u ovom sistemu. Većina njegovih predviđanja se pokazala tačnim kada su pomenuti elementi kasnije otkriveni. Mendeljejevljev periodni sistem od tada je znatno proširen i prerađen otkrivanjem ili sintetisanjem dodatnih novih elemenata, kao i razvojem novih teoretskih modela za objašnjavanje hemijskih principa.
Svi elementi od atomskog broja 1 (vodonik) do 118 (oganeson) otkriveni su ili sintetisani, a poslednje proširenje periodnog sistema (nihonijum, moskovijum, tenesin i oganeson; imenovani 28. novembra 2016) Međunarodna unija za čistu i primenjenu hemiju (IUPAC) potvrdila je 30. decembra 2015. godine; prvih sedam redova periodnog sistema je kompletirano.[1][2] Prva 94 elementa postoje prirodno, iako se neki mogu pronaći samo u tragovima i bili su sintetisani u laboratorijama pre nego što su pronađeni u prirodi.[n. 1] Elementi sa atomskim brojem iz intervala 95—118 jedino su sintetisani u laboratorijama ili nuklearnim reaktorima.[3] Sinteza elemenata koji imaju veće atomske brojeve je ono čemu hemičari trenutno teže. Brojni sintetički radioizotopi elemenata koji se prirodno pojavljuju takođe su proizvedeni u laboratorijama.
Pregled[uredi | uredi izvor]
| Grupa | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Alkalni metali | Zemnoalkalni metali | Pniktogeni | Halkogeni | Halogeni | Plemeniti gasovi | ||||||||||||||
| Perioda |
|||||||||||||||||||
| 2 | |||||||||||||||||||
| 3 | |||||||||||||||||||
| 4 | |||||||||||||||||||
| 5 | |||||||||||||||||||
| 6 | |||||||||||||||||||
| 7 | |||||||||||||||||||
1 (crvena) = gasovito 3 (crna) = čvrsto 80 (zelena) = tečno 109 (siva) = nepoznato Boja atomskog broja pokazuje agregatno stanje (na 0 °C i 1 atm)
- Ca: 40,078 — formalna kratka vrednost, zaokruženo (nema nesigurnosti)[5]
- Po: [209] — maseni broj najstabilnijeg izotopa
Boja pozadine pokazuje potkategoriju u metalno-metaloidno-nemetalnom trendu:
| Metal | Metaloid | Nemetal | Nepoznata hemijska svojstva | |||||||
| Alkalni metal | Zemnoalkalni metal | Lantanoid | Aktinoid | Prelazni metal | Postprelazni metal | Poliatomski nemetal | Diatomski nemetal | Plemeniti gas | ||
Svaki hemijski element ima jedinstven atomski broj (Z), koji predstavlja broj protona u njegovom jezgru.[n. 2] Većina elemenata ima različit broj neutrona u različitim atomima, a ove varijante se nazivaju izotopima. Na primer, ugljenik ima tri izotopa koja se prirodno pojavljuju: svi njegovi atomi imaju šest protona i većina ima šest neutrona takođe, ali oko jedan procenat ima sedam neutrona (postoji i veoma mali broj sa osam neutrona). Izotopi se nikada ne izdvajaju u periodnom sistemu; oni se uvek grupišu zajedno s pojedinim elementom. Elementi koji nemaju stabilnih izotopa imaju atomske mase svojih najstabilnijih izotopa, a ukoliko su takve mase prikazane — iste se nalaze u zagradama.[6]
U standardnom periodnom sistemu, elementi se ređaju rastuće prema svom atomskom broju (broj protona u jezgru atoma). Novi red (perioda) započinje se kada nova elektronska ljuska dobije svoj prvi elektron. Kolone (grupe) određene su elektronskom konfiguracijom atoma; elementi sa istim brojem elektrona u pojedinoj podljusci svrstavaju se u iste kolone (npr. kiseonik i selen su istoj koloni jer oba imaju po četiri elektrona u svojoj spoljašnjoj, p-podljusci). Elementi sa sličnim hemijskim svojstvima generalno se svrstavaju u iste grupe periodnog sistema, s tim da u f-bloku i određenim delovima d-bloka elementi i u istoj periodi takođe teže posedovanju sličnih svojstava. Prema tome, relativno je lako predvideti hemijska svojstva elementa ako su poznata svojstva elemenata koji ga okružuju.[7]
Periodni sistem je na kraju 2016. godine imao 118 potvrđenih elemenata; element broj 1 je vodonik, a element broj 118 je oganeson. Elemente 113, 115, 117 i 118 zvanično je potvrdila Međunarodna unija za čistu i primenjenu hemiju (skr. IUPAC) decembra 2015. godine.[1] Predložena imena za ove elemente — nihonijum (Nh), moskovijum (Mc), tenesin (Ts) i oganeson (Og) — IUPAC je objavio juna 2016. godine;[8] formalno ih je potvrdio po isteku petomesečnog javnog roka za raspravu, novembra 2016. godine.[9] Do tada, ovi elementi morali su da se formalno identifikuju svojim atomskim brojem (npr. „element 113”) ili svojim privremenim sistematskim imenom (npr. „ununtrijum”, simbol „Uut”).[10]
Prva 94 elementa se pojavljuju u prirodi; ostala 24 elementa, od americijuma do oganesona (95—118), dobijaju se samo sintetisanjem u laboratorijama. Od 94 elementa koja se nalaze prirodno, 83 su primordijalna dok ostalih 11 može da se pronađe samo u lancima raspadanja primordijalnih elemenata.[3] Nijedan element teži od ajnštajnijuma (element 99) nikada nije posmatran u makroskopskim količinama u svojoj čistoj formi, a isti je slučaj i sa astatom (element 85); francijum (element 87) bio je jedino fotografisan u obliku svetla emitovanog u mikroskopskim količinama (300.000 atoma).[11]
Metodi grupisanja[uredi | uredi izvor]
Grupe[uredi | uredi izvor]
Grupa ili porodica je vertikalna kolona u periodnom sistemu. Grupe obično imaju značajnije periodične zakone od perioda i blokova, što je objašnjeno ispod. Moderne teorije kvantne mehanike za atomsku strukturu objašnjavaju grupne zakone predlažući da elementi u istoj grupi generalno imaju istu elektronsku konfiguraciju u svojoj valentnoj ljusci.[12] Sledstveno tome, elementi u istoj grupi teže posedovanju sličnih hemijskih osobina i ogledaju iste zakone u svojstvima kako se atomski broj povećava.[13] Međutim, u nekim delovima periodnog sistema — kao što je d-blok i f-blok — horizontalne sličnosti mogu da budu važne isto kao ili više naglašene nego vertikalne sličnosti.[14][15][16]
Prema međunarodnim konvencijama za imenovanje, grupe se numerički označavaju brojevima od 1 do 18 počev od krajnje leve kolone (alkalni metali) prema krajnjoj desnoj koloni (plemeniti gasovi).[17] Pre ovog načina označavanja, koristili su se rimski brojevi. U Americi, rimski brojevi su bili popraćeni slovom A ako je grupa bila u s-bloku ili p-bloku, odnosno slovom B ako je grupa bila u d-bloku. Rimski brojevi koristili su odgovarajuću varijantu za poslednju cifru iz današnjeg načina označavanja (npr. elementi 4. grupe bili su grupa IV B, dok su elementi 14. grupe bili grupa IV A). U Evropi, označavanje slovima bilo je gotovo isto, izuzev pravila da se koristi A ako je grupa pre 10. grupe, odnosno B ako je grupa 10. ili neka posle nje. Pored ovoga, grupe 8, 9 i 10 su se smatrale jednom grupom trostruke veličine, kolektivno poznatom na oba kontinenta kao grupa VIII. Novi sistem imenovanja IUPAC je uveo u upotrebu 1988. godine, kada stara imena za grupe postaju prevaziđena.[18]
Određene grupe dobile su trivijalna (nesistematska) imena, što se može videti u tabeli ispod, s tim da se neka retko koriste. Grupe 3—10 nemaju trivijalnih imena i o istima se govori jednostavno pominjući brojeve njihovih članova ili samo ime prvog člana (primer je alternativni naziv „skandijumova grupa” za 3. grupu), i to zato što ogledaju manje sličnosti i/ili vertikalnih zakonitosti.[17]
Elementi u istoj grupi pokazuju određene uzorke u pogledu atomskog radijusa, energije jonizacije i elektronegativnosti. Idući od vrha ka dnu grupe, atomski radijus elemenata se povećava. Pošto postoji više popunjenih energetskih nivoa, valentni elektroni se pronalaze dalje od jezgra. Od vrha, svaki uzastopni element ima nižu energiju jonizacije zato što je lakše ukloniti elektron (jer su atomi slabije vezani). Slično tome, u grupi se primećuje smanjenje elektronegativnosti idući s vrha prema dnu zbog povećavanja rastojanja između valentnih elektrona i jezgra.[19] Međutim, postoje i izuzeci od ovih zakonitosti; primer ovakvog odstupanja je 11. grupa, gde se elektronegativnost povećava idući ka dnu grupe.[20]
| IUPAC | 1 | 2 | 3a | a | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Mendeljejev (I—VIII) | I | II | III | IV | V | VI | VII | VIII | I | II | III | IV | V | VI | VII | b | ||||
| CAS (SAD, A–B–A) | IA | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | ||||
| Zast. IUPAC (Evropa, A–B) | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIII | IB | IIB | IIIB | IVB | VB | VIB | VIIB | 0 | ||||
| Trivijalno ime |
Alkalni metali | Zemnoalkalni metalir | Kovni metali | Trijeli | Tetreli | Pniktogenir | Halkogenir | Halogenir | Plemeniti gasovir | |||||||||||
| Ime po elementur | Litijumova grupa | Berilijumova grupa | Skandijumova grupa | Titanijumova grupa | Vanadijumova grupa | Hromova grupa | Manganova grupa | Gvožđeva grupa | Kobaltova grupa | Niklova grupa | Bakrova grupa | Cinkova grupa | Borova grupa | Ugljenikova grupa | Azotova grupa | Kiseonikova grupa | Fluorova grupa | Helijumova ili neonova grupa | ||
| 1. perioda | Hh | He | ||||||||||||||||||
| 2. perioda | Li | Be | B | C | N | O | F | Ne | ||||||||||||
| 3. perioda | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||
| 4. perioda | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||
| 5. perioda | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||
| 6. perioda | Cs | Ba | La | Ce—Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7. perioda | Fr | Ra | Ac | Th—Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
b Grupa 18, plemeniti gasovi, nije bila otkrivena u vreme Mendeljejevljevog originalnog sistema. Kasnije (1902), Mendeljejev je prihvatio dokaz za njihovo postojanje; mogu se staviti u novu „0. grupu”.
r Ime grupe po preporuci IUPAC-a.
h Vodonik (H), iako se nalazi u 1. koloni, ne smatra se delom grupe alkalnih metala.
Periode[uredi | uredi izvor]
Perioda je horizontalni red u periodnom sistemu. Iako grupe generalno imaju značajnije periodične zakone, postoje regioni gde su horizontalne zakonitosti bitnije od onih koji se vežu za grupe; primer je f-blok, gde lantanoidi i aktinoidi formiraju dva značajna horizontalna niza elemenata.[22]
Elementi u istoj periodi pokazuju uzorke u pogledu atomskog radijusa, energije jonizacije, elektronskog afiniteta i elektronegativnosti. Idući sleva nadesno kroz periode, atomski radijus obično opada. Ovo se dešava zato što svaki uzastopni element ima proton i elektron više, što uzrokuje veće privlačenje i približavanje elektrona jezgru.[23] Ovo smanjenje u veličini atomskog radijusa takođe uzrokuje povećanje u energiji jonizacije idući sleva nadesno kroz periode. Što je element jače vezan, veća energija je potrebna da bi se uklonio elektron. Elektronegativnost se povećava na isti način kao i energija jonizacije zbog privlačne sile koja deluje na elektrone iz jezgra.[19] Elektronski afinitet takođe pokazuje primetan trend kada se prolazi periodama; metali (leva strana perioda) obično imaju niži elektronski afinitet od nemetala (desna strana perioda), sa izuzetkom plemenitih gasova.[24]
Blokovi[uredi | uredi izvor]

Određeni regioni periodnog sistema mogu da se nazovu blokovima, a određuju se prema redosledu po kom se popunjavaju elektronske ljuske elemenata. Svaki blok je ime dobio prema podljusci u kojoj „poslednji” elektron pojmovno obitava.[25][n. 3] s-blok obuhvata prve dve grupe (alkalni i zemnoalkalni metali), te vodonik i helijum. p-blok obuhvata poslednjih šest grupa, a to su grupe 13—18 u IUPAC-ovom sistemu označavanja (3A—8A u američkom sistemu označavanja); pored ostalih elemenata, u ovom bloku su smešteni svi metaloidi. d-blok obuhvata grupe 3—12 (ili 3B—2B prema američkoj konvenciji) i sadrži sve prelazne metale. f-blok, uglavnom prikazan ispod glavnog dela periodnog sistema, nema članova grupa i obuhvata lantanoide i aktinoide.[26]
Metali, metaloidi i nemetali[uredi | uredi izvor]

Prema fizičkim i hemijskim osobinama koje dele, elementi se mogu svrstati u tri velike kategorije: metali, metaloidi i nemetali. Metali su uglavnom sjajne, dobro provodljive čvrste tvari koje jedna s drugom formiraju legure i s nemetalima jonska jedinjenja nalik soli (osim plemenitih gasova). Većina nemetala su obojeni ili bezbojni neprovodljivi gasovi; nemetali koji formiraju jedinjenja s drugim nemetalima stvaraju kovalentne veze. Između metala i nemetala nalaze se metaloidi, koji imaju prosečna ili izmešana svojstva.[27]
Metali i nemetali mogu da se dodatno klasifikuju u potkategorije koje pokazuju gradaciju od svojstava metala do svojstava nemetala, idući redovima sleva nadesno. Metali su dodatno podeljeni u visoko reaktivne alkalne metale, preko manje reaktivnih zemnoalkalnih metala, lantanoida i aktinoida te arhetipskih prelaznih metala, sve do fizički i hemijski slabih postprelaznih metala. Nemetali su jednostavno podeljeni na poliatomske nemetale (koji, kako su najbliži metaloidima, pokazuju neke početne karakteristike metala), diatomske nemetale (koji su suštinski nemetali) i monoatomske plemenite gasove (koji su potpuno nemetali i gotovo skroz inertni). Specijalizovana grupisanja kao što su refraktorni metali i plemeniti metali, koja su niže jedinice (u ovom primeru) prelaznih metala, takođe su prepoznata[28] i povremeno u upotrebi.[29]
Razvrstavanje elemenata u kategorije i potkategorije na osnovu svojstava koja dele je nesavršeno. Postoji spektar svojstava unutar svake od kategorija i nije teško pronaći preklapanja na granicama, kao što je to slučaj i s većinom klasifikacionih šema.[30] Berilijum, na primer, svrstan je u zemnoalkalne metale iako su njegova amfoterička hemija i tendencija ka formiranju kovalentnih jedinjenja atributi hemijski slabih ili postprelaznih metala. Radon je svrstan u grupu nemetala, a plemeniti gas i uprkos tome ima mnoga svojstva katjonske hemije koja je karakterističnija za metale. Druge šeme za klasifikaciju takođe su moguće, a primer je podela elemenata u kategorije mineraloških učestalosti ili kristalnih struktura. Kategorizacija elemenata na načine slične ovima datira najmanje do 1869. godine, kada je Hinrihs[31] napisao da jednostavne granične linije mogu da se nacrtaju na periodnom sistemu kako bi se označili elementi sa sličnim svojstvima, kao što su metali i nemetali ili elementi u gasovitom stanju.
Periodični trendovi i obrasci[uredi | uredi izvor]
Periodični zakoni ili zakoni periodičnosti (engl. periodic trends) predstavljaju zakonitosti koje proizilaze iz uporedbe svojstava hemijskih elemenata u pogledu ponavljajućih (periodičnih) karakteristika. Tu se ubrajaju valentni elektroni, atomski radijusi, energija jonizacije, elektronegativnost, elektronski afinitet te metalna i nemetalna svojstva. Povećanje ili smanjenje svojstava koja su određena ovim zakonitostima može da se primeti pri prolasku kroz redove i kolone periodnog sistema, a same zakonitosti određene su teorijama strukture atoma.
Elektronska konfiguracija[uredi | uredi izvor]

Elektronska konfiguracija ili organizacija elektrona koji kruže oko neutralnih atoma pokazuje ponavljajuće uzorke ili periodičnost. Elektroni popunjavaju nizove elektronskih ljuski (numerisanih kao 1. ljuska, 2. ljuska itd.). Svaka ljuska se sastoji iz jedne ili više podljuski (imenovanih slovima s, p, d, f i g). Kako se atomski broj povećava, elektroni progresivno popunjavaju ove ljuske i podljuske manje-više prateći Madelungovo pravilo ili pravilo o energetskom redosledu, kao što je prikazano na dijagramu. Elektronska konfiguracija za neon, na primer, zapisuje se kao 1s2 2s2 2p6. Sa atomskim brojem 10, neon ima 2 elektrona u svojoj prvoj ljusci te 8 elektrona u svojoj drugoj ljusci (2 u njenoj s-podljusci i 6 u njenoj p-podljusci). Povezujući ovo s periodnim sistemom, može se reći da kada elektron po prvi put popuni novu ljusku — počinje nova perioda; ove pozicije zauzimaju vodonik i alkalni metali.[32][33]

Pošto svojstva elementa u većem delu određuje njegova elektronska konfiguracija, svojstva elemenata tako pokazuju ponavljajuće uzorke ili periodično ponašanje, a neki od primera prikazani su u dijagramima ispod za atomske radijuse, energiju jonizacije i elektronski afinitet. Upravo je ova periodičnost svojstava, čije su manifestacije bile i često primećivane pre nego što je njihova fundamentalna teorija razvijena, dovela do uspostavljanja periodičnog zakona (činjenice da se elementi ponavljaju u različitim intervalima) i formiranja prvih periodnih sistema.[32][33]
Atomski radijusi[uredi | uredi izvor]
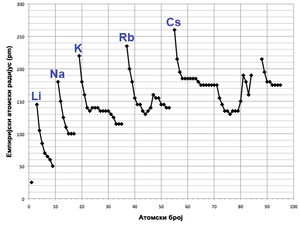
Atomski radijusi variraju na predvidljiv i objašnjiv način krećući se periodnim sistemom. Na primer, radijusi se generalno smanjuju duž svake od 7 perioda sistema, od alkalnih metala do plemenitih gasova; radijusi se povećavaju idući niz svaku od 18 grupa. Radijusi se povećavaju naglo između plemenitih gasova i kraja svake od perioda te alkalnih metala i početka sledeće periode. Ovakvi uzorci u veličini za atomske radijuse (i u raznim drugim hemijskim i fizičkim svojstvima elemenata) mogu da se objasne teorijom elektronske ljuske atoma; ovime su pruženi važni dokazi za razvijanje i potvrđivanje kvantne teorije.[34]
Elektroni u 4f-podljusci, koja se progresivno puni idući od cerijuma (element 58) do iterbijuma (element 70), nisu naročito efektivni u očuvanju porasta nuklearnog naboja pružajući otpor drugim spoljašnjim podljuskama. Elementi koji slede odmah nakon lantanoida imaju atomske radijuse koji su manji nego što se to očekuje i koji su gotovo jednaki atomskim radijusima elemenata smeštenih odmah iznad.[35] Tako hafnijum ima virtuelno isti atomski radijus (i hemiju) kao i cirkonijum, tantal ima atomski radijus gotovo jednak onom niobijuma itd. Ovo je poznato kao lantanoidna kontrakcija. Efekat lantanoidne kontrakcije može da se primeti sve do platine (element 78), posle čega biva zamaskiran relativističkim efektom poznatim kao efekat inertnog para.[36] Kontrakcija d-bloka, koja predstavlja sličan efekat između d-bloka i p-bloka, manje je naglašena nego lantanoidna kontrakcija ali se javlja usled sličnog uzroka.[35]
Energija jonizacije[uredi | uredi izvor]

Prva energija jonizacije je energija potrebna da se ukloni jedan elektron iz atoma, druga energija jonizacije je energija potrebna da se ukloni drugi elektron iz atoma itd. Za dati atom, uzastopne energije jonizacije povećavaju se stepenom jonizacije. Za magnezijum, na primer, prva energija jonizacije je 738 kJ/mol, a druga je 1450 kJ/mol. Elektroni u bližim orbitalama privlače se većim silama elektrostatičkog delovanja; prema tome, njihovo uklanjanje iz atoma zahteva više energije jer su smešteni na višim energetskim nivoima. Energija jonizacije se povećava idući nagore i nadesno u periodnom sistemu.[36]
Veliki skokovi u uzastopnim molarnim energijama jonizacije javljaju se pri uklanjanju elektrona iz konfiguracije plemenitog gasa (kompletna elektronska ljuska). Za magnezijum, ponovo, prve dve molarne energije jonizacije date iznad odgovaraju izuzimanju dva 3s-elektrona, dok je treća energija jonizacije mnogo veća (7730 kJ/mol) i potrebna je da se izuzme 2p-elektron iz veoma stabilne konfiguracije koju ima Mg2+ i koja je nalik onoj neona. Sličan skok u energijama jonizacije javlja se i kod drugih atoma 3. reda.[36]
Elektronegativnost[uredi | uredi izvor]

Elektronegativnost je tendencija atoma da privlači elektrone.[37] Elektronegativnost atoma određuje i njegov atomski broj i rastojanje između valentnih elektrona i jezgra. Što je elektronegativnost veća, element više privlači elektrone. Ovaj princip je 1932. godine prvi predložio Lajnus Poling.[38] Uopšteno govoreći, elektronegativnost se povećava idući sleva nadesno duž perioda, a smanjuje spuštajući se niz grupe. Stoga, fluor je najelektronegativniji od svih elemenata,[n. 5] dok je cezijum najmanje elektronegativan element (barem od onih za koje su priznati eksperimentalni rezultati dostupni).[20]
Postoji nekoliko izuzetaka od ovog opšteg pravila. Galijum i germanijum imaju veće elektronegativnosti od aluminijuma i silicijuma (redom) zbog prisutnosti efekta kontrakcije d-bloka. Elementi 4. periode odmah ispod prvog reda prelaznih metala imaju neobično male atomske radijuse zato što 3d-elektroni nisu efektivni u očuvanju povećanog nuklearnog naboja, a manja atomska veličina povezuje se s većom elektronegativnošću.[20] Neuobičajeno visoka elektronegativnost olova, pogotovo pri uporedbi s talijumom i bizmutom, veruje se da je artefakt odabira podataka (i njihove dostupnosti) — metodi računanja koji se razlikuju od Polingovog metoda pokazuju normalne periodične zakone za ove elemente.[39]
Elektronski afinitet[uredi | uredi izvor]

Elektronski afinitet atoma ili afinitet prema elektronu je količina energije koja se otpusti kada se elektron doda na neutralan atom da bi se stvorio negativni jon (anjon). Iako elektronski afinitet uveliko varira, pojavljuju se i određeni uzorci. Generalno govoreći, nemetali imaju pozitivnije vrednosti elektronskog afiniteta nego metali. Hlor najjače privlači dodatni elektron. Elektronski afiniteti plemenitih gasova nisu izmereni s pouzdanim vrednostima, tako da možda imaju a možda i nemaju vrednosti koje zalaze na levu stranu brojevne linije.[42]
Elektronski afinitet se obično povećava idući duž periode. Ovo je uzrokovano popunjavanjem valentnih ljuski atoma; pri primanju elektrona atom 17. grupe otpušta više energije nego atom 1. grupe jer poseduje popunjenu valentnu ljusku i prema tome je stabilniji.[42]
Trend opadanja afiniteta prema elektronu kako se ide niz grupe očekivana je pojava. Dodatni elektron će da popuni orbitalu koja je dalje od jezgra. Tako će taj elektron da se slabije privlači prema jezgru i oslobođena energija pri njegovom dodavanju će da bude manja. Međutim, idući ka dnu grupe, oko jedna trećina elemenata pokazuje anomaliju: teži elementi imaju veće elektronske afinitete od svojih susednih lakših srodnika. Ovo je uveliko zbog slabog pružanja otpora od strane d i f elektrona. Jednoobrazan pad u elektronskom afinitetu jedino se može uočiti kod atoma 1. grupe.[43]
Metalni karakter[uredi | uredi izvor]
Što su vrednosti energije jonizacije, elektronegativnosti i elektronskog afiniteta manje, element ima više metalnog karaktera. Vredi i obratno: nemetaličnost se povećava porastom tri prethodno pomenuta faktora.[44] Uzimajući u obzir periodične zakone koji upravljaju ovim faktorima, metalni karakter se smanjuje idući duž perioda (ili redova) i s nekoliko nepravilnosti — (uglavnom) zbog lošeg skrininga jezgra od strane d i f elektrona te relativističkih efekata[45] — teži povećavanju idući niz grupe (ili kolone/porodice). Prema tome, elementi s najviše metalnih svojstava (kao što su cezijum i francijum) smešteni su u donjem levom uglu tradicionalnih periodnih sistema, dok su elementi s najviše nemetalnih svojstava (kao što su kiseonik, fluor i hlor) smešteni u gornjem desnom uglu. Kombinacija horizontalnih i vertikalnih zakonitosti u metalnom karakteru objašnjava stepenasto oblikovanu graničnu liniju između metala i nemetala koja može da se uoči na nekim periodnim sistemima, kao i neretko kategorisanje nekoliko elemenata koji leže na toj liniji ili elemenata koji su susedni prethodno pomenutima (kao što su metaloidi).[46][47]
Povezujuće ili grupe premosnice[uredi | uredi izvor]
| Periodni sistem sa 32 kolone sa prikazanim, sleva nadesno, lokacijama: 3. grupe, lutecijuma i lorencijuma, 11. i 12. grupe, te plemenitih gasova |
Idući sleva nadesno preko četiri bloka dugog periodnog sistema (ili sistema u formatu sa 32 kolone), nalaze se serije ’povezujućih’ ili ’premošćavajućih’ grupa elemenata, smeštenih otprilike između svakog bloka.[48] Ove grupe, kao i metaloidi, imaju svojstva između ili kao i grupe sa strana. Hemijski gledano, elementi 3. grupe (skandijum, itrijum, lantan i aktinijum) ponašaju se baš kao zemnoalkalni metali[49] ili — uopštenije razmatrajući — kao metali s-bloka[50][51] ali sa nešto fizičkih svojstava prelaznih metala d-bloka.[52] Lutecijum i lorencijum, na kraju f-bloka, mogu da čine drugu vezujuću ili grupu premosnicu. Lutecijum se hemijski ponaša kao lantanoid ali poseduje mešavinu fizičkih svojstava lantanoida i prelaznih metala.[53][54] Lorencijum, kao analogan lutecijumu, po svoj prilici odražava slične karakteristike.[n. 6] Kovni metali u 11. grupi (bakar, srebro i zlato) hemijski su u stanju da se ponašaju ili kao prelazni metali ili kao metali glavne grupe.[57] Isparljivi metali 12. grupe (cink, kadmijum i živa) ponekad se smatraju premosnicom od d-bloka do p-bloka. Nominalno ovo su elementi d-bloka, ali imaju nešto svojstava prelaznih metala i ponašaju se više kao svoji susedi iz p-bloka u 13. grupi.[58][48] Relativno inertni plemeniti gasovi, u 18. grupi, premošćavaju najreaktivnije grupe elemenata u periodnom sistemu — halogene u 17. grupi i alkalne metale u 1. grupi.[48]
Istorija[uredi | uredi izvor]
Prvi pokušaji sistematizacije[uredi | uredi izvor]

Antoan Lavoazje je 1789. godine objavio spisak 33 hemijska elementa, grupišući ih u gasove, metale, nemetale i zemlje (engl. earths).[59] Hemičari ceo sledeći vek provode tragajući za preciznijom klasifikacionom šemom... Johan Volfgang Deberajner je 1829. godine uočio da mnogi elementi mogu da se grupišu u trojstva (engl. triads), i to na osnovu njihovih hemijskih svojstava. Litijum, natrijum i kalijum, na primer, zajedno su grupisani u trojstvo kao meki reaktivni metali. Deberajner je takođe uočio da je — pri raspoređivanju prema atomskoj težini — drugi član svakog trojstva grubo prosek prvog i trećeg;[60] ovo je postalo poznato kao Zakon trojstava (engl. Law of triads).[61] Nemački hemičar Leopold Gmelin radio je koristeći ovaj princip, a do 1843. godine identifikovao je deset trojstava, tri grupe od četiri elementa te jednu grupu od pet elemenata. Žan-Batist Dima objavio je 1857. godine rad u kom je opisao odnose između različitih grupa metala. Iako su mnogi hemičari bili u stanju da identifikuju odnose između malih grupa elemenata, i dalje je bilo neophodno stvoriti jednu šemu koja će da obuhvati sve elemente.[60]
Nemački hemičar August Kekule, posmatrajući ugljenik je shvatio da ovaj element najčešće ima četiri druga atoma vezana za sebe. Metan, primera radi, ima jedan atom ugljenika i četiri atoma vodonika.[62] Ovaj koncept je na kraju postao poznat kao valentnost ili valenc(ij)a; različiti elementi vežu se s različitim brojem atoma.[63]
Aleksandar-Emil Begejer de Šankurtoa, francuski geolog, 1862. godine je objavio jedan od prvih oblika periodnog sistema; nazvao ga je telurni heliks/vijak (franc. hélix/vis tellurique, engl. telluric helix/screw). De Šankurtoa je bio prva osoba koja je uočila periodičnost elemenata. Razmeštajući elemente spiralno na cilindar, rastuće prema atomskoj težini, on je pokazao da se elementi sa sličnim svojstvima uglavnom pojavljuju u pravilnim intervalima. Njegov dijagram je sadržavao i neke jone i jedinjenja pored elemenata. U radu je koristio više geološke nego hemijske termine i u isti nije uključio dijagram; kao rezultat, nije zadobijeno mnogo interesovanja sve dok Dmitrij Mendeljejev nije objavio svoj rad.[64]
Julijus Lotar Mejer, nemački hemičar, 1864. godine je objavio periodni sistem s 44 elementa raspoređena prema valentnosti. U tabeli se videlo da elementi sa sličnim svojstvima najčešće imaju istu valentnost.[65] Vilijam Odling, engleski hemičar, uporedo s Mejerom je objavio svoj sistem s 57 elemenata raspoređenih prema njihovim atomskim težinama. Uz nekoliko nepravilnosti i propusta, on je među elementima uočio nešto nalik na periodičnost atomskih težina te da je ovo usklađeno s „njihovim uglavnom stečenim grupisanjima”.[66] Odling je bio nadomak otkrića periodičnog zakona, ali istraživanje nije uspeo da sprovede do kraja.[67] Naknadno, 1870. godine, predložio je klasifikaciju elemenata na osnovu njihove valentnosti.[68]

Džon Njulands, engleski hemičar, napravio je niz projekata u periodu 1863—1866. godine; otkrio je da pri raspoređivanju elemenata prema rastućoj vrednosti njihovih atomskih težina — slična fizička i hemijska svojstva počinju da se ponavljaju u intervalu broja osam. Ovu periodičnost on je uporedio sa oktavama u muzici.[69][70] Ovaj takonazvani Zakon oktava, međutim, ismejala je velika većina Njulandsovih savremenika i Hemijsko društvo je tako odbilo da objavi njegov rad.[71] Njulands je uprkos ovome uspeo da napravi sistem elemenata i iskoristi ga za predviđanje postojanja elemenata koji su nedostajali, kao što je to slučaj s germanijumom.[72] Hemijsko društvo je odalo priznanje važnosti njegovih otkrića tek pet godina nakon što su zasluge pripale Mendeljejevu.[73]
Gustavus Hinrihs, akademski hemičar danskog porekla koji je živeo u Americi, 1867. godine je objavio spiralni periodni sistem zasnovan na atomskim spektrima i težinama te hemijskim sličnostima. Njegov rad je okarakterisan kao „idiosinkratičan, ostentativan i lavirintan”, što je negativno doprinelo prepoznavanju i prihvatanju istog.[74][75]
Mendeljejevljev sistem[uredi | uredi izvor]

Ruski profesor hemije Dmitrij Mendeljejev i nemački hemičar Julijus Lotar Mejer nezavisno su objavili svoje periodne sisteme 1869. i 1870. godine, redom.[76] Mendeljejevljev sistem je bila njegova prva objavljena verzija; Mejerov je bio proširena verzija njegovog (Mejerovog) sistema iz 1864. godine.[77] Obojica su svoje sisteme konstruisali razmeštajući elemente u redove ili kolone prema atomskoj težini i počinjući novi red ili kolonu kada se karakteristična svojstva elemenata počnu ponavljati (periodičnost).[78]
Najznačajniji srpski hemičar koji je među prvima u svetu prihvatio Mendeljejevljev sistem bio je Sima Lozanić (1847—1935).[79] Prepoznavanje i prihvatanje koje je zadobio Mendeljejevljev sistem u svetu je proizašlo iz dveju odlika koje je on napravio. Prva je bilo ostavljanje prostora u sistemu kada se moglo uvideti da odgovarajući element još uvek nije otkriven.[80] Mendeljejev nije bio prvi hemičar koji je postupio ovako, ali je bio prvi prepoznat po korišćenju zakonitosti u svom periodnom sistemu za predviđanje svojstava onih elemenata koji su bili neotkriveni (kao što je to galijum ili germanijum).[81] Druga odluka je bilo povremeno ignorisanje redosleda koji je proizilazio iz atomskih težina i zamenjivanje mesta nekim susednim elementima (kao što je telur i jod), da bi se isti bolje klasifikovali u hemijske porodice. Engleski fizičar Henri Mozli je nešto kasnije, 1913. godine, odredio eksperimentalne vrednosti nuklearnog naboja odnosno atomski broj pojedinog elementa, te je pokazao da Mendeljejevljev razmeštaj zaista odgovara rastućem raspoređivanju prema atomskim brojevima.[82]
Značaj atomskih brojeva za organizaciju periodnog sistema nije bio toliko primećen sve dok postojanje i svojstva protona i neutrona nisu bila shvaćena. Mendeljejevljev periodni sistem je koristio atomsku težinu umesto atomskog broja za raspoređivanje elemenata, što je bila informacija do koje se moglo doći poprilično tačno u to vreme. Atomska težina je poslužila kako treba u većini slučajeva da bi se (kako je istaknuto) dobila predstava o predviđanju svojstava neotkrivenih elemenata tačnije nego bilo kojim drugim tada poznatim metodom. Zamena atomskih brojeva, kada je postala razumljiva, za elemente je dala definitivni niz zasnovan na celim brojevima. Mozli je 1913. godine (pogrešno) predvideo da su jedini elementi koji nedostaju između aluminijuma (13) i zlata (79) elementi 43, 61, 72 i 75; kako god, ovi elementi su do danas ipak svi otkriveni. Niz atomskih brojeva se koristi i dan-danas kada se novi, sintetički elementi „veštački” prave i potom proučavaju u laboratorijama.[83]
Druga verzija i dalji razvoj[uredi | uredi izvor]


Mendeljejev je 1871. godine objavio svoj periodni sistem u novom obliku, s grupama sličnih elemenata raspoređenim u kolone a ne redove; te kolone bile su označene rimskim brojevima (od I do VIII), što je odgovaralo stanju oksidacije pojedinog elementa. Takođe je izneo detaljna predviđanja što se tiče svojstava elemenata za koje je ranije istakao da su neotkriveni ali da bi trebalo da postoje.[84] Ove praznine su naknadno popunjavane jer su hemičari otkrivali dodatne elemente koji se mogu naći u prirodi.[85] Opšteprihvaćeno je da je poslednji element koji se može naći u prirodi bio francijum (Mendeljejev ga je nazivao eka-cezijum), otkriven 1939. godine.[86] Međutim, plutonijum koji je sintetički proizveden godinu posle, 1971. godine je identifikovan u tragovima kao element koji može da se pronađe u prirodi.[87]
Popularni[25] izgled periodnog sistema, takođe poznat i kao uobičajena ili standardna forma (prikazana u mnogim delovima ovog članka), može da se pripiše Horasu Grouvsu Demingu. Naime, američki hemičar Deming je 1923. godine objavio dva periodna sistema: jedan u kratkom (Mendeljejevljev stil) i jedan u srednjem (18 kolona) obliku.[88][n. 7] Merck and Company izradio je brošurnu formu Demingovog srednjeg sistema sa 18 kolona 1928. godine, a ova verzija koristila se veoma mnogo u američkim školama. Do tridesetih godina 20. veka Demingov sistem se našao u mnogim priručnicima i enciklopedijama iz hemije. Takođe je distribuisan duži period od strane kompanije Sargent-Welch Scientific.[89][90][91]
Razvijanjem modernih teorija kvantne mehanike za elektronske konfiguracije unutar atoma, postalo je očigledno da svaka perioda (red) u periodnom sistemu odgovara popunjenosti kvantne ljuske elektronima. Veći atomi imaju više elektronskih podljuski, tako da su kasnije nastali sistemi zahtevali progresivno duže periode.[92]

Glen Siborg, američki naučnik, 1945. godine je dao predlog da se aktinoidski elementi (kao što su lantanoidi) smatraju podnivoom bloka f. Pre ovoga, aktinoidi su činili četvrti red d-bloka. Siborgove kolege su ga savetovale da ne objavljuje tako radikalan predlog jer bi mu to veoma lako moglo da upropasti karijeru. Pošto je Siborg smatrao da tada i nije imao karijeru koja bi mogla da se uništi, on je odlučio suprotno; predlog se pokazao ispravnim i 1951. godine Siborg za svoj rad na sintetisanju aktinoidskih elemenata osvaja Nobelovu nagradu za hemiju.[93][94][n. 8]
Iako se nekolicina određenih transuranijumskih elemenata nalazi u prirodi,[3] svi ovi elementi su prvo otkriveni u laboratorijama. Njihova proizvodnja proširila je periodni sistem u značajnoj meri, a prvi element koji je dodat kao sintetički bio je neptunijum (1939. godine).[95] Pošto su mnogi transuranijumski elementi veoma nestabilni i raspadaju se dosta brzo, detektovanje odnosno određivanje svojstava istih nakon proizvodnje predstavlja pravi izazov. Postojale su brojne kontroverze što se tiče prihvatanja naziva određenih elemenata koji su se otkrivali u kratkim vremenskim razmacima, a tada je bilo neophodno dati nezavisno mišljenje koje ime ima prioritet te pripisati otkriće pravoj osobi ili timu. Pretposlednji elementi koji su prihvaćeni i imenovani su bili flerovijum (element 114) i livermorijum (element 116), a oba su svoje ime dobila 31. maja 2012. godine.[96] Udruženim snagama rusko-američkih naučnika iz Dubne (Moskovska oblast, Rusija), sintetisano je šest atoma tenesina; ovo je najnovije otkriće hemijskih elemenata koji su se uvrstili u periodni sistem pod imenima koje je odredio i kao poslednje prihvaćene i imenovane elemente 28. novembra 2016. godine zvanično potvrdio/imenovao IUPAC: nihonijum (element 113), moskovijum (element 115), tenesin (element 117) i oganeson (element 118).[97][98]
Elementi 113, 115, 117 i 118 su formalno prepoznati 30. decembra 2015. godine od strane IUPAC-a, čime je kompletiran sedmi red periodnog sistema.[1][99] Zvanična imena i simboli za svaki od ovih elemenata, koji su zameniti privremene oznake kao što su ununpentijum (Uup) u slučaju elementa 115, bili su objavljeni u toku 2016. godine. IUPAC je 8. juna 2016. godine objavio predložena imena za svaki od elemenata. Nihonijum (simbol Nh) bilo je predloženo ime za element 113 jer je otkriven u RIKEN-u u Japanu. Ovo je prvi element koji je dobio ime po lokaciji u istočnoj Aziji. Element 115 je imao predloženo ime moskovijum (simbol Mc) po lokaciji Objedinjenog instituta za nuklearna istraživanja u Moskvi (Rusija). Element 117 imao je predloženo ime tenesin (simbol Ts), što se odnosi na državu Tenesi u SAD koja je dom Nacionalne laboratorije Ouk Ridž. Na kraju, element 118 imao je predloženo ime oganeson (simbol Og), u čast ruskog nuklearnog fizičara Jurija Oganesjana koji je predvodio tim koji je sintetisao ovaj element.[100][101]
Različiti periodni sistemi[uredi | uredi izvor]
Dugi ili sistem sa 32 kolone[uredi | uredi izvor]

Moderni periodni sistem se nekad proširuje u dugi odnosno format s 32 kolone, umećući elemente f-bloka iz fusnote na njihovu ’prirodnu’ poziciju između s i d bloka. Za razliku od formata sa 18 kolona, ovakav razmeštaj rezultuje sprečavanjem „[svakog] prekidanja u nizu rastućih atomskih brojeva”.[102] Odnos između f-bloka i ostalih blokova periodnog sistema takođe postaje jasnije vidljiv.[103]
Džensen zagovara format sistema s 32 kolone, ističući važnost činjenice da lantanoidi i aktinoidi u ostalim slučajevima u glavama učenika ili studenata ispadaju dosadni, nevažni elementi koji se mogu negde odložiti i ignorisati.[104]
Uprkos ovim prednostima, format s 32 kolone uglavnom se izbegava na račun neuobičajenog pravougaonog omjera (pri uporedbi sa omjerom stranice u knjizi i sl.),[105] ali i činjenice da su hemičari naviknuti mnogo više na moderni format (koji je uveo Siborg).[106]
Sistemi s različitim strukturama[uredi | uredi izvor]
U toku stogodišnjeg perioda nakon nastanka Mendeljejevljevog sistema 1869. godine, procenjeno je da je objavljeno oko 700 različitih verzija periodnog sistema.[107] Pored najbrojnijih pravougaonih varijacija, oblikovani su i periodni sistemi u nekim drugim formatima; najznačajniji primeri uključuju[n. 9] kružne, kockaste, cilindrične, kvadarske, spiralne, lemniskatne,[108] osmouganoprizmne, piramidalne, sferične, trougaone i druge verzije. Ovakvi alternativni sistemi se najčešće razvijaju da bi se naznačila ili istakla hemijska ili fizička svojstva elemenata koja se u tradicionalnim periodnim sistemima ne mogu lako uočiti.[107]

Popularni[109] alternativni format je sistem Teodora Benfija (1960). Elementi su razmešteni po neprekinutoj spirali, vodonik je u centru, a prelazni metali, lantanoidi i aktinoidi na ’poluostrvima’.[110]
Velika većina periodnih sistema je dvodimenzionalna;[3] međutim, trodimenzionalni sistemi su poznati još najmanje od 1862. godine (pre nastanka Mendeljejevljevog dvodimenzionalnog sistema 1869. godine). Noviji primeri uključuju Kurtinovu „Periodnu klasifikaciju” (engl. Courtines' "Periodic Classification") iz 1925. godine,[111] Ringlijev „Lamina sistem” (engl. Wringley's "Lamina System") iz 1949. godine,[112] Žigerov „Periodni heliks” (engl. Giguère's "Periodic helix") iz 1965. godine[113] i Duforovo „Periodno stablo” (engl. Dufour's "Periodic Tree") iz 1996. godine.[114] Usudivši se otići korak dalje, Timoti Stou je 1989. godine osmislio „Periodni sistem fizičara” (engl. Stowe's "Physicist's Periodic Table")[115] koji navodno predstavlja četvorodimenzionalni periodni sistem (ima tri prostorne dimenzije i boju kao dimenziju više, mada većina sistema danas izgleda baš ovako).[116]
Različiti oblici periodnog sistema mogu da se smatraju plodom hemijsko-fizičkog kontinuuma.[117] Približavajući se hemijskom kraju kontinuuma, moguće je pronaći — primera radi — Rejner-Kanamov ’neposlušni’[118] „Periodni sistem neorganskog hemičara” (engl. Rayner-Canham's 'unruly' "Inorganic Chemist's Periodic Table") iz 2002. godine,[119] u kom je naglasak na zakonitostima i uzorcima te neobičnim hemijskim odnosima i svojstvima. Blizu fizičkog kraja kontinuuma je Žaneov „Levostepenasti periodni sistem” (engl. Janet's "Left-Step Periodic Table") iz 1928. godine; ovaj sistem ima strukturu koja pokazuje bliskiju vezu s redosledom popunjavanja elektronskih ljuski i time kvantnom mehanikom.[120] Donekle sličan pristup imao je i Alper,[121] s tim da je njegov dizajn iskritikovao Skeri optužujući ga za zanemarivanje potrebe da se prikaže hemijska i fizička periodičnost.[122] Negde u sredini kontinuuma je sveprisutni uobičajeni ili standardni oblik periodnog sistema, u kom je cilj bolje predstaviti empirijske zakonitosti u pogledu fizičkog stanja, električne i toplotne provodljivosti te oksidacione brojeve, kao i druga svojstva lako izvodljiva tradicionalnim tehnikama u hemijskoj laboratoriji.[123] Njegova popularnost je, kako se veruje, rezultat činjenice da ovaj format ima dobar balans odlika u pogledu lakoće izrade i veličine, te predstavljanja atomskog reda i zakonitosti periodičnosti.[124][125]
| f1 | f2 | f3 | f4 | f5 | f6 | f7 | f8 | f9 | f10 | f11 | f12 | f13 | f14 | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | p1 | p2 | p3 | p4 | p5 | p6 | s1 | s2 | |
| 1s | H | He | ||||||||||||||||||||||||||||||
| 2s | Li | Be | ||||||||||||||||||||||||||||||
| 2p 3s | B | C | N | O | F | Ne | Na | Mg | ||||||||||||||||||||||||
| 3p 4s | Al | Si | P | S | Cl | Ar | K | Ca | ||||||||||||||||||||||||
| 3d 4p 5s | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | Rb | Sr | ||||||||||||||
| 4d 5p 6s | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | Cs | Ba | ||||||||||||||
| 4f 5d 6p 7s | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | Fr | Ra |
| 5f 6d 7p 8s | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | 119 | 120 |
| f-blok | d-blok | p-blok | s-blok | |||||||||||||||||||||||||||||
U stvarnosti, popunjavanje elektronskih ljuski karakteriše niz nepravilnosti.
Otvorena pitanja i kontroverze[uredi | uredi izvor]
Pozicija vodonika i helijuma[uredi | uredi izvor]
Jednostavno prateći elektronske konfiguracije, vodonik (1s1) i helijum (1s2) trebalo bi da se nalaze u 1. i 2. grupi, iznad litijuma ([He] 2s1) i berilijuma ([He] 2s2).[25] Međutim, takvo raspoređivanje ova dva elementa se retko koristi van konteksta elektronskih konfiguracija. Kada su plemeniti gasovi (tada pod nazivom „inertni gasovi”) prvi put otkriveni oko 1900. godine, bili su poznati kao „0. grupa” jer nisu odražavali nikakvu hemijsku reaktivnost onih elemenata koji su bili poznati u to vreme, a helijum je bio smešten na vrhu te grupe zato što je delio ogromnu hemijsku inertnost koja se mogla videti i kod drugih elemenata ove grupe. Kako je grupa promenila svoj formalni broj, mnogi autori su nastavili da stavljaju helijum direktno iznad neona, dakle u 18. grupu; jedan od primera takvog raspoređivanja je i trenutni periodni sistem koji koristi IUPAC.[126]
Hemijska svojstva vodonika nisu veoma bliska onima alkalnih metala koji zauzimaju 1. grupu, a na osnovu toga vodonik se ponekad stavlja na neku drugu poziciju: jedna od najčešćih alternativa je 17. grupa;[122] jedan od faktora koji na ovo utiču je striktno univalentna, preovlađujuće nemetalna hemija vodonika, dok je ona fluora (element koji se nalazi na vrhu 17. grupe) striktno univalentna i nemetalna takođe. Katkada, da bi se pokazalo kako vodonik ima osobine koje odgovaraju onima i alkalnih metala i halogena, ovaj element može da se nađe prikazan u dve kolone istovremeno.[127] Drugi predlog je pozicija iznad ugljenika u 14. grupi: raspoređen na ovaj način, vodonik se dobro uklapa u trend rastućih potencijalnih vrednosti jonizacije i vrednosti elektronskog afiniteta te ne odudara mnogo ni od zakonitosti elektronegativnosti (mada vodonik ne može da pokaže tetravalentne karakteristike težih elemenata 14. grupe).[128] U konačnici, vodonik može da se smesti zasebno od svih grupa; ovakav princip zasniva se na činjenici da se opšte osobine vodonika razlikuju od osobina elemenata iz svih grupa: za razliku od vodonika, ostali elementi 1. grupe pokazuju veoma jako izražena metalna svojstva; elementi 17. grupe uglavnom stvaraju soli (odakle i dolazi termin halogen); elementi preostalih grupa pokazuju multivalentniju hemiju. Drugi element 1. periode, helijum, takođe se nekada izdvaja iz svih grupa i stavlja na zasebnu poziciju.[129] Svojstvo koje razlikuje helijum od ostatka plemenitih gasova (iako je neverovatna inertnost helijuma veoma blizu onoj neona i argona)[130] predstavlja činjenica da u svojoj zatvorenoj elektronskoj ljusci helijum ima dva elektrona u spoljašnjoj elektronskoj orbitali, dok ostatak plemenitih gasova u ovoj ljusci ima osam elektrona.
Grupa 3 i njeni elementi u 6. i 7. periodi[uredi | uredi izvor]
Iako su skandijum i itrijum uvek prva dva elementa 3. grupe, identitet sledeća dva elementa nije u potpunosti jedinstveno prihvaćen. Najčešće su to lantan i aktinijum, a ređe lutecijum i lorencijum. Dve varijante vode poreklo iz istorijskih teškoća da se lantanoidi smeste u periodni sistem, te argumenata o tome gde elementi f-bloka počinju a gde završavaju.[106][n. 10][n. 11] Tvrdilo se da su ovakvi argumenti dokaz da je „greška rastavljati [periodni] sistem u oštro razgraničene blokove”.[132] Treća varijanta je prikaz dveju pozicija ispod itrijuma sa oznakom za lantanoide i aktinoide.
Postoje izneseni fizički i hemijski argumenti koji idu više u korist lutecijuma i lorencijuma,[106][133] ali daleko od toga da se svi autori slažu sa ovim odabirom.[134] Većina hemičara koji aktivno rade i nije svesna da postoji ikakva kontroverza.[135] IUPAC je decembra 2015. godine pokrenuo jedan projekat s ciljem iznalaska optimalnog rešenja po pitanju ovog problema, kako bi mogla da se izda i zvanična preporuka.[136]
Lantan i aktinijum[uredi | uredi izvor]
Lantan i aktinijum se najčešće prikazuju kao poslednja dva člana 3. grupe.[137][138][n. 12] Ističe se činjenica da je ovakav odabir napravljen još četrdesetih godina 20. veka te da se izgled periodnih sistema oslanja na elektronske konfiguracije elemenata i pojam diferencijacije elektrona. Konfiguracije cezijuma, barijuma i lantana su (redom) [Xe] 6s1, [Xe] 6s2 i [Xe] 5d1 6s2. Lantan tako ima 5d-diferencirajući elektron i ovo ga smešta u „3. grupu na mesto prvog člana d-bloka za 6. periodu”.[139] Dosledan niz elektronskih konfiguracija tada može da se primeti u 3. grupi i čine ga skandijum ([Ar] 3d1 4s2), itrijum ([Kr] 4d1 5s2) i lantan ([Xe] 5d1 6s2). Kako god, u 6. periodi iterbijum ima elektronsku konfiguraciju [Xe] 4f13 5d1 6s2, a lutecijum [Xe] 4f14 5d1 6s2; rezultat je „dobijanje 4f-diferencirajućeg elektrona za lutecijum i osnovano raspoređivanje istog na mesto poslednjeg člana f-bloka za 6. periodu”.[139] Kasnijim spektroskopskim ispitivanjem otkriveno je da je elektronska konfiguracija iterbijuma zapravo [Xe] 4f14 6s2. Ovo je značilo da i iterbijum i lutecijum (lutecijum koji ima konfiguraciju [Xe] 4f14 5d1 6s2) imaju 14 f-elektrona; rezultat je „dobijanje d-diferencirajućeg a ne f-diferencirajućeg elektrona” za lutecijum, što ga za poziciju u 3. grupi ispod itrijuma čini „jednako validnim kandidatom” kao što je i lantan ([Xe] 5d1 6s2).[139] Kako god, lantan ima prednost da bude na ovom položaju jer se 5d1-elektron pojavljuje prvi put u njegovoj strukturi, dok se tek treći put po redu javlja kod lutecijuma (kratko drugo javljanje je bilo kod gadolinijuma).[140]
Što se tiče hemijskog ponašanja[141] i trendova niz 3. grupu za svojstva kao što su tačka topljenja, elektronegativnost i jonski radijus,[142][143] skandijum, itrijum, lantan i aktinijum su nalik svojim pandanima iz 1—2. grupe. U ovoj varijanti, broj f-elektrona kod najčešćih (trivalentnih) jona elemenata f-bloka dosledno se poklapa s njihovim pozicijama u f-bloku.[144] Na primer, broj f-elektrona za trivalentne jone prvih triju elemenata f-bloka iznosi 1 (Ce), 2 (Pr) i 3 (Nd).[145]
Lutecijum i lorencijum[uredi | uredi izvor]
U ostalim sistemima, lutecijum i lorencijum se prikazuju kao poslednja dva člana 3. grupe.[146][n. 13] Prve tehnike za hemijsko izdvajanje skandijuma, itrijuma i lutecijuma oslanjaju se na činjenicu da su se ovi elementi pojavljivali zajedno u takozvanoj „itrijumovoj grupi”, dok su se lantan i aktinijum pojavljivali zajedno u „cerijumovoj grupi”.[139] Uzimajući ovo u obzir, mnogi hemičari su se dvadesetih i tridesetih godina 20. veka odlučivali za lutecijum naspram lantana kao jedan od elemenata 3. grupe.[n. 14] Nekoliko fizičara se pedesetih i šezdesetih godina 20. veka opredelilo za lutecijum, u svetlu uspoređivanja nekoliko fizičkih svojstava ovog elementa s fizičkim svojstvima koja karakterišu lantan.[139] Takav razmeštaj u kom je lantan prvi član f-bloka osporavalo je nekoliko autora jer lantan nema nijedan f-elektron. Međutim, zagovarala se i ideja da ovo nije validan protivargument jer postoje i druge analogne anomalije periodnog sistema; najbolji primer je torijum, zato što ovaj element nema nijedan f-elektron a opet se nalazi u pomenutom f-bloku.[147] Što se tiče lorencijuma, njegova gasovita atomska elektronska konfiguracija potvrđena je tek 2015. godine i glasi [Rn] 5f14 7s2 7p1. Ovakva konfiguracija predstavlja još jednu anomaliju periodnog sistema, nezavisno od toga da li je lorencijum smešten u f-bloku ili d-bloku, a razlog je postojanje jedne potencijalno primenljive pozicije u p-bloku koja je već bila rezervisana za nihonijum s predviđenom konfiguracijom [Rn] 5f14 6d10 7s2 7p1.[148][n. 15]
Hemijski gledano, skandijum, itrijum i lutecijum (i po svoj prilici lorencijum) ponašaju se kao trivalentne verzije metala 1—2. grupe.[150] S druge strane, trendovi niz grupu za svojstva kao što je tačka topljenja, elektronegativnost i jonski radijus, slični su onima koja se mogu naći kod njihovih pandana iz 4—8. grupe.[139] U ovoj varijanti, broj f-elektrona kod gasovitih oblika atoma f-bloka obično se poklapa s njihovim pozicijama u f-bloku. Na primer, broj f-elektrona za prvih pet elemenata f-bloka iznosi 0 (La), 1 (Ce), 3 (Pr), 4 (Nd) i 5 (Pm).[139]
Lantanoidi i aktinoidi[uredi | uredi izvor]
Nekolicina autora smešta svih trideset lantanoida i aktinoida na dve pozicije ispod itrijuma (obično koristeći fusnotne oznake). U ovoj varijanti naglašavaju se sličnosti u hemiji 15 lantanoidnih elemenata (La—Lu), možda na račun dvosmislenosti oko pitanja koji elementi zauzimaju dve pozicije ispod itrijuma u 3. grupi te 15 kolona širokog f-bloka (iako samo 14 elemenata može da bude u bilo kom od redova f-bloka).[n. 16]
Grupe uključene u prelazne metale[uredi | uredi izvor]
Definicija prelaznog metala koju daje IUPAC je da je to svaki element čiji atom ima nekompletnu d-podljusku ili koji može da se dovede u stanje katjona s nekompletnom d-podljuskom.[151] Prema ovoj definiciji, svi elementi u grupama 3—11 su prelazni metali. IUPAC-ova definicija iz kategorije prelaznih metala isključuje, dakle, elemente 12. grupe, što obuhvata cink, kadmijum i živu.
Neki hemičari koriste kategorije „elemenata d-bloka” i „prelaznih metala” kao sinonime, time direktno uključujući elemente grupa 3—12 među prelazne metale. U ovom slučaju, elementi 12. grupe se tretiraju kao poseban slučaj prelaznih metala kod kojih d-elektroni obično nemaju sposobnost stvaranja hemijske veze. Izveštaj iz 2007. godine o živa(IV)-fluoridu (HgF4), jedinjenju u kojem živa hipotetički koristi svoje d-elektrone za vezivanje, navelo je neke naučnike na izlaganje predloga o tome da i živa može da se tretira kao prelazni metal.[152] Ostali naučnici, kao na primer Džensen,[153] isticali su činjenicu da do formacije jedinjenja kao što je HgF4 može da dođe samo pod visoko abnormalnim uslovima; štaviše, postojanje istog je trenutno osporeno. Prema tome, živa ne može da se smatra prelaznim metalom ni prema jednoj razumnoj interpretaciji uobičajenog značenja ovog termina.[153]
S druge strane, neki hemičari isključuju elemente 3. grupe iz definicije prelaznog metala. To čine na osnovu toga što elementi 3. grupe ne formiraju nijedan jon s naročito zauzetom d-ljuskom i tako ne odražavaju niti jednu od karakteristika hemije prelaznih metala.[154] U ovom slučaju, samo elementi grupa 4—11 ubrajaju se u prelazne metale. Kako god, iako elementi 3. grupe pokazuju malo karakterističnih hemijskih svojstava prelaznih metala — isti pokazuju značajan broj karakterističnih fizičkih svojstava (na račun postojanja u svakom atomu pojedinog d-elektrona).[52]
Elementi s nepoznatim hemijskim osobinama[uredi | uredi izvor]
Iako su svi do oganesona do sada otkriveni, od elemenata posle hasijuma (element 108) samo kopernicijum (element 112), nihonijum (element 113) i flerovijum (element 114) imaju poznate hemijske osobine odnosno svojstva; samo za kopernicijum trenutno postoji dovoljno dokaza za konačnu kategorizaciju. Ostali elementi se možda ponašaju drugačije u odnosu na ono što ekstrapolacija predviđa, i to zbog relativističkih efekata; na primer, za flerovijum se predviđalo da će najverovatnije da se odlikuje nekim svojstvima koja su karakteristična za plemenite gasove, a trenutno se isti nalazi smešten u ugljenikovu grupu.[155] Noviji eksperimenti pokazali su, međutim, da se flerovijum hemijski ponaša poput olova, što se i očekuje gledajući poziciju ovog elementa u periodnom sistemu.[156]
Dodatna proširenja periodnog sistema[uredi | uredi izvor]
| Sistem u 8 redova, do elementa 172[157] |
Nije poznato da li će novootkriveni elementi da prate uzorak trenutnog periodnog sistema kao 8. perioda ili će dodatna prilagođavanja i korekcije da budu neophodne. Siborg je očekivao da će 8. perioda da prati prethodno uspostavljeni uzorak u potpunosti, i to tako što će da postane deo dvoelementnog s-bloka za elemente 119 i 120, novog g-bloka za sledećih 18 elemenata, te 30 dodatnih elemenata koji bi bili nastavak na preostala tri trenutna bloka (f, d i p blok) — završavajući se elementom 168 kao sledećim plemenitim gasom.[158] Nedavno su fizičari poput Peke Pikea iznosili teorije da ovi dodatni elementi možda neće slediti Madelungovo pravilo, koje predviđa kako se elektronske ljuske popunjavaju i time uveliko utiče na izgled trenutnog periodnog sistema. Trenutno postoji nekoliko konkurentnih teorijskih modela za određivanje položaja elemenata sa atomskim brojem manjim od ili jednakim 172.[159]
Element s najvećim mogućim atomskim brojem[uredi | uredi izvor]
Broj mogućih elemenata nije poznat. Veoma rano mišljenje koje je 1911. godine izneo Eliot Adams i koje je zasnovano na razmeštaju elemenata u svakom od horizontalnih redova periodnog sistema bilo je da elementi sa atomskom težinom većom od 256± (što bi danas bilo jednako elementu sa atomskim brojem između 99 i 100) ne mogu da postoje.[160] Nešto skorija procena je da bi periodni sistem mogao da se završi nedugo nakon prelaska ’ostrva stabilnosti’,[161] za što se veruje da će se desiti oko elementa 126, zato što je proširivanje periodnih i nuklidnih sistema ograničeno protonskim i neutronskim linijama kapi (engl. drip lines).[162] Drugi značajni predlozi vezano za kraj periodnog sistema uključuju prekid na elementu 128 koji je predložio Džon Emsli,[3] prekid na elementu 137 koji je predložio Ričard Fajnman[163] te prekid na elementu 155 koji je predložio Albert Kazan.[3][n. 17]
- Borov model
Borov model atoma stavlja određene teškoće pred atome sa atomskim brojevima većim od 137 zato što bi bilo koji element s većim atomskim brojem zahtevao da 1s-elektroni putuju brže od veličine c tj. brzine svetlosti.[164] Prema tome, nerelativistički Borov model pokazuje se netačnim kada se primeni na elemente sa ovim ili većim atomskim brojem.
- Relativistička Dirakova jednačina
Relativistička Dirakova jednačina takođe ispoljava probleme kada se primeni na elemente s više od 137 protona. Za takve elemente, talasna funkcija Dirakovog osnovnog stanja je oscilatorna umesto ograničene, te ne postoji praznine između pozitivnih i negativnih energetskih spektara (kao u Klajnovom paradoksu).[165] Tačniji proračuni, uzimajući u obzir efekte ograničene veličine jezgra, ukazuju na to da energija vezivanja prvo prelazi limit za elemente s više od 173 protona. Za teže elemente, ako unutrašnja orbitala (1s) nije popunjena, električno polje jezgra vuklo bi elektrone iz vakuuma, što bi dalje rezultovalo u spontanoj emisiji pozitrona;[166] međutim, ovo se ne dešava ako se unutrašnja orbitala popuni, tako da element 173 ne mora nužno da predstavlja kraj periodnog sistema.[163]
Optimalni oblik[uredi | uredi izvor]
Nekoliko različitih oblika periodnog sistema navelo je na postavljanje pitanja da li postoji optimalni ili definitivni oblik periodnog sistema. Smatra se da odgovor na ovo pitanje zavisi od toga da li je hemijska periodičnost uočena kao pojava među elementima zapravo stopostotno istinita, efektivno utkana u univerzum, ili je pak ova periodičnost samo proizvod subjektivne ljudske interpretacije, uslovljene okolnostima, verovanjima i sklonostima ljudskih posmatrača. Objektivni fundament hemijske periodičnosti dao bi odgovore i na pitanja pozicije za vodonik i helijum, kao i sastav 3. grupe. Takva temeljna istina, ukoliko postoji, veruje se da još uvek nije otkrivena. Sve dok se ovo otkriće ne dogodi, mnogi različiti oblici periodnog sistema mogu da se smatraju varijacijama shvatanja hemijske periodičnosti, pri čemu će zagovarači svake da istražuju i stavljaju naglasak na različite aspekte, svojstva, perspektive i odnose elemenata.[n. 18]
Moderna verzija[uredi | uredi izvor]
Ispod je dat primer savremenog ažuriranog periodnog sistema, urađenog u SVG formatu. Za razliku od sistema datih u uvodu, ovaj sadrži puno više korisnih informacija ugrađenih u same ćelije (1. energija jonizacije, elektronegativnost, oksidaciona stanja, elektronska konfiguracija itd.).
Vidi još[uredi | uredi izvor]
Napomene[uredi | uredi izvor]
- ^ Elementi koji su otkriveni prvo sintetisanjem a potom pronalaskom u prirodi su tehnecijum (43), prometijum (61), astat (85), neptunijum (93) i plutonijum (94).
- ^ Nulti element (tj. supstancija izgrađena samo od neutrona), uvršten je u nekoliko alternativnih izvedbi; na primer, u Hemijskoj galaksiji (engl. Chemical Galaxy).
- ^ Postoji nedoslednost i neke nepravilnosti u ovoj konvenciji. Tako je helijum prikazan u p-bloku iako je zapravo element s-bloka, a (primera radi) d-podljuska u d-bloku zapravo se popuni do dolaska do 11. umesto 12. grupe.
- ^ Plemeniti gasovi, astat, francijum i svi elementi teži od americijuma izostavljeni su iz prikazanog grafika zavisnosti dveju navedenih veličina jer za iste ne postoje dostupni i upotrebljivi podaci.
- ^ Dok je fluor najelektronegativniji od elemenata po Polingovoj skali, neon je najelektronegativniji element po drugim skalama (kao što je Alenova skala, na primer).
- ^ Dok se za Lr smatra da ima p a ne d elektron u svojoj elektronskoj konfiguraciji osnovnog stanja, pa bi se stoga očekivalo da bude volatilni metal u stanju da formira +1 katjon u jedinjenju, nije bilo moguće doći do dokaza ni za jedno od ovih svojstava uprkos brojnim eksperimentalnim pokušajima da se to uradi.[55] Prvobitno se očekivalo da ima d-elektron u svojoj elektronskoj konfiguraciji[55] što je i dalje moguće za metalni lorencijum, dok se za gasoviti atomski lorencijum smatra da veoma verovatno ima p-elektron.[56]
- ^ Preteča Demingovog sistema sa 18 kolona može da se vidi u Adamsovom periodnom sistemu s 16 kolona iz 1911. godine. Adams je iz glavnog tela svog sistema izostavio retke zemlje i radioaktivne elemente (aktinoide); umesto toga ih je prikazao kao „usečene samo da bi se sačuvao prostor” (engl. careted in only to save space) — retke zemlje između Ba i eka-Yt, radioaktivni elementi između eka-Te i eka-I. Pogledajte:
- Q. A., Elliot (1911). „A modification of the periodic table”. Journal of the American Chemical Society. 33 (5): 684—688 [687].
- ^ Drugi, ekstradugi red periodnog sistema postuliran je čak 1892. godine, kako bi se smestili poznati i neotkriveni elementi sa atomskom težinom većom od one bizmuta (npr. torijum, protaktinijum i uranijum). Većina naučnika je, međutim, smatrala da su ovi elementi analogni varijeteti prelaznih elemenata trećeg niza: hafnijum, tantal i volfram. Postojanje drugog, unutrašnjeg niza prelaznih elemenata (u formi aktinoida) nije prihvaćeno sve dok sličnosti sa elektronskim strukturama lantanoida nisu uspostavljene. Pogledajte:
- Van Spronsen, J. W. (1969). The periodic system of chemical elements. Amsterdam: Elsevier. str. 315—316. ISBN 978-0-444-40776-4.
- ^ Pogledajte Internetsku bazu podataka za periodne sisteme, gde se mogu pronaći razne varijante periodnog sistema što se tiče formata (oblika).
- ^ Za postojanje lantanoida sastav 3. grupe ne bi bio izvor od ikakvog posebnog značaja, pošto skandijum, itrijum, lantan i aktinijum pokazuju istu postepenu promenu u svojstvima kao i kalcijum, stroncijum, barijum i radijum u 2. grupi.[131]
- ^ Odvajanje lantanoida od glavnog tela periodnog sistema se pripisuje češkom hemičaru Bohuslavu Brauneru, koji je 1902. godine sve ove elemente (počev od cerijuma) smestio na jednu poziciju u 4. grupi (ispod cirkona). Ovakav razmeštaj se nazivao „asteroidskom hipotezom” (engl. asteroid hypothesis), prateći analogiju popunjavanja jedne orbite u Solarnom sistemu. Pre ovoga, lantanoidi su najčešće (i neuspešno) postavljani kroza grupe I—VIII starijeg oblika periodnog sistema sa 8 kolona. Iako se razmeštaji koje su pravili Braunerovi prethodnici (slični njegovom sistemu iz 1902. godine) beleže još od 1895. godine, on je poznat po tome što je 1881. godine — u pismu Mendeljejevu — ovakvom principu dao naziv „hemija asteroida” (engl. chemistry of asteroids). Drugi autori su smeštali sve lantanoide ili u 3. grupu, ili u 3. i 4. grupu, ili u 2, 3. i 4. grupu. Nils Bor je 1922. godine nastavio proces odvajanja smeštajući lantanoide između s i d bloka. Glen T. Siborg je 1949. godine ponovo uveo verziju periodnog sistema koji je danas najpoznatiji (lantanoidi i aktinoidi se prikazuju kao fusnote). Siborg je prvo objavio svoj sistem u poverljivom izveštaju iz 1944. godine. Posle toga je ponovo objavio sistem 1945. godine, u Hemijskim i inženjerskim vestima (engl. Chemical and Engineering News), a u godinama do 1949. nekoliko autora je prokomentarisalo ovaj novi sistem i generalno se složilo sa Siborgovim predlozima za izmene. Iste godine on ističe da je najbolji metod za predstavljanje aktinoida smeštanje istih ispod glavnog tela sistema, uzimajući u obzir analogiju s lantanoidima. Pogledajte:
- Thyssen & Binnemans (2011). „Accommodation of the Rare Earths in the Periodic Table: A Historical Analysis”. Handbook on the Physics and Chemistry of the Rare Earths [Gschneider Jr.]. Amsterdam: Elsevier. 41. str. 1—94.
- Seaborg (1994). „Origin of the Actinide Concept”. Handbook on the Physics and Chemistry of the Rare Earths [Gschneider Jr.]. Amsterdam: Elsevier. 18. str. 1—27.
- ^ Za još izvora sa ovom verzijom sistema (Sc-Y-La-Ac), pogledajte:
- Atkins et al. (2006). Shriver & Atkins Inorganic Chemistry. Oxford: Oxford University Press. izd. IV.
- Myers et al. (2004). Holt Chemistry. Orlando: Holt, Rinehart & Winston.
- Chang (2000). Essential Chemistry. Boston: McGraw-Hill. izd. II.
- ^ Za još izvora sa ovom verzijom sistema (Sc-Y-La-Ac), pogledajte:
- Rayner-Canham, G.; Overton, T. (2013). Descriptive Inorganic Chemistry. New York: W. H. Freeman and Company. izd. VI.
- Moore et al. (1978). Chemistry. Tokyo: McGraw-Hill Kogakusha.
- ^ Fenomen različitih grupa izdvajanja je izazvan porastom bazičnosti s porastom radijusa i ne predstavlja fundamentalni razlog koji bi bio dovoljan da se lutecijum (a ne lantan) smesti ispod itrijuma. Prema tome, među 2. grupom zemnoalkalnih metala, magnezijum (manje bazičan) pripada „rastvorljivoj grupi”, dok se kalcijum, stroncijum i barijum (više bazični) pojavljuju kao članovi „amonijum karbonatne grupe”. Bez obzira na ovu činjenicu, magnezijum, kalcijum, stroncijum i barijum oduvek se svrstavaju u 2. grupu periodnog sistema bez pogovora. Pogledajte:
- Moeller (1989). Chemistry with Inorganic Qualitative Analysis. SanDiego: Harcourt Brace Jovanovich. izd. III. str. 955—956, 958.
- ^ Čak i ako metalni lorencijum ima p-elektron, jednostavne studije modelovanja sugerišu da će se ponašati kao lantanoid[149] (kao i ostatak poznatih aktinoida).[145]
- ^ Za još izvora sa ovom verzijom sistema (Sc-Y-Ln-An), pogledajte:
- Housecroft & Sharpe (2008). Inorganic Chemistry. Harlow: Pearson Education. izd. III.
- Halliday (2005). Fundamentals of Physics. Hoboken, NewJersey: John Wiley & Sons. izd. VII.
- Nebergall (1980). General Chemistry. Lexington: D. C. Heath and Company. izd. VI.
- ^ „Karol (2002, str. 63)” kaže da bi gravitacioni efekti postali značajni kada bi atomski brojevi postali astronomski veliki, time prevazilazeći druge fenomene nestabilnosti supermasivnih jezgara, te da neutronske zvezde (sa atomskim brojevima reda 1021) mogu argumentovano da se smatraju najtežim poznatim elementima u univerzumu. Pogledajte:
- Karol (2002). „The Mendeleev–Seaborg periodic table: Through Z = 1138 and beyond”. Journal of Chemical Education. 79 (1): 60—63.
- ^ Skeri, jedan od najistaknutijih ovlašćenih za doslovno ’pisanje istorije’ periodnog sistema,[167] favorizovao je koncept optimalnog oblika periodnog sistema, ali nedavno je promenio svoje mišljenje i sada podržava vrednost pluraliteta periodnih sistema.[168]
Reference[uredi | uredi izvor]
- ^ a b v „Discovery and Assignment of Elements with Atomic Numbers 113, 115, 117 and 118”. IUPAC. 30. 12. 2015. Arhivirano iz originala 7. 2. 2016. g. Pristupljeno 12. 6. 2016.
- ^ „Chemistry: Four elements added to periodic table”. BBC News. 4. 1. 2016. Pristupljeno 19. 4. 2016.
- ^ a b v g d đ Emsley, J. (2011). Nature's Building Blocks: An A–Z Guide to the Elements (New izd.). New York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- ^ Meija, J.; et al. (2016). „Atomic weights of the elements 2013 (IUPAC Technical Report)”. Pure and Applied Chemistry. 88 (3): 265—291. doi:10.1515/pac-2015-0305.
- ^ IUPAC 2016, Tabela 2, 3 kombinovano; nesigurnost uklonjena.
- ^ Greenwood & Earnshaw 1984, str. 24–27
- ^ Gray 2009, str. 6.
- ^ Strickland, Ashley (8. 6. 2016). „New elements on the periodic table are named”. CNN. Arhivirano iz originala 9. 6. 2016. g. Pristupljeno 12. 6. 2016.
- ^ Gonzales, Richard (9. 6. 2016). „Hello, nihonium. Scientists Name 4 New Elements On The Periodic Table”. NPR.org. Arhivirano iz originala 12. 6. 2016. g. Pristupljeno 12. 6. 2016.
- ^ Koppenol, W. H. (2002). „Naming of New Elements (IUPAC Recommendations 2002)” (PDF). Pure and Applied Chemistry. 74 (5): 787—791. S2CID 95859397. doi:10.1351/pac200274050787. Arhivirano iz originala (PDF) 8. 3. 2016. g. Pristupljeno 19. 4. 2016.
- ^ Silva, Robert J. (2006). „Fermium, Mendelevium, Nobelium and Lawrencium”. Ur.: Morss, L. R.; Edelstein, N. M.; Fuger, J. The Chemistry of the Actinide and Transactinide Elements (III izd.). Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 978-1-4020-3555-5.
- ^ Scerri 2007, str. 24.
- ^ Messler 2010, str. 32
- ^ Bagnall 1967, str. 1–12
- ^ Day & Selbin 1969, str. 103
- ^ Holman & Hill 2000, str. 40
- ^ a b Leigh, G. J. (1990). Nomenclature of Inorganic Chemistry: Recommendations 1990. Blackwell Science. ISBN 978-0-632-02494-0.
- ^ Fluck, E. (1988). „New Notations in the Periodic Table” (PDF). Pure Appl. Chem. IUPAC. 60 (3): 431—436. doi:10.1351/pac198860030431. Arhivirano iz originala (PDF) 25. 11. 2013. g. Pristupljeno 19. 4. 2016.
- ^ a b Moore 2003, str. 111
- ^ a b v Greenwood & Earnshaw 1984, str. 30
- ^ „The constitution of group 3 of the periodic table; project № 2015-039-2-200, division № 200” [Sastav 3. grupe periodnog sistema; projekat № 2015-039-2-200, divizija № 200]. IUPAC. 18. 12. 2015. Pristupljeno 28. 6. 2017.
- ^ Stoker 2007, str. 68
- ^ Mascetta 2003, str. 50
- ^ Kotz, Treichel & Townsend 2009, str. 324
- ^ a b v Gray 2009, str. 12
- ^ Jones 2002, str. 2
- ^ Silberberg 2006, str. 536
- ^ Manson & Halford 2006, str. 376
- ^ Bullinger 2009, str. 8
- ^ Jones, B. W. (2010). Pluto: Sentinel of the outer solar system. Cambridge: Cambridge University Press. str. 169—71. ISBN 978-0-521-19436-5.
- ^ Hinrichs, G. D. (1869). „On the classification and the atomic weights of the so-called chemical elements, with particular reference to Stas's determinations”. Proceedings of the American Association for the Advancement of Science. 18 (5): 112—124. Pristupljeno 19. 4. 2016.
- ^ a b Myers, R. (2003). The basics of chemistry. Westport, CT: Greenwood Publishing Group. str. 61—67. ISBN 978-0-313-31664-7.
- ^ a b Chang 2002, str. 289–310, 340–42
- ^ Greenwood & Earnshaw 1984, str. 27
- ^ a b Jolly, W. L. (1991). Modern Inorganic Chemistry (II izd.). McGraw-Hill. str. 22. ISBN 978-0-07-112651-9.
- ^ a b v Greenwood & Earnshaw 1984, str. 28
- ^ IUPAC (1997). „Electronegativity”. Compendium of Chemical Terminology. izd. II [Gold Book]. Onlajn ispravljena verzija (2006—). Pristupljeno 7. 4. 2016.
- ^ Pauling, L. (1932). „The Nature of the Chemical Bond [IV. The Energy of Single Bonds and the Relative Electronegativity of Atoms]”. Journal of the American Chemical Society. 54 (9): 3570—3582. Bibcode:1932JAChS..54.2610C. doi:10.1021/ja01348a011.
- ^ Allred, A. L. (1960). „Electronegativity values from thermochemical data”. Journal of Inorganic and Nuclear Chemistry. Northwestern University. 17 (3/4): 215—221. doi:10.1016/0022-1902(61)80142-5. Arhivirano iz originala 02. 02. 2013. g. Pristupljeno 19. 4. 2016.
- ^ Huheey, Keiter & Keiter 1997, str. 42.
- ^ Siekierski, S.; Burgess, J. (2002). Concise chemistry of the elements. Chichester: Horwood Publishing. str. 35—36. ISBN 978-1-898563-71-6.
- ^ a b Chang 2002, str. 307–309
- ^ Huheey, Keiter & Keiter 1997, str. 42, 880–881
- ^ Yoder, C. H.; Suydam, F. H.; Snavely, F. A. (1975). Chemistry (II izd.). Harcourt Brace Jovanovich. str. 58. ISBN 978-0-15-506465-2.
- ^ Huheey, Keiter & Keiter 1997, str. 880–885
- ^ Sacks, O. (2009). Uncle Tungsten: Memories of a chemical boyhood. New York: Alfred A. Knopf. str. 191, 194. ISBN 978-0-375-70404-8.
- ^ Gray 2009, str. 9.
- ^ a b v MacKay, K. M.; MacKay, R. A.; Henderson, W. (2002). Introduction to Modern Inorganic Chemistry (VI izd.). Cheltenham: Nelson Thornes. str. 194—196, 385. ISBN 978-0-7487-6420-4.
- ^ Remy, H. (1956). Kleinberg, J., ur. Treatise on Inorganic Chemistry. 2. Amsterdam: Elsevier. str. 30.
- ^ Phillips, C. S. G.; Williams, R. J. P. (1966). Inorganic Chemistry. Oxford: Clarendon Press. str. 4—5.
- ^ King, R. B. (1995). Inorganic chemistry of main group elements. New York: Wiley-VCH. str. 289.
- ^ a b Greenwood & Earnshaw 1984, str. 947
- ^ Spedding, F. H.; Beadry, B. J. (1968). „Lutetium”. Ur.: Hampel, C. A. The Encyclopedia of the Chemical Elements. Reinhold Book Corporation. str. 374—378.
- ^ Settouti, N.; Aourag, H. (2014). „A Study of the Physical and Mechanical Properties of Lutetium Compared with Those of Transition Metals: A Data Mining Approach”. JOM. 67 (1): 87—93. Bibcode:2015JOM....67a..87S. doi:10.1007/s11837-014-1247-x.
- ^ a b Silva, Robert J. (2011). „Chapter 13. Fermium, Mendelevium, Nobelium, and Lawrencium”. Ur.: Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements. Netherlands: Springer. ISBN 978-94-007-0210-3. doi:10.1007/978-94-007-0211-0_13.
- ^ Sato, T. K.; Asai, M.; Borschevsky, A.; Stora, T.; Sato, N.; Kaneya, Y.; Tsukada, K.; Düllman, Ch. E.; Eberhardt, K.; Eliav, E.; Ichikawa, S.; Kaldor, U.; Kratz, J. V.; Miyashita, S.; Nagame, Y.; Ooe, K.; Osa, A.; Renisch, D.; Runke, J.; Schädel, M.; Thörle-Pospiech, P.; Toyoshima, A.; Trautmann, N. (9. 4. 2015). „Measurement of the first ionization potential of lawrencium, element 103” (PDF). Nature. 520: 209—211. Bibcode:2015Natur.520..209S. doi:10.1038/nature14342. Pristupljeno 26. 10. 2017.
- ^ Steele, D. The Chemistry of the Metallic Elements. Oxford: Pergamon Press. str. 67.
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements (II izd.). Oxford: Elsevier Science Ltd. str. 1206. ISBN 978-0-7506-3365-9.
- ^ Siegfried, R. (2002). From elements to atoms a history of chemical composition. Philadelphia, Pennsylvania: Library of Congress Cataloging-in-Publication Data. str. 92. ISBN 978-0-87169-924-4.
- ^ a b Ball 2002, str. 100
- ^ Horvitz, L. (2002). Eureka! – Scientific Breakthroughs That Changed The World. New York: John Wiley. str. 43. ISBN 978-0-471-23341-1. OCLC 50766822.
- ^ Kekulé, August (1857). „Über die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radicale”. Annalen der Chemie und Pharmacie. 104 (2): 129—150. doi:10.1002/jlac.18571040202.
- ^ van Spronsen, J. W. (1969). The periodic system of chemical elements. Amsterdam: Elsevier. str. 19. ISBN 978-0-444-40776-4.
- ^ „Alexandre-Emile Bélguier de Chancourtois (1820–1886)”. Annales des Mines history page. Arhivirano iz originala 19. 03. 2016. g. Pristupljeno 19. 4. 2016.
- ^ Venable 1896, str. 85–86, 97
- ^ Odling, W. (2002). „On the proportional numbers of the elements”. Quarterly Journal of Science. 1: 642—648 [643]. „their usually received groupings”
- ^ Scerri 2011
- ^ Kaji, M. (2004). „Discovery of the periodic law: Mendeleev and other researchers on element classification in the 1860s”. Ur.: Rouvray, D. H.; King, R. Bruce. The periodic table: Into the 21st Century. Research Studies Press. str. 91—122 [95]. ISBN 978-0-86380-292-8.
- ^ Newlands, J. A. R. (20. 8. 1864). „On Relations Among the Equivalents”. Chemical News. 10: 94—95. Arhivirano iz originala 4. 3. 2016. g. Pristupljeno 19. 4. 2016.
- ^ Newlands, J. A. R. (18. 8. 1865). „On the Law of Octaves”. Chemical News. 12: 83. Arhivirano iz originala 4. 3. 2016. g. Pristupljeno 19. 4. 2016.
- ^ Bryson, B. (2004). A Short History of Nearly Everything. Black Swan. str. 141—142. ISBN 978-0-552-15174-0.
- ^ Scerri 2007, str. 306.
- ^ Brock, W. H.; Knight, D. M. (1965). „The Atomic Debates: 'Memorable and Interesting Evenings in the Life of the Chemical Society'”. Isis. The University of Chicago Press. 56 (1): 5—25. doi:10.1086/349922.
- ^ Scerri 2007, str. 87, 92.
- ^ Kauffman, G. B. (mart 1969). „American forerunners of the periodic law”. Journal of Chemical Education. 46 (3): 128—135 [132]. Bibcode:1969JChEd..46..128K. doi:10.1021/ed046p128. „idiosyncratic, ostentatious and labyrinthine”
- ^ Mendelejew, D. (1869). „Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente”. Zeitschrift für Chemie: 405—406.
- ^ Venable 1896, str. 96–97, 100–102
- ^ Ball 2002, str. 100–102
- ^ „Periodni sistem elemenata” (PDF). Hemija 024. str. 1. Arhivirano iz originala (PDF) 15. 04. 2016. g. Pristupljeno 19. 4. 2016.
- ^ Pullman, B. (1998). The Atom in the History of Human Thought [Axel Reisinger]. Oxford University Press. str. 227. ISBN 978-0-19-515040-7.
- ^ Ball 2002, str. 105.
- ^ Atkins, P. W. (1995). The Periodic Kingdom. HarperCollins Publishers, Inc. str. 87. ISBN 978-0-465-07265-1.
- ^ Samanta, C.; Chowdhury, P. R.; Basu, D. N. (2007). „Predictions of alpha decay half lives of heavy and superheavy elements”. Nucl. Phys. A. 789: 142—154. Bibcode:2007NuPhA.789..142S. arXiv:nucl-th/0703086
 . doi:10.1016/j.nuclphysa.2007.04.001.
. doi:10.1016/j.nuclphysa.2007.04.001.
- ^ Scerri 2007, str. 112.
- ^ Kaji, M. (2002). „D. I. Mendeleev's Concept of Chemical Elements and the Principle of Chemistry” (PDF). Bull. Hist. Chem. Tokyo Institute of Technology. 27 (1): 4—16. Arhivirano iz originala (PDF) 03. 03. 2016. g. Pristupljeno 19. 4. 2016.
- ^ Adloff, J-P.; Kaufman, G. B. (25. 9. 2005). „Francium (Atomic Number 87), the Last Discovered Natural Element”. The Chemical Educator. Arhivirano iz originala 25. 9. 2013. g. Pristupljeno 26. 3. 2007.
- ^ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. (1971). „Detection of Plutonium-244 in Nature”. Nature. 234 (5325): 132—134. Bibcode:1971Natur.234..132H. doi:10.1038/234132a0. Arhivirano iz originala 3. 3. 2016. g. Pristupljeno 19. 4. 2016.
- ^ Deming, H. G. (1923). General chemistry: An elementary survey. New York: J. Wiley & Sons. str. 160, 165.
- ^ Abraham, M.; Coshow, D.; Fix, W. Periodicity: A source book module, version 1.0 (PDF). New York: Chemsource, Inc. str. 3. Arhivirano iz originala (PDF) 26. 6. 2015. g. Pristupljeno 19. 4. 2016.
- ^ Emsley, J. (7. 3. 1985). „Mendeleyev's dream table”. New Scientist: 32—36 [36].
- ^ Fluck, E. (1988). „New notations in the period table”. Pure & Applied Chemistry. 60 (3): 431—436 [432]. doi:10.1351/pac198860030431.
- ^ Ball 2002, str. 111.
- ^ Scerri 2007, str. 270–271
- ^ Masterton, W. L.; Hurley, C. N.; Neth, E. J. Chemistry: Principles and reactions (VII izd.). Belmont, CA: Brooks/Cole Cengage Learning. str. 173. ISBN 978-1-111-42710-8.
- ^ Ball 2002, str. 123.
- ^ Barber, R. C.; Karol, P. J.; Nakahara, H.; Vardaci, E.; Vogt, E. W. (2011). „Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report)”. Pure Appl. Chem. 83 (7): 1485. doi:10.1351/PAC-REP-10-05-01.
- ^ „Эksperiment po sintezu 117-go эlementa polučaet prodolženie”. JINR. 2012. Arhivirano iz originala 01. 08. 2013. g.
- ^ St. Fleur, Nicholas (1. 12. 2016). „Four New Names Officially Added to the Periodic Table of Elements”. The New York Times. Arhivirano iz originala 14. 8. 2017. g. Pristupljeno 3. 12. 2016.
- ^ „Periodic table's seventh row finally filled as four new elements are added”. The Guardian. 3. 1. 2016. Arhivirano iz originala 2. 4. 2016. g. Pristupljeno 19. 4. 2016.
- ^ Gunther, Matthew (8. 6. 2016). „IUPAC Announces Proposed New Element Names”. Chemistry World. Arhivirano iz originala 9. 6. 2016. g. Pristupljeno 9. 6. 2016.
- ^ „IUPAC is naming the four new elements nihonium, moscovium, tennessine, and oganesson”. IUPAC. 8. 6. 2016. Arhivirano iz originala 9. 6. 2016. g. Pristupljeno 9. 6. 2016.
- ^ Scerri, Eric (2013). „Element 61—Promethium”. A Tale of 7 Elements. New York: Oxford University Press (USA). str. 175—194 (190). ISBN 978-0-19-539131-2. Pristupljeno 27. 8. 2016. „... [no] interruptions in the sequence of increasing atomic numbers...”
- ^ Newell, S. B. (1980). Chemistry: An introduction. Boston: Little, Brown and Company. str. 196. ISBN 978-0-316-60455-0. Pristupljeno 27. 8. 2016.
- ^ Jensen, W. B. (1982). „Classification, Symmetry and the Periodic Table”. Computers & Mathematics with Applications. 12B (1/2): 487—510 [498]. doi:10.1016/0898-1221(86)90167-7.
- ^ Leach, M. R. „Concerning electronegativity as a basic elemental property and why the periodic table is usually represented in its medium form”. Foundations of Chemistry. 15 (1): 13—29. doi:10.1007/s10698-012-9151-3.
- ^ a b v Thyssen, P.; Binnemans, K. (2011). „I Accommodation of the Rare Earths in the Periodic Table: A Historical Analysis”. Ur.: Gschneidner Jr., K. A.; Bünzli, J-C. G.; Vecharsky, B. Handbook on the Physics and Chemistry of Rare Earths. Handbook on the Physics and Chemistry of Rare Earths. 41. Amsterdam: Elsevier. str. 1—94 [76, 80—81]. ISBN 978-0-444-53590-0.
- ^ a b Scerri 2007, str. 20
- ^ „Weird Words of Science: Lemniscate Elemental Landscapes”. fieldofscience.com. Fields of Science. 22. 3. 2009. Arhivirano iz originala 14. 3. 2016. g. Pristupljeno 19. 4. 2016.
- ^ Emsely, J.; Sharp, R. (21. 6. 2010). „The periodic table: Top of the charts”. The Independent. Arhivirano iz originala 5. 3. 2016. g. Pristupljeno 19. 4. 2016.
- ^ Seaborg, G. (1964). „Plutonium: The Ornery Element”. Chemistry. 37 (6): 14.
- ^ Leach, Mark R. „1925 Courtines' Periodic Classification”. Arhivirano iz originala 16. 05. 2016. g. Pristupljeno 19. 4. 2016.
- ^ Leach, Mark R. „1949 Wringley's Lamina System”. Arhivirano iz originala 03. 12. 2011. g. Pristupljeno 19. 4. 2016.
- ^ Mazurs, E. G. (1974). Graphical Representations of the Periodic System During One Hundred Years. Alabama: University of Alabama Press. str. 111. ISBN 978-0-8173-3200-6.
- ^ Leach, Mark R. „1996 Dufour's Periodic Tree”. Arhivirano iz originala 18. 04. 2010. g. Pristupljeno 19. 4. 2016.
- ^ Leach, Mark R. „1989 Physicist's Periodic Table by Timothy Stowe”. Arhivirano iz originala 05. 06. 2012. g. Pristupljeno 16. 10. 2012.
- ^ Bradley, D. (20. 7. 2011). „At last, a definitive periodic table”. ChemViews Magazine. doi:10.1002/chemv.201000107. Arhivirano iz originala 01. 05. 2013. g. Pristupljeno 19. 4. 2016.
- ^ Scerri 2007, str. 285–286
- ^ Scerri 2007, str. 285 »unruly«
- ^ Leach, Mark R. „2002 Inorganic Chemist's Periodic Table”. Arhivirano iz originala 6. 3. 2016. g. Pristupljeno 19. 4. 2016.
- ^ Scerri, E. (2008). „The role of triads in the evolution of the periodic table: Past and present”. Journal of Chemical Education. 85 (4): 585—589 [589]. Bibcode:2008JChEd..85..585S. doi:10.1021/ed085p585.
- ^ Alper, R. (2010). „The simplified periodic table: Elements ordered by their subshells”. The Journal of Biological Physics and Chemistry. 10 (2): 74—80. doi:10.4024/43AL09F.jbpc.10.02.
- ^ a b Scerri, E. (2012). „Some comments on the recently proposed periodic table featuring elements ordered by their subshells”. Journal of Biological Physics and Chemistry. 12 (2): 69—70.
- ^ Bent, H. A.; Weinhold, F. (2007). „Supporting information: News from the periodic table – An introduction to 'Periodicity symbols, tables, and models for higher-order valency and donor–acceptor kinships'”. Journal of Chemical Education. 84 (7): 3—4. doi:10.1021/ed084p1145.
- ^ Scerri 2011.
- ^ Francl, M. (maj 2009). „Table manners” (PDF). Nature Chemistry. 1 (2): 97—98. Bibcode:2009NatCh...1...97F. PMID 21378810. doi:10.1038/nchem.183. Arhivirano iz originala (PDF) 25. 10. 2012. g. Pristupljeno 19. 4. 2016.
- ^ „IUPAC Periodic Table of the Elements” (PDF). iupac.org. IUPAC. 1. 5. 2013. Arhivirano iz originala (PDF) 22. 8. 2015. g. Pristupljeno 19. 4. 2016.
- ^ Seaborg, G. (1945). „The chemical and radioactive properties of the heavy elements”. Chemical English Newspaper. 23 (23): 2190—2193.
- ^ Cronyn, M. W. (avgust 2003). „The Proper Place for Hydrogen in the Periodic Table”. Journal of Chemical Education. 80 (8): 947—951. Bibcode:2003JChEd..80..947C. doi:10.1021/ed080p947.
- ^ Greenwood & Earnshaw 1984.
- ^ Lewars, Errol G. (5. 12. 2008). Modeling Marvels: Computational Anticipation of Novel Molecules. Springer Science & Business Media. str. 69—71. ISBN 978-1-4020-6973-4. Pristupljeno 19. 4. 2016.
- ^ Hevesy, G. (1929). Redkie zemeli s tochki zreniya stroeniya atoma [Rare earths from the point of view of structure of atom] (citirano u: Trifonov (1970). str. 188). Leningrad: NKhTI.
- ^ Stewart, P. J. (2008). „The Flyleaf Table: An Alternative”. Journal of Chemical Education. 85 (11): 1490. Bibcode:2008JChEd..85.1490S. doi:10.1021/ed085p1490. „it is a mistake to break the [periodic] system into sharply delimited blocks”
- ^ Keeler, J.; Wothers, P. (2014). Chemical Structure and Reactivity: An Integrated Approach. Oxford: Oxford University. str. 259. ISBN 978-0-19-960413-5.
- ^ Scerri, E. (2012). „Mendeleev's Periodic Table Is Finally Completed and What To Do about Group 3”. Chemistry International. 34 (4). Arhivirano iz originala 15. 9. 2015. g. Pristupljeno 19. 4. 2016.
- ^ Castelvecchi, D. (8. 4. 2015). „Exotic atom struggles to find its place in the periodic table”. Nature News. Arhivirano iz originala 5. 10. 2015. g. Pristupljeno 19. 4. 2016.
- ^ „The constitution of group 3 of the periodic table”. IUPAC. 2015. Pristupljeno 19. 4. 2016.
- ^ Emsley, J. (2011). Nature's Building Blocks. Oxford: Oxford University. str. 651. ISBN 978-0-19-960563-7.
- ^ Staff. „Periodic Table”. Royal Society of Chemistry. Arhivirano iz originala 10. 4. 2016. g. Pristupljeno 19. 4. 2016.
- ^ a b v g d đ e Jensen, William B. (1982). „The Positions of Lanthanum (Actinium) and Lutetium (Lawrencium) in the Periodic Table”. J. Chem. Educ. 59 (8). Bibcode:1982JChEd..59..634J. doi:10.1021/ed059p634. „... it in group 3 as the first member of the d-block for period 6.« • »... resulting in a 4f differentiating electron for lutetium and firmly establishing it as the last member of the f-block for period 6.« • »... "resulting in a d rather than an f differentiating electron" for lutetium and making it an "equally valid candidate"...”
- ^ Trifonov, D. N. (1970). Rare-earth elements and their position in the periodic system (prevedeno s ruskog). New Delhi: Indian National Scientific Documentation Centre. str. 201—202.
- ^ Greenwood, N. N.; Harrington, T. J. (1973). The chemistry of the transition elements. Oxford: Clarendon Press. str. 50. ISBN 978-0-19-855435-6.
- ^ Aylward, G.; Findlay, T. (2008). SI chemical data (VI izd.). Milton, Queensland: John Wiley & Sons. ISBN 978-0-470-81638-7.
- ^ Wiberg, N. (2001). Inorganic Chemistry. San Diego: Academic Press. str. 119. ISBN 978-0-12-352651-9.
- ^ Wulfsberg, G. (2006). „Periodic table: Trends in the properties of the elements”. Encyclopedia of Inorganic Chemistry. New York: John Wiley & Sons. str. 3. ISBN 978-0-470-86210-0.
- ^ a b Cotton, S. (2007). Lanthanide and Actinide Chemistry. Chichester: John Wiley & Sons. str. 150. ISBN 978-0-470-01006-8.
- ^ Brown, T. L.; LeMay Jr., H. E.; Bursten, B. E.; Murphy, C. J. (2009). Chemistry: The Central Science (XI izd.). Upper Saddle River, New Jersey: Pearson Education. ISBN 978-0-13-235848-4.
- ^ Scerri, E. (2015). „Five ideas in chemical education that must die – part five”. Educationinchemistryblog. Royal Society of Chemistry. Arhivirano iz originala 04. 03. 2016. g. Pristupljeno 19. 4. 2016. „It is high time that the idea of group 3 consisting of Sc, Y, La and Ac is abandoned.”
- ^ Jensen, W. B. (2015). „Some Comments on the Position of Lawrencium in the Periodic Table” (PDF). Arhivirano iz originala (PDF) 23. 12. 2015. g. Pristupljeno 19. 4. 2016.
- ^ Xu, W-H.; Pyykkö, P. (2016). „Is the chemistry of lawrencium peculiar”. Physical Chemistry Chemical Physics. 18 (26): 17351—17355. Bibcode:2016PCCP...1817351X. doi:10.1039/C6CP02706G.
- ^ King, R. B. (1995). Inorganic Chemistry of Main Group Elements. New York: Wiley-VCH. str. 289. ISBN 978-1-56081-679-9.
- ^ IUPAC (1997). „Transition element”. Compendium of Chemical Terminology. izd. II [Gold Book]. Onlajn ispravljena verzija (2006—). Pristupljeno 7. 4. 2016.
- ^ Xuefang, W.; Andrews, L.; Riedel, S.; Kaupp, M. (2007). „Mercury Is a Transition Metal: The First Experimental Evidence for HgF4”. Angew. Chem. Int. Ed. 46 (44): 8371—8375. PMID 17899620. doi:10.1002/anie.200703710.
- ^ a b Jensen, W. B. (2008). „Is Mercury Now a Transition Element”. J. Chem. Educ. 85 (9): 1182—1183. Bibcode:2008JChEd..85.1182J. doi:10.1021/ed085p1182.
- ^ Rayner-Canham, G.; Overton, T (2006). Descriptive inorganic chemistry (IV izd.). New York: W. H. Freeman. str. 484—485. ISBN 978-0-7167-8963-5.
- ^ Schändel, M. (2003). The Chemistry of Superheavy Elements. Dordrecht: Kluwer Academic Publishers. str. 277. ISBN 978-1-4020-1250-1.
- ^ Scerri 2011, str. 142–143
- ^ Fricke, B.; Greiner, W.; Waber, J. T. (1971). „The continuation of the periodic table up to Z = 172 [The chemistry of superheavy elements]”. Theoretica chimica acta. Springer-Verlag. 21 (3): 235—260. doi:10.1007/BF01172015. Arhivirano iz originala 03. 02. 2013. g. Pristupljeno 19. 4. 2016.
- ^ Frazier, K. (1978). „Superheavy Elements”. Science News. 113 (15): 236—238. JSTOR 3963006. doi:10.2307/3963006.
- ^ Pyykkö, P. (2011). „A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions”. Physical Chemistry Chemical Physics. 13 (1): 161—168. Bibcode:2011PCCP...13..161P. PMID 20967377. doi:10.1039/c0cp01575j.
- ^ Elliot, Q. A. (1911). „A modification of the periodic table”. Journal of the American Chemical Society. 33 (5): 684—688 [688]. doi:10.1021/ja02218a004.
- ^ Seaborg, G. (cca 2006). „Transuranium element (chemical element)”. Encyclopædia Britannica. Arhivirano iz originala 2. 4. 2016. g. Pristupljeno 19. 4. 2016.
- ^ Cwiok, S.; Heenen, P-H.; Nazarewicz, W. (2005). „Shape coexistence and triaxiality in the superheavy nuclei”. Nature. 433 (7027): 705—709. Bibcode:2005Natur.433..705C. PMID 15716943. doi:10.1038/nature03336.
- ^ a b Ball, P. (2010). „Column: The crucible | Would Element 137 Really Spell the End of the Periodic Table – Philip Ball Examines the Evidence [Chemistry World]”. Chemistry World. Royal Society of Chemistry. Arhivirano iz originala 1. 10. 2015. g.
- ^ Eisberg, R.; Resnick, R. (1985). Quantum Physics of Atoms, Molecules, Solids, Nuclei and Particles. Wiley.
- ^ Bjorken, J. D.; Drell, S. D. (1964). Relativistic Quantum Mechanics. McGraw-Hill.
- ^ Pogledajte i reference u sledećem izvoru pored samog primarnog izvora:
- Greiner, W.; Schramm, S. (2008). „American Journal of Physics”. 76: 509.
- ^ Sella, Andrea (7. 8. 2013). „An elementary history lesson”. New Scientist (2929 [51]). Arhivirano iz originala 3. 7. 2016. g. Pristupljeno 17. 6. 2017.
- ^ Scerri, Eric (9. 8. 2013). „Is there an optimal periodic table and other bigger questions in the philosophy of science”. ericscerri23.blogspot.com.au. Eric Scerri. Arhivirano iz originala 13. 06. 2017. g. Pristupljeno 17. 6. 2017.
Citirana bibliografija[uredi | uredi izvor]
- Ball, P. (2002). The Ingredients: A Guided Tour of the Elements. Oxford: Oxford University Press. ISBN 978-0-19-284100-1. Pristupljeno 19. 4. 2016.
- Chang, R. (2002). Chemistry (VII izd.). New York: McGraw-Hill Higher Education. ISBN 978-0-19-284100-1. Pristupljeno 19. 4. 2016.
- Gray, T. (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. New York: Black Dog & Leventhal Publishers. ISBN 978-1-57912-814-2. Pristupljeno 19. 4. 2016.
- Greenwood, N. N.; Earnshaw, A. (1984). Chemistry of the Elements. Oxford: Pergamon Press. ISBN 978-0-08-022057-4. Pristupljeno 19. 4. 2016.
- Huheey, J. E.; Keiter, E. A.; Keiter, R. L. (1997). Principles of structure and reactivity (IV izd.). New York: Harper Collins College Publishers. ISBN 978-0-06-042995-9. Pristupljeno 19. 4. 2016.
- Moore, J. (2003). Chemistry For Dummies (I izd.). New York: Wiley Publications. ISBN 978-0-7645-5430-8. Pristupljeno 19. 4. 2016.
- Scerri, E. (2007). The periodic table: Its story and its significance. Oxford: Oxford University Press. ISBN 978-0-19-530573-9. Pristupljeno 19. 4. 2016.
- Scerri, E. (2011). The periodic table: A very short introduction. Oxford: Oxford University Press. ISBN 978-0-19-958249-5. Pristupljeno 19. 4. 2016.
- Venable, F. P. (1896). The Development of the Periodic Law. Easton, Pennsylvania: Chemical Publishing Company. Pristupljeno 19. 4. 2016.
Literatura[uredi | uredi izvor]
- Bullinger, Hans-Jörg (2009). Technology guide: Principles, applications, trends. Berlin: Springer-Verlag. str. 8. ISBN 978-3-540-88545-0.
- Manson, S. S.; Halford, G. R. (2006). Fatigue and durability of structural materials. Materials Park, Ohio: ASM International. str. 376. ISBN 978-0-87170-825-0.
- Silberberg, M. S. (2006). Chemistry: The molecular nature of matter and change (IV izd.). New York: McGraw-Hill. str. 536. ISBN 978-0-07-111658-9.
- Jones, C. (2002). d- and f-block chemistry. New York: J. Wiley & Sons. str. 2. ISBN 978-0-471-22476-1. OCLC 300468713.
- Kotz, J.; Treichel, P.; Townsend, John (2009). Chemistry and Chemical Reactivity, Volume 2 (VII izd.). Belmont: Thomson Brooks [Cole]. str. 324. ISBN 978-0-495-38712-1. OCLC 220756597.
- Mascetta, J. (2003). Chemistry The Easy Way (IV izd.). New York: Hauppauge. str. 50. ISBN 978-0-7641-1978-1. OCLC 52047235.
- Stoker, S. H. (2007). General, organic, and biological chemistry. New York: Houghton Mifflin. str. 68. ISBN 978-0-618-73063-6. OCLC 52445586.
- Leigh, G. J. (1990). Nomenclature of Inorganic Chemistry: Recommendations 1990. Blackwell Science. ISBN 978-0-632-02494-0.
- Holman, J.; Hill, G. C. (2000). Chemistry in context (V izd.). Walton-on-Thames: Nelson Thornes. str. 40. ISBN 978-0-17-448276-5.
- Day, M. C. Jr.; Selbin, J. (1969). Theoretical inorganic chemistry (II izd.). New York: Nostrand-Rienhold Book Corporation. str. 103. ISBN 978-0-7637-7833-0.
- Bagnall, K. W. (1967). „Recent advances in actinide and lanthanide chemistry”. Ur.: Fields, P. R.; Moeller, T. Advances in chemistry, Lanthanide/Actinide chemistry. Advances in Chemistry. 71. American Chemical Society. str. 1—12. ISBN 978-0-8412-0072-2. doi:10.1021/ba-1967-0071.
- Messler, R. W. (2010). The essence of materials for engineers. Sudbury, MA: Jones & Bartlett Publishers. str. 32. ISBN 978-0-7637-7833-0.
- Silva, Robert J. (2006). „Fermium, Mendelevium, Nobelium and Lawrencium”. Ur.: Morss, L. R.; Edelstein, N. M.; Fuger, J. The Chemistry of the Actinide and Transactinide Elements (III izd.). Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 978-1-4020-3555-5.
- Emsley, J. (2011). Nature's Building Blocks: An A–Z Guide to the Elements (New izd.). New York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- Dayah, M. „Dynamic/Interactive Periodic Table”. Ptable. Arhivirano iz originala 16. 3. 2016. g. Pristupljeno 19. 4. 2016.
- Haran, B. „The Periodic Table of Videos”. University of Nottingham. Arhivirano iz originala 4. 3. 2016. g. Pristupljeno 19. 4. 2016.
- Winter, M. „WebElements: The Periodic Table on the Web”. University of Sheffield. Arhivirano iz originala 11. 4. 2016. g. Pristupljeno 19. 4. 2016.
- Leach, M. R. „The Internet Database of Periodic Tables”. Meta-Synthesis. Arhivirano iz originala 24. 03. 2016. g. Pristupljeno 19. 4. 2016.
Spoljašnje veze[uredi | uredi izvor]
- Periodni sistem hemijskih elemenata IUPAC-a na zvaničnom veb-sajtu
- Projekti IUPAC-a na zvaničnom veb-sajtu
- 10 činjenica o periodnom sistemu elemenata Arhivirano na sajtu Wayback Machine (25. april 2016)
- Pesma o periodnom sistemu [AsapSCIENCE]
- 108 hemijskih elemenata animiranih u zanimljive likove [CHEEZburger]
- Spisak reči na engleskom jeziku sastavljenih od simbola hemijskih elemenata periodnog sistema [ScienceNotes]
- PDF verzija periodnog sistema na srpskom jeziku i ćiriličkom pismu
- PDF verzija periodnog sistema na srpskom jeziku i latiničkom pismu






