Polonijum
 | |||||||||||||||||||||||||
| Opšta svojstva | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ime, simbol | polonijum, Po | ||||||||||||||||||||||||
| Alotropi | α, β | ||||||||||||||||||||||||
| Izgled | srebrnast | ||||||||||||||||||||||||
| U periodnom sistemu | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Atomski broj (Z) | 84 | ||||||||||||||||||||||||
| Grupa, perioda | grupa 16 (halkogeni), perioda 6 | ||||||||||||||||||||||||
| Blok | p-blok | ||||||||||||||||||||||||
| Kategorija | postprelazni metal, ali taj status je osporen | ||||||||||||||||||||||||
| Rel. at. masa (Ar) | 208,9824308(20)[1] | ||||||||||||||||||||||||
| Maseni broj | 209 (najstabilniji izotop) | ||||||||||||||||||||||||
| El. konfiguracija | [Xe] 4f14 5d10 6s2 6p4 | ||||||||||||||||||||||||
po ljuskama | 2, 8, 18, 32, 18, 6 | ||||||||||||||||||||||||
| Fizička svojstva | |||||||||||||||||||||||||
| Agregatno stanje | čvrst | ||||||||||||||||||||||||
| Tačka topljenja | 527 K (254 °C, 489 °F) | ||||||||||||||||||||||||
| Tačka ključanja | 1235 K (962 °C, 1764 °F) | ||||||||||||||||||||||||
| Gustina pri s.t. | alfa: 9,196 g/cm3 beta: 9,398 g/cm3 | ||||||||||||||||||||||||
| Toplota fuzije | ca. 13 kJ/mol | ||||||||||||||||||||||||
| Toplota isparavanja | 102,91 kJ/mol | ||||||||||||||||||||||||
| Mol. topl. kapacitet | 26,4 J/(mol·K) | ||||||||||||||||||||||||
Napon pare
| |||||||||||||||||||||||||
| Atomska svojstva | |||||||||||||||||||||||||
| Elektronegativnost | 2,0 | ||||||||||||||||||||||||
| Energije jonizacije | 1: 812,1 kJ/mol | ||||||||||||||||||||||||
| Atomski radijus | 168 pm | ||||||||||||||||||||||||
| Kovalentni radijus | 140±4 pm | ||||||||||||||||||||||||
| Valsov radijus | 197 pm | ||||||||||||||||||||||||
| Ostalo | |||||||||||||||||||||||||
| Kristalna struktura | kubična α-Po | ||||||||||||||||||||||||
| | romboedarska β-Po | ||||||||||||||||||||||||
| Topl. širenje | 23,5 µm/(m·K) (na 25 °C) | ||||||||||||||||||||||||
| Topl. vodljivost | 20 W/(m·K) (?) | ||||||||||||||||||||||||
| Električna otpornost | α: 0.40 µΩ·m (na 0 °C) | ||||||||||||||||||||||||
| Magnetni raspored | nemagnetan | ||||||||||||||||||||||||
| CAS broj | 7440-08-6 | ||||||||||||||||||||||||
| Istorija | |||||||||||||||||||||||||
| Imenovanje | po lat. Polonia, latinski za Poljska, domovina Marije Kiri | ||||||||||||||||||||||||
| Otkriće | Pjer i Marija Kiri (1898) | ||||||||||||||||||||||||
| Prva izolacija | Vili Markvald (1902) | ||||||||||||||||||||||||
| Glavni izotopi | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Polonijum (lat. polonium) jeste hemijski element sa simbolom Po i atomskim brojem 84. Otkrili su ga 1898. godine Marija Kiri i Pjer Kiri. To je redak i veoma radioaktivan element bez stabilnih izotopa. U hemijskom aspektu, polonijum je veoma sličan bizmutu i teluru, a javlja se u sklopu ruda uranijuma. Postoji vrlo mali broj oblasti gde se koristi polonijum. Osim kao sredstvo za generiranje toplote u svemirskim probama, koristi se u antistatičkim uređajima i kao izvor neutrona i alfa-čestica. Zbog svog mesta u periodnom sistemu, gde je uvršten u VIA grupu, polonijum se ponekad smatra metaloidom.[3] Međutim, drugi izvori navode da je on bez sumnje metal, što dokazuju na bazi osobina i delovanja polonijuma.[4]
Istorija[uredi | uredi izvor]
Ranije provizorno nazvan radijum F, polonijum su otkrili Marija i Pjer Kiri 1898. godine,[5] i dali mu ime u čast Marijine domovine Poljske (lat. Polonia).[6][7] Današnja Poljska u to vreme je bila podeljena između Ruskog carstva, Nemačke i Austrougarske pa nije postojala kao nezavisna zemlja. Kirijeva nada kojom se rukovodila pri davanju imena elementa je bila da će to imati odjeka u svetu i skrenuti pažnju na poljsku težnju ka nezavisnošću.[8] Polonijum je bio prvi element koji je dobio ime u svrhu naglašavanja neke političke kontroverze.[8]
Ovaj je element prvi koji su otkrili Kirijevi dok su istraživali radioaktivnost minerala uraninita. Taj mineral, nakon izdvajanja radioaktivnih elemenata uranijuma i torijuma iz njega, bio je još više radioaktivan nego kad je sadržavao ta dva elementa. Ta pojava navela je Kirije u potragu za drugim radioaktivnim elementima sadržanim u uranitu. Iz njega su prvo izdvojili polonijum u julu 1898. a pet meseci kasnije izolovali su radijum.[9][5][10] U Sjedinjenim Američkim Državama, polonijum se proizvodio kao deo potprojekta Dajton u sklopu projekta Menhetn tokom Drugog svetskog rata. On je bio kritični deo nuklearnog oružja implozivnog tipa koje se koristilo u bombi Fat Man bačenoj na Nagasaki 9. augusta 1945. godine. Polonijum i berilijum bili su osnovni sastojci modulisanog neutronskog detonatora tipa jež, koji je postavljan u središte sferno konstruisanog plutonijumskog jezgra bombe. Detonator jež je pokretao lančanu nuklearnu reakciju u trenutku dostizanja kritične mase čime se osiguravalo ispravno detoniranje bombe.[11] Veći deo osnovnih fizičkih i hemijskih osobina polonijuma krio se sve do završetka Drugog svetskog rata. Činjenica da je korišten kao detonator bila je poverljiva informacija u vojsci SAD sve do 1960-ih.[12]
Komisija za atomsku energiju SAD i projekat Menhetn vršili su eksperimente na ljudima, koristeći polonijum dajući ga petero osoba na Univerzitetu u Ročesteru između 1943. i 1947. godine. Tim ljudima su davali između 9 i 22 mikrokirija (330 do 810 kBq) polonijuma proučavajući način njegovog izlučivanja iz ljudskog organizma.[13][14][15]
Osobine[uredi | uredi izvor]
Fizičke[uredi | uredi izvor]
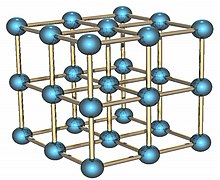
Polonijum je radioaktivni element koji postoji u dve metalne modifikacije. Alfa modifikacija je jedini poznati primer jednostavne kubne kristalne strukture na bazi jednog atoma, čija je ivica dužine 335,2 pikometara; dok je beta modifikacija romboedarske strukture.[16][17][18] Karakteristika strukture polonijuma je difrakcija (prelamanje) x-zraka[19][20] i difrakcija elektrona.[21]
210Po (obično zajedno sa 238Pu) ima mogućnost lakog dospevanja u vazduh: ako se njegov uzorak zagreje u prisustvu vazduha na 55 °C, oko 50% te količine ispari u periodu od 45 sati u obliku dvoatomskih Po2 molekula, iako je tačka topljenja polonijuma 254 °C, a tačka ključanja 962 °C.[22][23][24] Postoji nekoliko pretpostavki za ovu pojavu; a jedna od hipoteza je da se pri alfa-raspadu od uzorka odlome male grupe atoma polonijuma.
Hemijske[uredi | uredi izvor]
Hemijske osobine polonijuma slične su onima telura i bizmuta. Polonijum se lako rastvara u razblaženim kiselinama, ali mu je rastvorljivost u bazama vrlo slaba. Rastvori polonijuma najprije poprimaju ružičastu boju zbog jona Po2+, da bi nedugo zatim vrlo brzo postali žuti zbog alfa-radijacije iz polonijuma koji jonizuje rastvor i pretvara jone Po2+ u Po4+. Ovaj proces je praćen nastankom balončića gasa i emisijom toplote i svetlosti iz staklenog posuđa jer ono apsorbuje alfa-zrake. Kao rezultat, rastvori polonijuma vrlo lako isparavaju i mogu za nekoliko dana potpuno ispariti ako posuda nije čvrsto zatvorena.[9][25]
Izotopi[uredi | uredi izvor]
Polonijum ima 33 poznata izotopa, od kojih su svi radioaktivni. Oni imaju atomske mase u rasponu od 188 do 220 u. Izotop 210Po (vreme poluraspada 138,376 dana) je najviše korišten i dostupan. 209Po (sa vremenom poluraspada od 125,2 ± 3,3 godine) jeste polonijumov izotop sa najdužim vremenom poluraspada od svih njegovih izotopa.[2] Taj izotop zajedno sa izotopom 208Po (vreme poluraspada 2,9 godina) se mogu dobiti putem alfa-, protonskim ili deuterijumskim bombardovanjem olova ili bizmuta u ciklotronu.[26]
Izotop 210Po je emiter alfa-zraka a ima vreme poluraspada od 138,4 dana; raspada se direktno u svoj kćerinski stabilni izotop, 206Pb. Miligram (5 kirija) izotopa 210Po emituje toliki broj alfa čestica u sekundi koliko i 5 grama izotopa 226Ra.[27] Nekoliko kirija (1 kiri jednak je 37 GBq (gigabekerela)) izotopa 210Po isijava plavo zračenje uzrokovano pobuđivanjem okolnog vazduha. Samo jedna od 100.000 alfa-emisija uzrokuje pobuđivanje u jezgru koje može rezultirati emisijom gama zraka sa maksimalnom energijom od 803 KeV.[28][29]
Detekcija[uredi | uredi izvor]

Merenje gama zračenja[uredi | uredi izvor]
Pomoću radiometrijskih metoda kao što je gama spektroskopija (ili koristeći metode hemijske separacije nakon čega se meri aktivnost sa brojačem koji ne rasipa energiju), moguće je merenje koncentracije radioizotopa i razlikovanje jednih od drugih. U praksi, prisutan je pozadinski šum, te u zavisnosti od detektora, širina linije je veća što otežava identifikaciju i merenje izotopa. U biološkim i medicinskim radovima obično se koristi prirodno prisutni 40K u svim telesnim tkivima i tečnostima kao proba podešenosti opreme i kao interni standard.[30][31]
Alfa zraci[uredi | uredi izvor]
Najbolji način za testiranje (i merenje) mnogih alfa emitera je korištenje spektroskopije alfa-čestica. Obično se stavi kapljica ispitivanog rastvora na metalni disk koji se zatim isušuje te se dobija ravnomerno obložen disk. On se zatim koristi kao testni uzorak. Ako je debljina sloja formiranog na disku isuviše velika, onda se pri merenju javljaju preširoke linije spektra. Ovo se dešava jer se deo energije alfa čestica gubi kretanjem kroz sloj aktivnog materijala. Alternativna metoda je korištenje scintilacije interne tečnosti gde je uzorak pomešan sa scintiliranim „koktelom”. Kada se meri emitovano svetlo, neki uređaji će zabeležiti količinu svetlosne energije po svakom događaju radioaktivnog raspada.
Zbog nesavršenosti metode tečne scintilacije (kao što je nemogućnost detekcije svih fotona, teškoće brojanja kod zamućenih ili obojenih uzoraka) i činjenice da nasumično gašenje može smanjiti broj fotona generiranih po jednom radioaktivnom raspadu, nemoguće je postići proširenje alfa spektra dobijenog pomoću tečne scintilacije. Moguće je da će ovi spektri tečne scintilacije biti subjekt Gausovog proširenja umesto distorzije koja se javlja kada je sloj aktivnog materijala na disku previše debeo.[31] Treći metod raspršavanjem energije radi brojanja alfa čestica sastoji se u upotrebi poluprovodničkog detektora.[31]
Zastupljenost[uredi | uredi izvor]
Polonijum se u zemljinoj kori nalazi u tragovima i to samo u rudama urana. Ne može se u većoj količini nagomilati u mineralima zbog kratkog vremena poluraspada. Ravnotežna količina je oko 0,004 mg po jednoj toni. Polonijum ima 33 izotopa čije se atomske mase nalaze između 194—218. Ne poseduje postojane izotope. Najpostojaniji je izotop 209 (vreme polu raspada je 105 godina), ali on se ne javlja u prirodi, nego je dobijen usled veštačke sinteze jedara bizmuta bombardovanih neutronima. Najpostojaniji izotop koji se javlja u prirodi je izotop 210, koji ima vreme poluraspada 138 dana.
Dobijanje[uredi | uredi izvor]
Polonijum se u prirodi javlja kao oksid. Ipak njegova količina u rudama je veoma mala tako da se u industriji isplati dobijanje bombardovanjem bizmuta neutronima. Njegova godišnja produkcija u svetu iznosi svega 20- 30 grama. Značajan izvor ovog elementa je raspadnuti radon iz bolnica gde se ovaj gas upotrebljava za lečenje raka.
Jedinjenja[uredi | uredi izvor]
Poznato je nekoliko jedinjenja polonijuma: hidrid PoH2, oksidi: PoO, Po2O3, PoO2 i PoO3, sulfid (po čemu se razlikuje od selena i telura), hloride PoCl2 i PoCl4 i metaloorganska jedinjenja. Ta jedinjenja nemaju praktičnu upotrebu zbog ogromnih troškova produkcije samog polonijuma.[32]
Reference[uredi | uredi izvor]
- ^ Meija, J.; et al. (2016). „Atomic weights of the elements 2013 (IUPAC Technical Report)”. Pure and Applied Chemistry. 88 (3): 265—291. doi:10.1515/pac-2015-0305.
- ^ a b Boutin, Chad (9. 9. 2014). „Polonium's Most Stable Isotope Gets Revised Half-Life Measurement”. nist.gov. NIST Tech Beat. Pristupljeno 9. 9. 2014.
- ^ „Characterizing the Elements”. Los Alamos National Laboratory. Pristupljeno 4. 3. 2013.
- ^ Hawkes, Stephen J. (2010). „Polonium and Astatine Are Not Semimetals”. Journal of Chemical Education. 87 (8): 783. Bibcode:2010JChEd..87..783H. doi:10.1021/ed100308w.
- ^ a b Curie, P.; Curie, M. (1898). „Sur une substance nouvelle radio-active, contenue dans la pechblende” [On a new radioactive substance contained in pitchblende] (PDF). Comptes rendus (na jeziku: francuski). 127: 175—178.
- ^ Pfützner, M. (1999). „Borders of the Nuclear World – 100 Years After Discovery of Polonium”. Acta Physica Polonica B. 30 (5): 1197. Bibcode:1999AcPPB..30.1197P.
- ^ Adloff J. P. (2003). „The centennial of the 1903 Nobel Prize for physics”. Radichimica Acta. 91 (12–2003): 681—688. S2CID 120150862. doi:10.1524/ract.91.12.681.23428.
- ^ a b Kabzinska, K. (1998). „Chemical and Polish aspects of polonium and radium discovery”. Przemysl Chemiczny. 77 (3): 104—107.
- ^ a b John, Emsley (2001). Nature's Building Blocks. New York: Oxford University Press. str. 330—332. ISBN 978-0-19-850341-5.
- ^ Curie, P.; Curie, M.; Bémont, G. (1898). „Sur une nouvelle substance fortement radio-active contenue dans la pechblende” [On a new, strongly radioactive substance contained in pitchblende] (PDF). Comptes rendus (na jeziku: francuski). 127: 1215—1217. Arhivirano iz originala (PDF) 22. 7. 2013. g. Pristupljeno 16. 6. 2019.
- ^ Nuclear Weapons FAQ, Section 4.1, Version 2.04: 20. februar 1999. Nuclearweaponarchive.org. pristupljeno dana 28.4.2013.
- ^ Restricted data declassification decisions, 1946 to the present (RDD-7), 1. januar 2001, U.S. Department of Energy Office of Declassification, preko fas.org
- ^ American nuclear guinea pigs: three decades of radiation experiments on U.S. citizens Arhivirano na sajtu Wayback Machine (30. jul 2013). United States. Congress. House. of the Committee on Energy and Commerce. Subcommittee on Energy Conservation and Power
- ^ "Studies of polonium metabolism in human subjects", poglavlje 3 u: Biological Studies with Polonium, Radium, and Plutonium, National, Nuclear Energy Series, Volume VI-3, McGraw-Hill, New York, 1950, citirano u: American Nuclear Guinea Pigs ..., 1986 Izvještaj komiteta House Energy and Commerce
- ^ Moss, William i Eckhardt, Roger (1995) "The Human Plutonium Injection Experiments", Los Alamos Science, br. 23.
- ^ Greenwood & Earnshaw 1997, str. 753
- ^ Miessler, Gary L.; Tarr, Donald A. (2004). Inorganic Chemistry (3 izd.). Upper Saddle River, N.J.: Pearson Prentice Hall. str. 285. ISBN 978-0-13-120198-9.
- ^ „The beta Po (A_i) Structure”. Naval Research Laboratory. 20. 11. 2000. Arhivirano iz originala 4. 2. 2001. g. Pristupljeno 5. 5. 2009.
- ^ J., Desando R.; Lange, R. C. (1966). „The structures of polonium and its compounds—I α and β polonium metal”. Journal of Inorganic and Nuclear Chemistry. 28 (9): 1837. doi:10.1016/0022-1902(66)80270-1.
- ^ H., Beamer W.; Maxwell, C. R. (1946). „The Crystal Structure of Polonium”. Journal of Chemical Physics. 14 (9): 569. doi:10.1063/1.1724201. hdl:2027/mdp.39015086430371.
- ^ Rollier, M. A.; Hendricks, S. B.; Maxwell, L. R. (1936). „The Crystal Structure of Polonium by Electron Diffraction”. Journal of Chemical Physics. 4 (10): 648. Bibcode:1936JChPh...4..648R. doi:10.1063/1.1749762.
- ^ Wąs, Bogdan; Misiak et.al., Ryszard (2006). „Thermochromatographic Separation of 206,208Po from a Bismuth Target Bombardet with Protons” (PDF). Nukleonica. 51 (suppl. 2): s3—s5.
- ^ Lide, D. R., ur. (2005). CRC Handbook of Chemistry and Physics (86 izd.). Boca Raton (FL): CRC Press. ISBN 978-0-8493-0486-6.
- ^ Thayer, John S. (2010). „Relativistic Effects and the Chemistry of the Heavier Main Group Elements”. Relativistic Methods for Chemists. Challenges and Advances in Computational Chemistry and Physics. 10. str. 63—97. ISBN 978-1-4020-9974-8. doi:10.1007/978-1-4020-9975-5_2.
- ^ Bagnall 1962, str. 206
- ^ John, Emsley (2011). Nature's Building Blocks: An A-Z Guide to the Elements (novo izd.). New York, NY: Oxford University Press. str. 415. ISBN 978-0-19-960563-7.
- ^ „Polonium” (PDF). Argonne National Laboratory. Arhivirano iz originala (PDF) 3. 7. 2007. g. Pristupljeno 5. 5. 2009.
- ^ Greenwood & Earnshaw 1997, str. 250
- ^ „210PO α decay”. Nuclear Data Center, Korea Atomic Energy Research Institute. 2000. Pristupljeno 5. 5. 2009.
- ^ Gilmore G, Hemingway J (1995). Practical Gamma-Ray Spectrometry. Chichester: John Wiley & Sons. ISBN 978-0-471-95150-6.
- ^ a b v Knoll, G. (2000). Radiation Detection and Measurement. New York: John Wiley & Sons, Inc. ISBN 978-0-471-07338-3.
- ^ Parkes, G.D. & Phil, D. (1973). Melorova moderna neorganska hemija. Beograd: Naučna knjiga.
Literatura[uredi | uredi izvor]
- Miessler, Gary L.; Tarr, Donald A. (2004). Inorganic Chemistry (3 izd.). Upper Saddle River, N.J.: Pearson Prentice Hall. str. 285. ISBN 978-0-13-120198-9.
- John, Emsley (2001). Nature's Building Blocks. New York: Oxford University Press. str. 330—332. ISBN 978-0-19-850341-5.
- Gilmore G, Hemingway J (1995). Practical Gamma-Ray Spectrometry. Chichester: John Wiley & Sons. ISBN 978-0-471-95150-6.
- Parkes, G.D. & Phil, D. 1973. Melorova moderna neorganska hemija. Naučna knjiga. Beograd.
- Bagnall, K. W. (1962). „The Chemistry of Polonium”. Advances in Inorganic Chemistry and Radiochemistry. 4. New York: Academic Press. str. 197—226. ISBN 978-0-12-023604-6. doi:10.1016/S0065-2792(08)60268-X. Pristupljeno 14. 6. 2012.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd izd.). Butterworth–Heinemann. ISBN 978-0080379418.
Spoljašnje veze[uredi | uredi izvor]
- Polonium at The Periodic Table of Videos (University of Nottingham)



