Rodijum
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Opšta svojstva | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ime, simbol | rodijum, Rh | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izgled | srebrnasto beo metaličan | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| U periodnom sistemu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomski broj (Z) | 45 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa, perioda | grupa 9, perioda 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | d-blok | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kategorija | prelazni metal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rel. at. masa (Ar) | 102,90550(2)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El. konfiguracija | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
po ljuskama | 2, 8, 18, 16, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizička svojstva | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka topljenja | 2237 K (1964 °C, 3567 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka ključanja | 3968 K (3695 °C, 6683 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gustina pri s.t. | 12,41 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| tečno st., na t.t. | 10,7 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota fuzije | 26,59 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota isparavanja | 493 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mol. topl. kapacitet | 24,98 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Napon pare
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomska svojstva | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativnost | 2,28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energije jonizacije | 1: 719,7 kJ/mol 2: 1740 kJ/mol 3: 2997 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomski radijus | 134 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentni radijus | 142±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ostalo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristalna struktura | postraničnocentr. kubična (FCC) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brzina zvuka tanak štap | 4700 m/s (na 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Topl. širenje | 8,2 µm/(m·K) (na 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Topl. vodljivost | 150 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Električna otpornost | 43,3 nΩ·m (na 0 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetni raspored | paramagnetičan[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetna susceptibilnost (χmol) | +111,0·10−6 cm3/mol (298 K)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jangov modul | 380 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modul smicanja | 150 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modul stišljivosti | 275 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poasonov koeficijent | 0,26 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mosova tvrdoća | 6,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vikersova tvrdoća | 1100–8000 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinelova tvrdoća | 980–1350 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS broj | 7440-16-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Istorija | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Otkriće i prva izolacija | Vilijam Hajd Volaston (1804) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Glavni izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Rodijum (Rh, grč. rhodium) metal je VIIIB grupe sa atomskim brojem 45. Ima 34 izotopa čije se atomske mase nalaze izmađu 94—112. Postojan je samo izotop 103 koji predstavlja 100% prirodnog sastava izotopa rodijuma.[4] Rodijum je dobio ime po grčkoj reči rhodon što znači ruža. Otkriven je 1803. godine od strane V.H. Volastona u Londonu. U zemljinoj kori je zastupljen u veoma maloj količini od 10−4 ppm (engl. parts per million). Dobija se iz nekih ruda bakra i nikla u kojima se nalazi oko 0,1% rodijuma.[5]
U čistom obliku je sjajan, srebrnosiv metal. Ne reaguje sa vodom, vazduhom i kiselinama, ali reaguje sa jakim bazama. U čistom obliku se ne koristi zbog njegove veoma visoke cene. Cena rodijuma je oko 6100 američkih dolara za 1 finu uncu.[6]
Istorija[uredi | uredi izvor]
Rodijum je otkrio Vilijam Hajd Volaston 1803. u uzorku rude sirove platine iz Južne Amerike. U istoj rudi, Volaston i Smitson Tenant otkrili su još tri druga platinska metala: paladijum, osmijum i iridijum. Prvo su rudu rastvorili u „carskoj vodi” (aqua regia). Razdvojio se rastvorljivi deo i crni nerastvorljivi ostatak, u kojem je Tenant pronašao osmijum i iridijum. Volaston je uspeo iz rastvora carske vode da istaloži rodijum te neke druge sastojke sa cinkom u prahu.
Nakon odvajanja bakra i olova razblaženom azotnom kiselinom te ponovnim rastvaranjem u carskoj vodi i dodavanju natrijum hlorida nastao je Na3[RhCl6] · n H2O, da bi nakon isparavanja tečnosti preostala ružičasto-crvena so. Iz nje je Volaston ekstrakcijom sa etanolom i redukcijom sa cinkom uspeo da dobije elementarni rodijum. Izabrao je ime po starogrčkoj reči ῥόδεος rhodeos („ružičasto-crven”), pošto mnoga jedinjenja rodijuma pokazuju upravo tu boju.[7]
Od 1820. među prvim načinima upotrebe novih metala bila je izrada vrhova naliv-pera, za šta se upotrebljavala legura rodijuma i kalaja. Međutim, ona je kasnije zamenjena tvrđim legurama osmijuma i iridijuma.[7]
Osobine[uredi | uredi izvor]

Fizičke[uredi | uredi izvor]
Rodijum je srebreno-svetli, teško topivi, tvrdi plemeniti metal. Rodijum je dosta tvrđi od zlata ili platine, ali i pored toga se lako izvlači u žice i može se kovati. Po mnogim osobinama može se uporediti sa drugim platinskim elementima. Tako na primer tačka topljenja rodijuma iznosi 1966 °C što je između one kod platine (1772 °C) i rutenijuma (2334 °C). Gustina elementa od 12,41 g/cm3 takođe se može porediti sa „susednim” elementima iz periodnog sistema rutenijumom i paladijumom. Rodijum ima najvišu provodljivost toplote i električne struje od svih platinskih metala. Na temperaturi ispod 0,9 K rodijum postaje superprovodnik.[8]
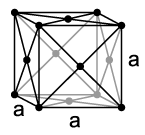
Rodijum se kristalizuje poput kobalta i iridijuma u kuglastom kubičnom kristalnom sistemu (tip bakra) sa prostornom grupom Fm3m (br. 225) i sa parametrom rešetke a = 380,4 pm kao i četiri formulske jedinice po elementarnoj ćeliji.[9]
Hemijske[uredi | uredi izvor]
Kao tipični plemeniti metal, rodijum je veoma hemijski inertan. Nakon iridijuma je najmanje reaktivni platinski metal. On reaguje sa kiseonikom i hlorom tek pri temperaturi od 600 do 700 °C gradeći rodijum(III) oksid odnosno rodijum(III) hlorid. Takođe sa najreaktivnijim halogenom fluorom reaguje tek pri visokoj temperaturi dajući rodijum(VI) fluorid. Mineralne kiseline ne napadaju ovaj metal. Jedini izuzetak čini fino isitnjeni rodijum, koji se vrlo sporo rastvara u carskoj vodi i koncentrovanoj sumpornoj kiselini.
Metal reaguje sa nekim istopljenim solima te se na taj način može odvojiti iz smese. Soli, sa kojima je to moguće, su natrijum hidrogensulfat, kalijum disulfat, cijanid i natrijum karbonat. Kiseonik se rastvara u tečnom rodijumu. Pri njegovom hlađenju i očvršćivanju, kiseonik se iz njega ponovno oslobađa.
Izotopi[uredi | uredi izvor]
Poznata su ukupno 33 izotopa kao i 20 nuklearnih izomera rodijuma.[10] Prirodni rodijum se u potpunosti sastoji iz jednog izotopa 103Rh te stoga spada među 22 poznata jednoizotopna elementa. Veštački izotopi sa najdužim vremenom poluraspada su 101Rh koji se raspada na 101Ru za 3,3 godine (t1/2) putem elektronskog zahvata. Neznatnim delom njegov raspad ide preko metastabilnog jezgra izomernim prelazom u 102Rh.[10] Kratkoživeće jezgro izotopa 105Rh sa vremenom poluraspada od 35,88 sati našlo je primenu u medicini kao trejser.
Rasprostranjenost[uredi | uredi izvor]
Rodijum je, zajedno sa rutenijumom i iridijumom, a posle renijuma, jedan od najređih neradioaktivnih metala u kontinentalnom delu Zemljine kore. Njegov udeo na Zemlji iznosi približno 1 ppb (jedan gram na 1.000 tona).[11] U prirodi, rodijum se može javljati i u samorodnom obliku, pa je zbog toga priznat i kao mineral. Među najvažnije tipske lokalitete rodijuma ubraju se okrug Stilvoter u Montani te zaliv Gudnjuz na Aljaski. Na tim lokalitetima, rodijum prati, između ostalih, druge platinske metale i zlato.[12]
Pored elementarnog rodijuma, poznati su i neki njegovi minerali kao što su bovijet, genkinit ili mijasit. Međutim, i oni su kao i elementarni rodijum veoma retki te za njegovo dobijanje ne igraju važniju ulogu. Najvažnija nalazišta elementa nalaze se u sulfidnim nikl-bakarnim rudama, kojih najviše ima u Južnoafričkoj Republici, Kanadi (Sadberi) i Sibiru. U depozitima zlata u Meksiku takođe se javlja rodijum u značajnijim količinama. Pri preradi ovih ruda, rodijum se taloži zajedno sa drugim platinskim metalima te se na kraju obrade mora izdvojiti iz njih.
Dobijanje[uredi | uredi izvor]

Dobijanje metalnog rodijuma je kao i dobijanje drugih platinskih metala veoma zahtevno. To se odnosi prvenstveno na sličnost s njima i slabu reaktivnost te grupe elemenata, zbog čega se oni izuzetno teško odvajaju jedan od drugih. Polazna sirovina za dobijanje rodijuma je anodni mulj koji se taloži kao sporedni proizvodi pri elektrolizi u proizvodnji bakra i nikla. Najpre se mulj rastvara u carskoj vodi. Prvo se rastvara zlato, platina i paladijum, dok rutenijum, osmijum, rodijum i iridijum kao i srebro u vidu srebro hlorida preostaje nerastvoreno. Srebro hlorid se zagrejavanjem sa olovo karbonatom i nitratnom kiselinom prevodi u rastvorljivi srebro nitrat i tako uklanja.
Da bi se rodijum odvojio od drugih elemenata, nerastvorljivi ostatak se topi zajedno sa natrijum bisulfatom. Nastaje rodijum sulfat (Rh2(SO4)3) koji je rastvorljiv u vodi, koji se može istaložiti s vodom. Rastvoreni rodijum se najpre taloži sa natrijum hidroksidom u vidu rodijum-hidroksida Rh(OH)3. Sledeće faze procesa proizvodnje su rastvaranje u hlorovodičnoj kiselini čime nastaje H3[RhCl6] te taloženje sa natrijum nitritom i amonijum hloridom u obliku (NH4)3[Rh(NO2)6]. Da bi se došlo do elementarnog rodijuma, to jedinjenje se macerira hlorovodoničnom kiselinom čime nastaje rastvorljivi kompleks (NH4)3[RhCl6]. Nakon što se isparavanjem ukloni voda, pomoću vodonika se može redukovati do praškastog rodijuma.
-
- Reakcija amonijum-heksahlororodata sa vodonikom daje rodijum
Izotopi rodijuma nastaju kao sporedni proizvodi pri cepanju jezgra uranijuma 235U te se mogu ekstrahovati iz potrošenih gorivih elemenata. Zbog radioaktivnosti do danas ne postoji niti jedna komercijalna upotreba tako dobijenog rodijuma.[8]
Rodijum se proizvodi u vrlo ograničenom obimu, tako da je svetska proizvodnja u 2005. iznosila samo 23,5 tone. Od ukupne proizvodnje oko 83,2% se odnosi na Južnoafričku Republiku. Drugi najveći proizvođač je bila Rusija (11,9%) nakon koje slede Kanada i Zimbabve.
Upotreba[uredi | uredi izvor]

Kao i drugi platinski metali, rodijum u mnogim procesima deluje katalitički. Ne samo da metalni rodijum deluje tako, nego i njegova jedinjenja i legure sa drugim platinskim metalima, te se stoga u te svrhe i oni koriste. Osim katalitičkih, postoje i mogućnosti upotrebe rodijuma u druge svrhe, ali su načini upotrebe vrlo ograničeni zbog njegove visoke cene.
Najvažnija oblast u kojoj se koristi rodijum su katalizatori u vozilima. On u njima služi da omogući i ubrza redukciju azot-monoksida do elementarnog azota. Ako se umesto rodijuma koristi platina ili paladijum, dolazi do prekomernog nastanka amonijaka i diazot-monoksida.[13] Deo rodijuma se koristi za katalizatore u industriji azotne kiseline. U takozvanom Ostvaldovom procesu za katalitičko sagorevanje amonijaka do azot-monoksida upotrebljavaju se mrežice, koje se sastoje od legure platine sa rodijumom gde je njegov udeo 10%. Korištenjem rodijuma povećava se postojanost i prinos reakcije u odnosu na korištenje čiste platine.[14] Takođe i u Andrusovom procesu za proizvodnju cijanovodične kiseline kao katalizatori se koriste legure platine i rodijuma.[8]
Reference[uredi | uredi izvor]
- ^ Meija, J.; et al. (2016). „Atomic weights of the elements 2013 (IUPAC Technical Report)”. Pure and Applied Chemistry. 88 (3): 265—291. doi:10.1515/pac-2015-0305.
- ^ Lide, D. R., ur. (2005). „Magnetic susceptibility of the elements and inorganic compounds”. CRC Handbook of Chemistry and Physics (PDF) (86th izd.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5. Arhivirano iz originala 03. 03. 2011. g. Pristupljeno 15. 01. 2021.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. str. E110. ISBN 0-8493-0464-4.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. izd.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Parkes, G.D. & Phil, D. (1973). Melorova moderna neorganska hemija. Beograd: Naučna knjiga.
- ^ „Price History Charts”. Arhivirano iz originala 15. 09. 2010. g. Pristupljeno 20. 06. 2010.
- ^ a b W. P. Griffith (2003). „Bicentenary of Four Platinum Group Metals, Part I Rhodium und Palladium”. Platinum Metals Review. 47 (4): 175—183.
- ^ a b v Hermann Renner; et al. (2001). „Platinum Group Metals and Compounds”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 9783527303854. doi:10.1002/14356007.a21_075.
- ^ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. u: Acta Crystallographica, 1974, B30, str. 193–204.
- ^ a b G. Audi; O. Bersillon; J. Blachot; A. H. Wapstra (2003). „The NUBASE evaluation of nuclear and decay properties” (PDF). Nuclear Physics. A 729 (1): 3—128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001. Arhivirano iz originala 15. 12. 2013. g. Pristupljeno 15. 01. 2021.
- ^ David R. Lide (2003). „Properties of the Elements and Inorganic Compounds”. CRC Handbook of Chemistry and Physics (84 izd.). Boca Raton, Florida: CRC Press.
- ^ Anthony; et al. (1990). „Rhodium”. Handbook of Mineralogy (PDF) (1 izd.). str. 101.
- ^ Votsmeier, Martin; Kreuzer, Thomas; Lepperhoff, Gerhard (2003). „Automobile Exhaust Control”. Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. ISBN 3527306730. doi:10.1002/14356007.a03_189.
- ^ A. F. Holleman; E. Wiberg; N. Wiberg (2007). Lehrbuch der Anorganischen Chemie (102 izd.). Berlin: de Gruyter. str. 1697. ISBN 978-3-11-017770-1.
Spoljašnje veze[uredi | uredi izvor]
- Rhodium at The Periodic Table of Videos (University of Nottingham)
- Rhodium Technical and Safety Data Архивирано на сајту Wayback Machine (11. октобар 2007)
- CDC - NIOSH Pocket Guide to Chemical Hazards



![{\displaystyle \mathrm {2\ {(NH_{4})}_{3}{[RhCl_{6}]+3\ H_{2}}\longrightarrow } }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c6e9d6fecceb9096043e2cfc8462d519c2a33609)
