Stereoizomerija
Stereoizomeri su jedinjenja iste konstitucije a različitih konfiguracija. Pojednostavljeno, ovo su jedinjenja koja imaju identične supstituente ali je prostorni raspored tih supstituenata različit.
Enantiomerija[uredi | uredi izvor]

Enantiomeri su stereoizomeri koji se odnose kao predmet i lik u ogledalu. Svaki stereocentar jednog enantiomera ima suprotnu konfiguraciju na odgovarajućem hiralnom atomu drugog enantiomera. Enantiomeri imaju identične fizičke osobine osim u jednom aspektu: jedan enantiomer okreće ravan polarizovane svetlosti ulevo, drugi udesno. Po pitanju hemijskih osobina, postoji značajna razlika u reaktivnosti enantiomera sa drugim optički aktivnim jedinjenjima. Enantiomere je stoga moguće razlikovati ili propuštanjem polarizovane svetlosti kroz njihov standardizovan rastvor i merenjem ugla za koji ravan svetlosti skreće, ili u reakciji sa nekim hiralnim reagensom. U prirodi, važi pravilo da je najčešće jedan enantiomer zastupljen u značajno većoj meri od drugog, kao što je to slučaj kod aminokiselina, što za posledicu ima i veoma različitu biološku aktivnost enantiomera.
Dijastereoizomerija[uredi | uredi izvor]
Dijastereoizomeri su stereoizomeri koji se ne odnose kao predmet i lik u ogledalu, odnosno to su svi stereoizomeri koji nisu enantiomeri. Geometrijska izomerija kod nekih klasa jedinjenja potpada pod dijastereoizomeriju, ali se u najužem smislu odnosi na optički aktivne ne-enantiomerne oblike jedinjenja. U dole datom primeru, vinska kiselina ima 2 hiralna ugljenikova atoma, što znači da bi po pravilu trebalo da ima 4 stereoizomera. Od toga se dva, L-(+)-vinska kiselina i D-(-)-vinska kiselina odnose kao enantiomeri, dok druga dva oblika zapravo predstavljaju identično jedinjenje - mezo-vinsku kiselinu. Zbog prisustva ravni simetrije u ovom obliku, mezo-vinska kiselina ne pokazuje optičku aktivnost, ali se sa dva enantiomerna oblika odnosi kao prema dijastereoizomerima. Dijastereoizomeri se gotovo uvek razlikuju po fizičkim i hemijskim osobinama.

Geomatrijska izomerija[uredi | uredi izvor]
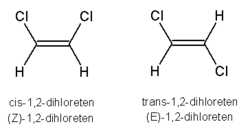

Stereoizomerija kod jedinjenja sa dvostrukom vezom javlja se usled relativne nemogućnosti rotacije oko dvostruke veze što znači da se supstituenti nalaze u stalnom položaju jedan u odnosu na drugi. O prostornim odlikama ovakvih molekula ne može se govoriti ukoliko sa bilo koje strane dvostruke veze (gledano u odnosu na ravan normalnu na vezu) postoje isti supstituenti. Tradicionalni način opisivanja stereohemije jedinjenja sa dvostrukom vezom obuhvata upotrebu cis-trans opisa, preuzetih od opisivanja položaja suspstituenata u cikličnim jedinjenjima kao iznad ili ispod ravni prstena. Cis-trans nomenklatura se može koristiti samo kada su posmatrani supstituenti isti ili slični. Nešto dosledniji sistem propisan od IUPAC-a, koji se može koristiti i kada posmatrani supstituenti nisu identični, ali je moguće ustanoviti njihov redosled prioriteta, obuhvata dodeljivanje prioriteta svakom od supstituenata, nakon čega se konfiguracija označava kao E (nem. entgegen - suprotno) ukoliko su supstituenti viših prioriteta na suprotnim stranama dvostruke veze, ili Z (nem. zusammen - zajedno) ako su supstituenti sa višim prioritetom sa iste strane dvostruke veze. Vrlo često je Z konfiguracija ujedno i cis a E - trans, ali kako što se vidi u datim primerima, ovo nije pravilo.
Konformacije[uredi | uredi izvor]
Konformacije predstavljaju različite prostorne oblike nekog jedinjenja koji nastaju rotacijom oko jedne ili više jednostrukih veza. Različite konformacije imaju različite sadržaje energije što zavisi od niza faktora i interakcija u samom molekulu. U zavisnosti od broja jednostrukih veza i prirode samog molekula, on se može naći u većem broju konformacija, međutim, praktično je nemoguće izolovati pojedinačni oblik, odnosno odvojiti ga od ostalih. Takav primer je cikloheksan, koji se javlja u konformaciji „stolice“ i „lađe“, ali je ove dve nemoguće razdvojiti jednu od druge. Kod nekih jedinjenja kao što su 2,2,2,2-tetrasupstutuisani bifenili, ovo je, pak, moguće zbog velikih energetskih barijera između dve konformacije. Ova pojava se naziva atropizomerija i može se smatrati jednim vidom enantiomerije, mada je neki autori izdvajaju zasebno.
Literatura[uredi | uredi izvor]
- Ernest L. Eliel; Samuel H. Wilen (1994). Stereochemistry of Organic Compounds (1 izd.). Wiley, John & Sons, Incorporated. ISBN 978-0-471-01670-0.
- Ernest L. Eliel; Samuel H. Wilen; Michael P. Doyle (2001). Basic Organic Stereochemistry (1. izd.). Wiley-Interscience. ISBN 978-0-471-37499-2.
- Kurt Martin Mislow Kurt Mislow (15. 1. 2003). Introduction to Stereochemistry. Dover Publications. ISBN 978-0-486-42530-6.
- D. Nasipuri (1994). Stereochemistry of Organic Compounds: Principles and Applications (2. izd.). South Asia Books. ISBN 978-81-224-0570-5.
