Enzim razgradnje glikogenskih grana
| Amilo-α-1,6-glukozidaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Enzim kresanja grana kod E. coli | |||||||||
| Identifikatori | |||||||||
| EC broj | 3.2.1.33 | ||||||||
| CAS broj | 9012-47-9 | ||||||||
| Baze podataka | |||||||||
| IntEnz | IntEnz pregled | ||||||||
| BRENDA | BRENDA pristup | ||||||||
| ExPASy | NiceZyme pregled | ||||||||
| KEGG | KEGG pristup | ||||||||
| MetaCyc | metabolički put | ||||||||
| PRIAM | profil | ||||||||
| Strukture PBP | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Ontologija gena | AmiGO / EGO | ||||||||
| |||||||||

Enzim razlaganja glikogenskih grana ili enzim kresanja grana je molekul koji učestvuje u razgradnji glikogena, skladišta glukoze u telu, aktivnošću glukoziltransferaza i glukozidaza. Zajedno sa fosforilazama, ovi enzimi mobilišu rezerve glukoze iz glikogenskih naslaga u mišićima i jetri. Ovo predstavlja glavni izvor energetskih rezervi u većini organizama. Razgradnja glikogena u telu je visoko regulirana, posebno u jetri, putem raznih hormona, uključujući insulin i glukagon, da bi se održao homeostatski balans nivoa glukoze u krvi. Kada je razgradnja glikogena ugrožena mutacijama u sintezi ovog enzima, javljaju se metaboličke bolesti, kao što je bolest glikogenske pothranjenosi tipa III.
Kod sisara, kvasaca i nekih bakterija, glukoziltransferaza i glukozidaza se javljaju u jednom enzimu, dok kod E. coli i drugih bakterija, to čine dva različita enzima, što komplikuje nomenklaturu. Proteini koji kataliziraju obe funkcije se nazivaju glikogen enzimi za razlaganje glikogenskih grana ili enzimi kresanja glikogenskih grana (GDE). Kada se glukoziltransferaza i glukozidaza katalizuju različitim enzimima, naziv se obično odnosi na glukozidazni enzim.[1][2]
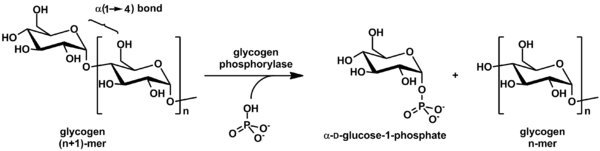
.
Struktura i aktivnost[uredi | uredi izvor]
Dva enzima[uredi | uredi izvor]
Kod Escherichia coli i drugih bakterija, glukoziltransferaza i glukozidaza deluju putem dva različita enzima. Kod E. coli, transfer glukoze obavlja 4-alfa-glukanotransferaza, protein od 78,5 kDa, koji je kodiran genom malQ. Drugi protein, zvani enzim za otklanjane grana, razlaganje obavlja alfa-1,6-glukoza. Ovaj enzim ima molekulsku masu od 73,6 kDa, a kodiran genom glgX. Aktivnost ova dva enzima ne odvija se uvek nužno zajedno. Kod E. coli glgX selektivno katalizuje razlaganje 4-podedinične grane, bez akcije glukanotransferaze. Proizvod ovog razlaganja, maltotetraoza, dodatno degradira maltodekstrin fosforilaza.[3][4][5]
Gen GlgX E. coli je strukturno sličan proteinu izoamilazi. Monomerni protein sadrži centralni domen u kojem je osam paralelnih beta-lanaca okruženo sa osam paralelnih alfa niti. Unutar ove strukture je rascep dužine 26 angstrema, a širok 9 angstrema, koji sadrži aromatske ostatke za koje se smatra da, pre razlaganja, stabilizuju četveroglukozne grane.[1]
Jedan enzim sa dva katalitska mesta[uredi | uredi izvor]
Kod sisara i kvasaca, jedan enzim obavlja obe funkcije uklanjanja glikogenskih grana. Ljudski enzim uklanjanja grana glikogena (gen: AGL) je monomer s molekulskom masom od 175 kDa. Dokazano je da dve katalitske akcije AGL mogu funkcionisati nezavisno jedna od druge, što pokazuje da je prisutno više aktivnih mesta. Ova pojava je ojačana aktivnim mestom inhibitora, kao što je polihidroksiamin, za koji je utvrđeno da inhibira glukozidaznu aktivnost dok transferazna nije merljivo promenjena. Enzim za razlaganje glikogenskih grana je jedini poznati eukariotski enzim koji sadrži više katalitskih mesta i koji je aktivan kao monomer.
Neke studije su pokazale da je pola kvašćevih GDE C-krajeva povezano sa glukozidaznom aktivnosti, dok je pola N-krajeva povezano sa aktivnosti glukoziltransferaze. Osim ova dva aktivna mesta, čini se da AGL sadrži i treće aktivno mesto koji omogućava da se veže za glikogenski polimer. Iako je kompletna struktura GDE kod eukariota tek treba da se utvrdi, misli se da se vežu za šestomolekulske lance glukoze kao i razgranate glukoze, što odgovara sedam podedinica u aktivnom mjestu, kao što je prikazano na slici ispod.[6][7][8][9][10][11][12][13][14][15][16]

Može se uočiti da kada je glukoza u aktivnom mestu 'A', 'B', 'C' i '0' je najbrže hidroliziraju. Ovo ukazuje da je ovaj region veza lanca glikogena najjači na aktivnom mestu, jer jača interakcija između enzima i supstrata dovodi do brže hidrolize. Uprkos ovom napretku, kompletna struktura GDE kod eukariota tek treba da se utvrdi. Enzimi koji razlažu glikogen kod arheja Sulfolobus solfataricus su bolje okarakterisani od onih kod eukariota. GDE u S. solfataricus je poznat kao Trex. Iako, kao i sisarski GDE, Trex ima i amilozidazne i glukanotransferazne funkcije, Trex je strukturno sličan glgX i ima masu od 80 kD i jedno aktivno mesto. Za razliku od glgX ili AGL, međutim, Trex u rastvoru postoji kao dimer i tetramer. Izgleda da oligomerni oblik Treksa ima značajnu ulogu u izmeni i oblika i funkcije enzima. Smatra se da dimerizacija stabilizuje „fleksibilne petlje” koje se nalaze u neposrednoj blizini aktivnog mesta. To može biti ključ za objašnjenje zašto TREX (i ne glgX) ispoljava glukoziltransferaznu aktivnost. Kao tetramera, katalitske efikasnosti TREX su povećana četiri puta, u odnosu na svoj dimerni oblik.[7][8][1][11]
Genetička lokcija[uredi | uredi izvor]
Službeni naziv za gen je „amilo- α-1,6- glukozidaza, α- glukanotransferaza 4-”, sa službenim simbolom AGL. AGL je autozomni gen koji se nalazi na hromozomu 21, pozicija: lp21. AGL gen sadrži uputstva za izradu nekoliko različitih verzija, poznatih kao [[izoforma|izoforme, enzima za razlaganje glikogenskih grana. Ove izoforme razlikuju se po veličini i ispoljavaju se u različitim tkivima, kao što su jetra i mišići. Ovaj gen je studiran u detalje, jer njegova mutacija je uzrok bolesti skladištenja glikogena, tipa III.
Gen je dug 85 kb, a ima 35 eksona i kodira za 7,0 kb-iRNK. Translacija gena počinje u egzonu 3, koji kodira prvih 27 aminokiselina AGL, jer su prva dva egzona (68kb) sadrže neprevedene 5' regije. Eksoni 4-35 kodiraju preostalih 1.505 aminokiselina koje kodira AGL gen.[17][18][19][20]
Klinički značaj[uredi | uredi izvor]
Kada je ugrožena aktivnost GDE, telo ne može efikasno otpuštati uskladišteni glikogen, pa se javlja tip III bolesti skladištenja glikogena (zbog nedostatka enzima), što je autozomno recesivni poremećaj. Razgradnja GSD III glikogen je nepotpuna i ne postoji akumulacija abnormalnog glikogena sa kratkim vanjskim granama.
Većina pacijenata pokazuju nedostatak GDE i u jetri i mišićima (tp IIIa), iako 15% pacijenata sadrži GDE u mišićima, a koji je odsutan iz jetri (Tip IIIb). Zavisno od mesta mutacije, različite mutacije u AGL genu mogu uticati na različite izoforme ekspresije gena. Na primer, mutacije koje se javljaju na egzonu 3, utiču na oblik koji deluje na izoforme koje su je prvenstveno izražene u jetri; to dovodi do pojave GSD tip III.
Ove različite manifestacije proizvode raznovrsne simptome, koji mogu biti gotovo isti kao kod tipa I GSD, uključujući i hepatomegaliju, hipoglikemiju kod dece, nizak rast, miopatije i kardiopatije.
Pacijenti sa tipom IIIa često imaju simptome koji se odnose na bolesti jetre i progresiju u mišićnima, sa varijacijama koji su uslovljeni godinom početka, stopom progresije i ozbiljnosti bolesti. Pacijenti s Tip IIIb obično simptome koji se odnose na bolest jetre.[20] Pacijenti sa tipom III se razlikuju po povišenim enzimom jetre, sa normalnim razinam mokraćne kiseline i laktata u krvi, za razliku od drugih oblika GSD. U pacijenata sa uključenošću mišića, tip IIIa, mišićna slabost postaje dominantna u odraslom dobu i može dovesti do hipertrofije srčanih komora i distalnih mišića.
Reference[uredi | uredi izvor]
- ^ а б в Song HN, Jung TY, Park JT, Park BC, Myung PK, Boos W, Woo EJ, Park KH (jun 2010). „Structural rationale for the short branched substrate specificity of the glycogen debranching enzyme GlgX”. Proteins. 78 (8): 1847—55. PMID 20187119. doi:10.1002/prot.22697.
- ^ Bao Y, Dawson TL, Chen YT (decembar 1996). „Human glycogen debranching enzyme gene (AGL): complete structural organization and characterization of the 5' flanking region”. Genomics. 38 (2): 155—65. PMID 8954797. doi:10.1006/geno.1996.0611.
- ^ Chen YT, He JK, Ding JH, Brown BI (decembar 1987). „Glycogen debranching enzyme: purification, antibody characterization, and immunoblot analyses of type III glycogen storage disease”. Am. J. Hum. Genet. 41 (6): 1002—15. PMC 1684360
 . PMID 2961257.
. PMID 2961257.
- ^ „Glycogen debranching enzyme - Homo sapiens (Human)”. UniProt.
- ^ Gillard BK, White RC, Zingaro RA, Nelson TE (septembar 1980). „Amylo-1,6-glucosidase/4-alpha-glucanotransferase. Reaction of rabbit muscle debranching enzyme with an active site-directed irreversible inhibitor, 1-S-dimethylarsino-1-thio-beta-D-glucopyranoside”. J. Biol. Chem. 255 (18): 8451—7. PMID 6447697.
- ^ Gillard BK, Nelson TE (septembar 1977). „Amylo-1,6-glucosidase/4-alpha-glucanotransferase: use of reversible substrate model inhibitors to study the binding and active sites of rabbit muscle debranching enzyme”. Biochemistry. 16 (18): 3978—87. PMID 269742. doi:10.1021/bi00637a007.
- ^ а б Woo EJ, Lee S, Cha H, Park JT, Yoon SM, Song HN, Park KH (oktobar 2008). „Structural insight into the bifunctional mechanism of the glycogen-debranching enzyme TreX from the archaeon Sulfolobus solfataricus”. J. Biol. Chem. 283 (42): 28641—8. PMC 2661413
 . PMID 18703518. doi:10.1074/jbc.M802560200.
. PMID 18703518. doi:10.1074/jbc.M802560200.
- ^ а б „TreX - Actinoplanes sp. SN223/29”. UniProt.
- ^ „Glycogen debranching enzyme - Escherichia coli O139:H28 (strain E24377A / ETEC)”. UniProt.
- ^ „4-alpha-glucanotransferase - Escherichia coli (strain K12)”.
- ^ а б Park JT, Park HS, Kang HK, Hong JS, Cha H, Woo EJ, Kim JW, Kim MJ, Boos W, Lee S, Park KH (2008). „Oligomeric and functional properties of a debranching enzyme (TreX) from the archaeon Sulfobus solfataricus P2.”. Biocatalysis and Biotransformation. 26: 76—85. doi:10.1080/10242420701806652.
- ^ Talente GM, Coleman RA, Alter C, Baker L, Brown BI, Cannon RA, Chen YT, Crigler JF, Ferreira P, Haworth JC, Herman GE, Issenman RM, Keating JP, Linde R, Roe TF, Senior B, Wolfsdorf JI (februar 1994). „Glycogen storage disease in adults”. Ann. Intern. Med. 120 (3): 218—26. PMID 8273986. doi:10.7326/0003-4819-120-3-199402010-00008.
- ^ S, Satdarshan P.. Monga (2010). Molecular Pathology of Liver Diseases (Molecular Pathology Library). Berlin: Springer. ISBN 978-1-4419-7106-7.
- ^ Hondoh H, Saburi W, Mori H, et al. (2008). „Substrate recognition mechanism of alpha-1,6-glucosidic linkage hydrolyzing enzyme, dextran glucosidase from Streptococcus mutans”. J. Mol. Biol. 378 (4): 913—22. PMID 18395742. doi:10.1016/j.jmb.2008.03.016.
- ^ McCarter JD, Withers SG (decembar 1994). „Mechanisms of enzymatic glycoside hydrolysis”. Curr. Opin. Struct. Biol. 4 (6): 885—92. PMID 7712292. doi:10.1016/0959-440X(94)90271-2.
- ^ Yamamoto E, Makino Y, Omichi K (maj 2007). „Active site mapping of amylo-alpha-1,6-glucosidase in porcine liver glycogen debranching enzyme using fluorogenic 6-O-alpha-glucosyl-maltooligosaccharides”. J. Biochem. 141 (5): 627—34. PMID 17317688. doi:10.1093/jb/mvm065.
- ^ S, Chiba (avgust 1997). „Molecular mechanism in alpha-glucosidase and glucoamylase”. Biosci. Biotechnol. Biochem. 61 (8): 1233—9. PMID 9301101. doi:10.1271/bbb.61.1233.
- ^ „Genes (Genetic Home Reference a service of U.S. National Library of Medicine.”. Приступљено 29. 2. 2012.
- ^ Shen J, Bao Y, Liu HM, Lee P, Leonard JV, Chen YT (jul 1996). „Mutations in exon 3 of the glycogen debranching enzyme gene are associated with glycogen storage disease type III that is differentially expressed in liver and muscle”. J. Clin. Invest. 98 (2): 352—7. PMC 507437
 . PMID 8755644. doi:10.1172/JCI118799.
. PMID 8755644. doi:10.1172/JCI118799.
- ^ а б Kishnani PS, Austin SL, Arn P, et al. (jul 2010). „Glycogen storage disease type III diagnosis and management guidelines”. Genet. Med. 12 (7): 446—63. PMID 20631546. doi:10.1097/GIM.0b013e3181e655b6.
Spoljašnje veze[uredi | uredi izvor]
- GeneReviews/NCBI/NIH/UW entry on Glycogen Storage Disease Type III
- OMIM entries on Glycogen Storage Disease Type III
- Glycogen+debranching+enzyme на US National Library of Medicine Medical Subject Headings (MeSH)
