Inhibitor enzima

Inhibitor enzima je molekul koji se vezuje za enzim i umanjuje njegovu aktivnost. Pošto blokiranje enzimske aktivnosti može da uzrokuje uginuće patogena ili da koriguje metaboličku neuravnoteženost, stoga su mnogi lekovi inhibitori enzima. Inhibitori enzima se takođe koriste kao pesticidi. Nisu svi molekuli koji se vezuju za enzime inhibitori; aktivatori enzima se vezuju za enzime i povećavaju njihovu aktivnost, dok se enzimski supstrati vezuju i bivaju konvertovani do produkata u normalnom katalitičkom ciklusu enzima.
Vezivanje inhibitora može da spreči pristup supstrata enzimskom aktivnom mestu i/ili omete enzim pri katalizi biohemijske reakcije. Vezivanje inhibitora može da bude reverzibilno ili ireverzibilno. Ireverzibilni inhibitori obično reaguju sa enzimom i hemijski ga menjaju (npr. formiranjem kovalentne veze), te modifikuju ključne aminokiselinske ostatke neophodne za enzimatsku aktivnost. Nasuprot ovome, reverzibilni inhibitori se vezuju nekovalentno, te se različiti tipovi inhibicije javljaju zavisno od toga da li se inhibitori vezuju za enzim, za enzimsko-supstratni kompleks, ili za oboje.[1]
Mnogi molekuli lekova su inhibitori enzima, tako da je njihovo otkrivanje i poboljšanje aktivna oblast istraživanja u biohemiji i farmakologiji. Medicinski enzimski inhibitori se često vrednuju po svojoj specifičnosti (svom odsustvu vezivanja za druge proteine) i svojoj potentnosti (svojoj konstanti disocijacije, koja je indikator koncentracije neophodne za inhibiciju enzima). Visoka specifičnost i potentnost su preduslovi da lek ispoljava mali broj nuspojava i stoga nisku toksičnost.
Enzimski inhibitori se isto tako javljaju u prirodi i učestvuju u regulaciji metabolizma. Na primer, enzimi u metaboličkom putu mogu da budu inhibirani produktima daljih koraka puta. Ovaj tip povratne sprege usporava ćelijsku proizvodnu liniju kad produkti počnu da se nakupljaju, i to je jedan od važnih načina održavanja homeostaze u ćelijama. Drugi ćelijski enzimski inhibitori su proteini, koji se specifično vezuju za i inhibiraju enzimsku metu. To može da pomogne u kontroli enzima, koji bi inače mogli da oštete ćeliju, kao što su proteaze ili nukleaze. Jedna detaljno okarakterisana klasa inhibitornih molekula su ribonukleazni inhibitori, koji se vezuju za ribonukleaze formirajući jednu od najčvršćih poznatih protein—protein interakcija.[2] Prirodni enzimski inhibitori takođe mogu da budu otrovi i da se koriste kao vid odbrane od predatora, ili kao način ubijanja plena.
Reverzibilni inhibitori[uredi | uredi izvor]
Tipovi reverzibilnih inhibitora[uredi | uredi izvor]
Reverzibilni inhibitori se vezuju za enzime putem nekovalentnih interakcija kao što su vodonične veze, hidrofobne interakcije i jonske veze. Višestruke slabe veze između inhibitora i aktivnog mesta se kombinuju i proizvode jako i specifično vezivanje. Za razliku od supstrata i ireverzibilnih inhibitora, reverzibilni inhibitori generalno ne podležu hemijskim reakcijama pri vezivanju za enzim i mogu lako da se uklone razblaživanjem ili dijalizom.
Postoje četiri vrste reverzibilnih enzimskih inhibitora. Klasifikuju se na osnovu uticaja promenljive koncentracije enzimskog supstrata na inhibitor.[3]

- U konkurentnoj inhibiciji, supstrat i inhibitor ne mogu istovremeno da se vežu za enzim, kao što je to prikazano na slici desno. To je obično posledica toga da inhibitor ima afinitet za aktivno mesto enzima za koje se takođe vezuje supstrat; supstrat i inhibitor se nadmeću za pristup aktivnom mestu enzima. Ovaj tip inhibicije se može prevazići primenom dovoljno visokih koncentracija supstrata (Vmax ostaje konstantno), od. putem nadmašivanja koncentracije inhibitora. Međutim, dolazi do povećanja pojavne vrednosti Km, jer je potrebna veća koncentracija supstrata da bi se dosegla tačka Km, ili polovina vrednosti Vmax.[4] Konkurentni inhibitori su obično strukturno slični realnom supstratu (vidi primere ispod).
- U nekonkurentnoj inhibiciji, inhibitor se jedino vezuje za supstratno-enzimski kompleks. Ovaj tip inhibicije uzrokuje sniženje vrednosti Vmax (maksimalna brzina se smanjuje usled uklanjanja aktiviranog kompleksa) i vrednosti Km (usled povećane efikasnosti vezivanja koja proizilazi iz Le Šateljeovog principa i efektivne eliminacije ES kompleksa čime se umanjuje Km, što je indikator povećanog afiniteta vezivanja).[4]
- U beskonkurentnoj inhibiciji, vezivanjem inhibitora za enzim redukuje se njegova aktivnost, mada to nema uticaja na vezivanje supstrata. Rezultat ovoga je da stepen inhibicije jedino zavisi od koncentracije inhibitora. Vrednost Vmax se smanjuje, jer se reakcija odvija manje efikasno, dok se vrednost Km ne menja, pošto se samo vezivanje supstrata — po definiciji — i dalje normalno odvija.[4]
- U mešovitoj inhibiciji, inhibitor se može vezati za enzim istovremeno sa supstratom enzima. Međutim, ovakvo vezivanje inhibitora utiče na vezivanje supstrata, i obrnuto. Ova vrsta inhibicije se može umanjiti, ali ne i prevazići povećanjem koncentracije supstrata. Mada postoji mogućnost da se inhibitori mešovitog tipa vežu na aktivnom mestu, ovaj tip inhibicije generalno proizilazi iz alosternog dejstva, pri čemu se inhibitor vezuje na različitom mestu na enzimu. Vezivanje inhibitora za alosterno mesto menja konformaciju (tj. tercijarnu strukturu ili trodimenzionalni oblik) enzima, tako da je afinitet supstrata za aktivno mesto umanjen.[4]
Kvantitativni opis reverzibilne inhibicije[uredi | uredi izvor]
Reverzibilna inhibicija se može kvantitativno opisati u pogledu vezivanja inhibitora za enzim i za enzimsko-supstratni kompleks, kao i njegovog uticaja na kinetičke konstante enzima. U klasičnoj Mihaelis—Menteninoj šemi ispod, enzim (E) vezuje se za svoj supstrat (S) i formira enzimsko-supstratni kompleks ES. Nakon katalize, ovaj kompleks se razlaže i oslobađaju se produkt P i slobodni enzim. Inhibitor (I) može se vezati ili za E ili za ES sa konstantama disocijacije Ki ili Ki′, redom.
Kada enzim ima višestruke supstrate, inhibitori mogu da ispolje različite tipove inhibicije u zavisnosti od toga koji se supstrat posmatra. Do ovoga dolazi zato što aktivno mesto sadrži dva različita mesta vezivanja, po jedno za svaki supstrat. Na primer, inhibitor se može nadmetati sa supstratom A za prvo mesto vezivanja, a biti beskonkurentni inhibitor supstrata B u drugom mestu vezivanja.[5]
Merenje konstanti disocijacije reverzibilnog inhibitora[uredi | uredi izvor]
Kao što je napomenuto iznad, enzimski inhibitor se opisuje putem svojih dveju konstanti disocijacije: Ki i Ki′, za enzim i enzimsko-supstratni kompleksa, redom. Enzimsko-inhibitorska konstanta Ki se može direktno meriti različitim metodima. Jedan od izuzetno preciznih metoda je izotermalna titraciona kalorimetrija, u kojoj se inhibitor titrira u rastvor enzima; potom se meri oslobođena ili apsorbovana toplota.[6] Međutim, drugu konstantu disocijacije Ki′ je teško direktno meriti, pošto je enzimsko-supstratni kompleks kratkotrajan i podleže hemijskoj reakciji kojom se formira produkt. Stoga se Ki′ obično indirektno meri, i to putem posmatranja enzimske aktivnosti pri različitim koncentracijama supstrata i inhibitora, te postavljanjem podataka[7] u modifikovanu Mihaelis—Menteninu jednačinu.
gde su modifikujući faktori α i α′ definisani putem koncentracije inhibitora i njegovih dveju konstanti disocijacije:

Stoga, u prisustvu inhibitora, enzimske efektivne vrednosti Km i Vmax postaju (α/α′)Km i (1/α′)Vmax, redom. Treba imati u vidu da modifikovana Mihaelis—Mentenina jednačina podrazumeva da je ostvarena ravnoteža vezivanja inhibitora za enzim, što može da bude veoma spor proces za inhibitore sa podnanomolarnim konstantama disocijacije. U tim slučajevima, obično je praktičnije da se tretira čvrsto vezujući inhibitor kao ireverzibilni inhibitor (vidi ispod); mada, još uvek može da postoji opcija kinetičkog procenjivanja Ki′, ako se nezavisno izmeri Ki.
Uticaji različitih tipova reverzibilnih inhibitora enzima na enzimatsku aktivnost se mogu prikazati koristeći grafičke reprezentacije Mihaelis—Mentenine jednačine, kao što su Lajnviver—Berkov i Edi—Hofstijev dijagram. Na primer, na Lajnviver—Berkovom dijagramu prikazanom desno, linije konkurentne inhibicije seku se na y-osi, što ilustruje da takvi inhibitori nemaju uticaja na Vmax. Analogno, linije beskonkurentne inhibicije seku se na x-osi, što pokazuje da ovi inhibitori ne utiču na Km. Međutim, često je teško precizno proceniti Ki i Ki′ sa dijagrama,[8] pa se preporučuje korišćenje pouzdanijih metoda nelinearne regresije za procenu konstanti (opisano iznad).
Reverzibilni inhibitori[uredi | uredi izvor]
Tradicionalno se reverzibilni inhibitori enzima klasifikuju kao konkurentni, nekonkurentni ili beskonkurentni, na osnovu njihovog uticaja na parametre Km i Vmax. Ti različiti uticaji direktno proizilaze iz načina vezivanja inhibitora za enzim E, enzimsko-supstratni kompleks ES, ili oba. Podela u ove klase proističe iz problema sa određivanjem parametara i stvara potrebu za korišćenjem različitih konstanti vezivanja za opisivanje čina vezivanja. Vezivanje inhibitora i njegov uticaj na enzimatsku aktivnost su dve potpuno različite svari, što je još jedan problem koji tradicionalne jednačine ne odražavaju. Kod nekonkurentne inhibicije vezivanje inhibitora sledstveno jednačinama jedino dovodi do potpune (100%) inhibicije enzima, i jednačine ne ostavljaju mogućnost postojanja bilo čega između tih krajnosti.[9] Zajednički oblik inhibitornog člana takođe zamagljuje odnos između vezivanja inhibitora za enzim i njegovog odnosa sa drugim članovima vezivanja, bilo da je to Mihaelis—Mentenina jednačina ili dozno-responsna kriva asocirana sa vezivanjem liganda za receptor. Da bi se demonstrirao odnos, može se stvoriti sledeće preraspoređivanje:
Dodajući nulu na dno ([I]−[I]):
... i deleći sa [I]+Ki dobija se:
Ova jednačina demonstrira da je slično Mihaelis—Menteninoj jednačini, gde brzina reakcije zavisi od procenta enzimske populacije koja međudeluje sa supstratom:
razlomak enzimske populacije vezane supstratom
razlomak enzimske populacije vezane inhibitorom
... uticaj inhibitora rezultat procenta populacije enzima koja međudeluje sa inhibitorom. Jedini problem sa ovom jednačinom u njenoj trenutnoj formi je što podrazumeva apsolutnu inhibiciju enzima vezivanjem inhibitora, dok se u stvarnosti može javiti širok opseg uticaja: od 100% inhibicije supstrata do samo izvesnog procenta, > 0%. Da bi se ovo uzelo u obzir, jednačina se može jednostavno modifikovati uvođenjem člana delta Vmax, tako da dozvoljava različite stepene inhibicije:
... ili:
Ovaj član može onda da definiše rezidualni procenat enzimatske aktivnosti kad inhibitor interaguje sa individualnim enzimima u populaciji. Uvrštavanje ovog člana ima dodatnu prednost dozvoljavanja mogućnosti aktivacije ako se ispostavi da je sekundarni član Vmax veći od inicijalnog člana. Da bi se u obzir takođe uzela mogućnost aktivacije, jednačina se može prilagoditi zamenjivanjem inhibitorske oznake „I” opštom oznakom odnosno modifikatorskim članom koji je ovde označen sa „X”:
Dok ova terminologija dovodi do pojednostavljenog načina rukovanja kinetičkim efektima vezanim za maksimalnu brzinu Mihaelis—Mentenine jednačine, ona isto tako naglašava potencijalne probleme sa članovima koji se koriste za opisivanje efekata vezanih za Km. Vrednost Km vezana za afinitet enzima za supstrat je u većini slučaja povezana sa mogućim promenama mesta vezivanja enzima, što je direktna posledica interakcije enzima i inhibitora. Stoga je član sličan gorenavedenom članu za korekciju Vmax podesan u većini slučajeva:[10][11]
Specijalni slučajevi[uredi | uredi izvor]
- Mehanizam parcijalno konkurentne inhibicije je sličan onom beskonkurentne, izuzev što EIS kompleks ima katalitičku aktivnost, koja može da bude niža ili čak viša (parcijalno kompetitivna aktivacija) od aktivnosti enzimsko-supstratnog (ES) kompleksa. Ova inhibicija tipično ispoljava nižu vrednost Vmax, dok se vrednost Km ne menja.[5][12]
- Nekonkurentna inhibicija se javlja kada se inhibitor vezuje samo za enzimsko-supstratni kompleks, ne i za slobodni enzim; kompleks EIS je katalitički neaktivan. Ovaj način inhibicije je redak i uzrokuje smanjivanje obeju vrednosti, i Vmax i Km.[5]
- Inhibicija supstrata i produkata se javlja kad bilo supstrat ili produkt enzimatske reakcije inhibira enzimsku aktivnost. Ovaj oblik inhibicije može da sledi kompetitivne, nekompetitivne ili mešovite obrasce. Pri supstratnoj inhibiciji dolazi do progresivnog smanjenja aktivnosti pri visokim koncentracijama supstrata. To može da bude indikacija postojanja dva mesta vezivanja supstrata na enzimu. Pri niskim koncentracijama supstrata, mesto visokog afiniteta je okupirano i normalna kinetika dolazi do izražaja. Međutim, pri višim koncentracijama dolazi do zauzeća sekundarnog, inhibitornog mesta, čime se inhibira enzim.[13] Produkt inhibicije često služi kao regulatorno svojstvo pri metabolizmu i može da formira negativnu povratnu spregu.[14]
- Spora nepropusna inhibicija se javlja kad inicijalni kompleks enzima i inhibitora (EI) podleže izomerizaciji do drugog, čvršće pakovanog (nepropusnog) kompleksa, EI*, iako je sveukupni proces inhibicije reverzibilan.[15] Ovo se manifestuje kao sporo rastuća inhibicija enzima. Pod ovim uslovima, tradicionalna Mihaelis—Mentenina kinetika daje pogrešnu vrednost za Ki, jer je ona zavisna od vremena. Tačna vrednost Ki se može dobiti putem kompleksnije analize konstanti brzina asocijacije (kon) i disocijacije (koff) inhibitora. Dodatne informacije su dostupne u odeljku o ireverzibilnoj inhibiciji.
Primeri reverzibilnih inhibitora[uredi | uredi izvor]

Enzimi su evoluciono razvili sposobnost čvrstog vezivanja svojih supstrata; kako se većina reverzibilnih inhibitora vezuje za aktivno mesto enzima, nije iznenađujuće da neki od tih inhibitora imaju veoma slične strukture sa supstratima svoje mete. Jedan od primera oponašanja supstrata su proteazni inhibitori. Oni su veoma uspešna klasa antiretroviralnih lekova koji se koriste za lečenje infekcije HIV.[16] Struktura ritonavira, proteaznog inhibitora koji je baziran na peptidu i koji sadrži tri peptidne veze, prikazana je sa desne strane. Ovaj lek nalikuje na protein koji je supstrat HIV proteaze; nadmeće sa ovim supstratom za pristup aktivnom mestu enzima.
Enzimski inhibitori se često dizajniraju tako da oponašaju prelazno stanje ili intermedijer enzimski katalizovane reakcije. Time se osigurava da inhibitor iskoristi stabilizujući efekat prelaznog stanja enzima, što dovodi do poboljšanog afiniteta vezivanja (niže Ki vrednosti) nego što je to slučaj sa dizajnima zasnovanim na supstratu. Primer ovakvog inhibitora prelaznog stanja je antiviralni lek oseltamivir; ovaj lek oponaša planarnu strukturu prstena oksonijumskog jona u reakciji viralnog enzima neuraminidaze.[17]
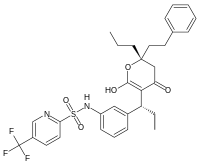
Međutim, nisu svi inhibitori bazirani na strukturama supstrata. Na primer, struktura drugog inhibitora HIV proteaze tipranavira prikazana je na levoj strani. Ovaj molekul nije zasnovan na peptidu i nije očiglednu strukturnu sličnost sa proteinskim supstratom. Ovi nepeptidni inhibitori mogu da budu stabilniji od inhibitora koji sadrže peptidne veze, pošto oni ne mogu da budu supstrati peptidaza i mnogo manje su skloni degradaciji.[18]
Pri dizajnu lekova je važno da se uzmu u obzir koncentracije supstrata kojima su izloženi ciljni enzimi. Na primer, neki inhibitori proteinskih kinaza imaju hemijske strukture koje su slične adenozin-trifosfatu, jednom od supstrata pomenutih enzima. Međutim, lekovi koji su jednostavni kompetitivni inhibitori će morati da se nadmeću sa visokim koncentracijama ATP molekula u ćeliji. Proteinske kinaze se isto tako mogu inhibirati konkurisanjem za mesta vezivanja na kojima kinaze međudeluju sa svojim supstratnim proteinima, a većina proteina je prisutna u ćelijama sa daleko nižim koncentracijama od koncentracije ATP molekula. Posledično, ako se dva inhibitora proteinske kinaze vezuju za aktivna mesta sa sličnim afinitetom — a samo jedan od njih treba da se nadmeće sa ATP molekulima, onda će kompetitivni inhibitor na mestu proteinskog vezivanja efektivnije inhibirati enzim.[19]
Ireverzibilni inhibitori[uredi | uredi izvor]
Tipovi ireverzibilne inhibicije (kovalentna inaktivacija)[uredi | uredi izvor]

Ireverzibilni inhibitori obično kovalentno modifikuju enzim, te inhibicija stoga ne može da bude povratna. Ireverzibilni inhibitori često sadrže reaktivne funkcionalne grupe, kao što su azotni iperiti, aldehidi, haloalkani, alkeni, Majklovi akceptori, fenil sulfonati ili fluorofosfonati. Te elektrofilne grupe reaguju sa aminokiselinskim bočnim lancima i formiraju kovalentne dodatke. Modifikovani ostaci su oni sa bočnim lancima koji sadrže nukleofile kao što su hidroksilne ili sulfhidrilne grupe; tu se ubrajaju aminokiseline serin (npr. DFP molekuli, prikazano na desnoj strani), cistein, treonin ili tirozin.[20]
Ireverzibilna inhibicija se razlikuje od ireverzibilne enzimske inaktivacije. Ireverzibilni inhibitori su generalno specifični za jednu klasu enzima i ne inaktiviraju sve proteine; ne funkcionišu uništavajući proteinske strukture nego specifičnim izmenjivanjem aktivnog mesta svoje mete. Na primer, ekstremi vrednosti pH ili temperature obično uzrokuju denaturaciju svih proteinskih struktura, što je nespecifičan efekat. Pojedini nespecifični hemijski tretmani analogno uništavaju proteinsku strukturu: na primer, zagrevanje u koncentrovanoj hlorovodoničnoj kiselini će hidrolizovati peptidne veze koje proteine drže na okupu, oslobađajući ovime slobodne aminokiseline.[21]
Ireverzibilni inhibitori ispoljavaju vremenski zavisnu inhibiciju i njihova potentnost se stoga ne može okarakterisati pomoću IC50 vrednosti. Razlog za ovo je što se količina aktivnog enzima pri datoj koncentraciji ireverzibilnog inhibitora razlikuje u zavisnosti od toga koliko dugo je inhibitor bio preinkubiran sa enzimom. Zbog ovoga, umesto IC50 koriste se kobs/[I] vrednosti,[22] gde je kobs uočena brzina inaktivacije pseudoprvog reda (izvedena is grafika zavisnosti logaritamske vrednosti postotne aktivnosti od vremena) a [I] koncentracija inhibitora. Parameter kobs/[I] je validan dokle god se inhibitor ne zasiti vezivanjem za enzim (u kom slučaju je kobs = kinact).
Analiza ireverzibilne inhibicije[uredi | uredi izvor]

Kao što je prikazano na šemi levo, ireverzibilni inhibitori formiraju reverzibilni nekovalentni kompleks sa enzimom (EI ili ESI), i zatim dolazi do reakcije kojom se formira kovalentno modifikovani neaktivni kompleks EI*. Brzina kojom se EI* formira se naziva brzinom inaktivacije, ili kinact. Pošto formiranje EI može da se nadmeće sa ES, vezivanje ireverzibilnih inhibitora se može sprečiti konkurencijom bilo sa supstratom ili sa drugim, reverzibilnim inhibitorom. Ovaj protekcioni efekat je dobra potvrda specifičnosti reakcije ireverzibilnog inhibitora sa aktivnim mestom.
Koraci vezivanja i inaktivacije ove reakcije se ispituju putem inkubacije enzima sa inhibitorom i utvrđivanjem stepena aktivnosti koja preostaje tokom vremena. Aktivnost će opadati na vremenski zavisan način, obično sledeći eksponencijalni raspad. Uklapanjem ovih podataka u jednačinu brzine dobija se brzina inaktivacije pri datoj koncentraciji inhibitora. Ovo se radi za nekoliko različitih koncentracija inhibitora. Ako dolazi do formiranja reverzibilnog EI kompleksa, biće uočljivo zasićenje brzine inaktivacije i iz odgovarajuće krive biće moguće izvesti kinact i Ki.[23]
Drugi metod koji je u širokoj upotrebi u ovim analizama je masena spektrometrija. Ovde precizno merenje mase nemodifikovanog prirodnog enzima i inaktiviranog enzima daje povećanje mase uzrokovano reakcijom sa inhibitorom i pokazuje stehiometriju reakcije.[24] To se obično radi koristeći MALDI-TOF maseni spektrometar. U komplementarnoj tehnici zvanoj peptidni maseni otisci prstiju vrši se razlaganje prirodnog i modifikovanog proteina dejstvom proteaze, kao što je tripsin. Time nastaje set peptida koji se mogu analizirati koristeći maseni spektrometar. Peptidi koji promene masu nakon reakcije sa inhibitorom su oni koji sadrže mesto modifikacije.
Specijalni slučajevi[uredi | uredi izvor]

Ne formiraju svi ireverzibilni inhibitori kovalentne dodatke na svojim enzimskim metama. Neki reverzibilni inhibitori se tako čvrsto vežu za svoje ciljne enzime da su u suštini ireverzibilni. Ovi potentno vezujući inhibitori mogu da ispolje kinetiku sličnu kovalentnim ireverzibilnim inhibitorima. Neki od ovih inhibitora se brzo vezuju za enzim u EI kompleksu niskog afiniteta i zatim dolazi do sporog preraspoređivanja do veoma čvrsto vezanog EI* kompleksa (pogledajte levu sliku iznad). Ovakvo kinetičko ponašanje se naziva sporim vezivanjem.[26] Spori rearanžman nakon vezivanja često obuhvata konformacionu promenu pri čemu se enzim obavije oko molekula inhibitora. Primeri sporo vezujućih inhibitora su neki važni lekovi, kao što je metotreksat,[27] alopurinol[28] i aktivirani oblik aciklovira.[29]
Primeri ireverzibilnih inhibitora[uredi | uredi izvor]

Diizopropilfluorofosfat (DFP) prikazan je kao primer ireverzibilnog proteaznog inhibitora na desnoj slici iznad. Enzim hidrolizuje fosforno-fluornu vezu, ali fosfatni ostatak ostaje vezan za serin u aktivnom mestu, čime se enzim deaktivira.[30] Slično ovome, DFP takođe reaguje sa aktivnim mestom acetilholinske esteraze u sinapsama neurona; posledično je potentan neurotoksin, sa smrtnom dozom manjom od 100 mg.[31]
Samoubilačka inhibicija je neobični tip ireverzibilne inhibicije gde enzim konvertuje inhibitor u reaktivnu formu u svom aktivnom mestu. Primer takvog jedinjenja je inhibitor poliaminske biosinteze, α-difluorometilornitin ili DFMO, koji je analogan aminokiselini ornitin i koristi se za lečenje afričke tripanosomijaze (bolest spavanja). Ornitinska dekarboksilaza može da katalizuje dekarboksilaciju DFMO umesto ornitina, kao što je prikazano iznad. Međutim, ovoj reakciji dekarboksilacije sledi eliminacija atoma fluora, čime se ovaj katalitički intermedijer konvertuje u konjugovani imin, koji je veoma elektrofilno jedinjenje. Ova reaktivna forma DFMO molekula zatim reaguje ili sa cisteinom ili sa lizinom u aktivnom mestu, da bi se enzim ireverzibilno inaktivirao.[25]
Pošto ireverzibilna obično obuhvata prvobitno formiranje nekovalentnog EI kompleksa, ponekad je moguće da se inhibitor veže za enzim na više od jednog načina. Na primer, na slici levo na kojoj je prikazana tripanotionska reduktaza iz ljudskog protozoanskog parazita Trypanosoma cruzi, dva molekula inhibitora zvanog kvinakrinski iperit vezana su u aktivnom mestu ovog enzima. Gornji molekul je reverzibilno vezan, dok je donji vezan kovalentno pošto je reagovao sa aminokiselinskim ostatkom putem azotnoiperitne grupe.[32]
Otkriće i dizajn inhibitora[uredi | uredi izvor]

Novi lekovi su produkti dugotrajnog procesa razvoja lekova. Prvi korak u tom procesu je često otkriće novog enzimskog inhibitora. U prošlosti je jedini način da se otkriju novi inhibitori bio pristup pokušaja i greške: testiranje ogromnih kolekcija jedinjenja na ciljnom enzimu u nadi da će se doći korisnih molekula. Ovaj pristup grube sile je još uvek uspešan i bio je unapređen primenom pristupa kombinatorne hemije kojima se omogućava brza proizvodnja ogromnog broja novih jedinjenja, kao i tehnologijom visokopropusnog skrininga da bi se brzo testirale ogromne hemijske kolekcije (biblioteke) s ciljem nalaženja inhibitora.[33]
Jedan od skorašnjih alternativnih pristupa je racionalni dizajn lekova, pri čemu se koristi trodimenzionalna struktura aktivnog mesta enzima da bi se predvidelo koji molekuli bi mogli da budu inhibitori.[34] Ta predviđanja se zatim testiraju. Novi inhibitori se nakon toga koriste za dobijanje strukture enzima u kompleksu inhibitor/enzim, da bi se potvrdilo na koji način su molekuli vezani za aktivno mesto. Na bazi struktura je moguće dizajnirati izmenjene inhibitore s ciljem dalje optimizacije vezivanja. Ovaj ciklus testiranja i poboljšanja se zatim ponavlja dok se ne dođe do dovoljno potentnih inhibitora.[35] Niz pristupa baziranih na primeni računara za predviđanje afiniteta inhibitora za enzim takođe je u razvoju. Primeri ovakvih metoda su molekularni doking[36] i molekulska mehanika.[37][38]
Upotrebe inhibitora[uredi | uredi izvor]
Enzimski inhibitori se mogu naći u prirodi. Osim njih postoji i znatan broj inhibitora koji su dizajnirani i proizvode se za farmakološke svrhe i biohemijska istraživanja. Prirodni otrovi su često enzimski inhibitori koji su evoluirali da štite biljke ili životinje od predatora. Ti prirodni toksini obuhvataju neke od najsmrtonosnijih otrova. Veštački inhibitori se često koriste kao lekovi, mada isto tako mogu da budu i insekticidi kao što je malation, herbicidi kao što je glifosat, ili dezinfektanti kao što je triklosan. Deo veštačkih enzimskih inhibitora blokira acetilholinesterazu, enzim koji razlaže acetilholin; koriste se kao nervni agensi u bojnim otrovima.
Hemioterapija[uredi | uredi izvor]
 |
 |
 |
Enzimski inhibitori se najčešće koriste kao lekovi za tretman bolesti. Mnogi od njih deluju na ljudske enzime s ciljem korigovanja patološkog stanja. Međutim, nisu svi lekovi enzimski inhibitori. Neki, kao što su antiepileptički lekovi, menjaju aktivnost enzima uzrokujući da se enzim proizvodi u manjoj ili većoj količini. Ovi efekti se nazivaju enzimska indukcija i inhibicija[42] i predstavljaju promene u izražavanju gena. To nije direkno povezano sa tipom enzimske inhibicije o kojem se ovde govori. Drugi lekovi međudeluju sa ćelijskim metama koje nisu enzimi, kao što su jonski kanali ili membranski receptori.
Primer medicinskog enzimskog inhibitora je sildenafil (vijagra), popularni lek za mušku erektilnu disfunkciju. Ovo jedinjenje je potentni inhibitor cGMP specifične fosfodiesteraze tipa 5, enzima koji degradira signalni molekul ciklični guanozin monofosfat.[43] Ovaj signalni molekul podstiče relaksaciju glatkih mišića i omogućava protok krvi u corpus cavernosum, što uzrokuje erekciju. Pošto lek umanjuje aktivnost enzima koji zaustavlja signal, produžava se trajanje signala.
Još jedan primer strukturne sličnosti pojedinih inhibitora sa supstratima enzima na koje deluju je prikazan na slici desno na kojoj se poredi lek metotreksat sa folnom kiselinom (vitamin B9). Folna kiselina je supstrat dihidrofolatne reduktaze, enzima koji učestvuje u formiranju nukleotida i koji biva potentno inhibiran metotreksatom. Metotreksat blokira dejstvo dihidrofolatne reduktaze i time zaustavlja produkciju nukleotida. Ova blokada nukleotidne biosinteze je toksičnija za brzorastuće ćelije nego za one koje se ne dele, zato što brzorastuće ćelije moraju da izvode replikaciju DNK. Stoga se metotreksat obično koristi za hemoterapiju kancera.[44]
Antibiotici[uredi | uredi izvor]
Lekovi se isto tako koriste za inhibiranje enzima neophodnih za opstanak patogena.[45][46] Na primer, bakterije su okružene debelim ćelijskim zidom sačinjenim iz polimera koji nalikuje na mrežu i zove se peptidoglikan. Mnogi antibiotici, kao što su penicilin i vankomicin, inhibiraju enzime koji proizvode i potom umrežavaju niti tog polimera.[47] Posledica njihovog dejstva je da bakterijski ćelijski zid gubi jačinu i bakterije se rasprsnu.[48] Na slici, molekul penicilina (prikazan u formi „kugli i štapića”) vezan je za svoj ciljni enzim, transpeptidazu iz bakterije Streptomyces R61 (protein je prikazan kao trakasti dijagram).[49]
Antibiotički dizajn lekova je olakšan kad je enzim koji je esencijalan za opstanak patogena odsutan ili veoma različit kod ljudi.[50] U primeru iznad, ljudsko telo ne pravi peptidoglikan, i stoga su inhibitori tog procesa selektivno toksični za bakterije. Selektivna toksičnost se takođe ostvaruje kod antibiotika kroz iskorišćavanje razlika u strukturi ribozoma kod bakterija,[51] ili načina na koji prave masne kiseline.[52]
Metabolička kontrola[uredi | uredi izvor]
Enzimski inhibitori su važni u metaboličkoj kontroli.[53] Mnogi ćelijski metabolički putevi su inhibirani metabolitima, koji kontrolišu enzimsku aktivnost putem alosterne regulacije ili inhibicije supstrata. Dobar primer je alosterna regulacija glikolitičkog puta.[54] Ovaj katabolički put konzumira glukozu i proizvodi ATP, NADH i piruvat.[55][56] Ključni korak u regulaciji glikolize je jedna rana reakcija puta koja je katalizovana fosfofruktokinazom-1 (PFK1).[57][58] Kad se ATP nivo povisi, ATP se vezuje za alosterno mesto na PFK1 čime se smanjuje brzina enzimske reakcije; glikoliza se inhibira i opada produkcija ATP. Ovaj oblik kontrole negativnom povratnom spregom pomaže u održavanju stabilnog nivoa koncentracije ATP molekula u ćeliji.[59] Međutim, metabolički putevi se ne regulišu samo inhibicijom, već je aktivacija enzima jednako važna. U odnosu na PFK1, fruktoza 2,6-bisfosfat i ADP predstavljaju primere metabolita koji deluju kao alosterini aktivatori.[60]
Fiziološka enzimska inhibicija se takođe može proizvesti putem specifičnih proteinskih inhibitora. Ovaj mehanizam se javlja u pankreasu, koji sintetiše mnoštvo digestivnih prekursorskih enzima, poznatih kao zimogeni.[61][62] Mnogi od njih se aktiviraju dejstvom proteaze tripsin,[63] tako da je važno da se inhibira aktivnost tripsina u pankreasu da bi se sprečila mogućnost da organ počne da probavlja sam sebe.[64] Jedan način kontrole aktivnosti tripsina je produkcija specifičnog i potentnog proteinskog inhibitora tripsina u pankreasu.[65] Taj inhibitor se čvrsto vezuje za tripsin, sprečavajući aktivnost tripsina koja bi inače bila štetna za organ.[66] Mada je tripsinski inhibitor protein, on izbegava da postane supstrat proteaze tako što uklanja vodu iz aktivnog mesta tripsina i time destabilizuje prelazno stanje.[67] Drugi primeri fizioloških enzimskih inhibitornih proteina su barstar koji je inhibitor bakterijske ribonukleaze barnaze[68][69][70][71] i inhibitori proteinskih fosfataza.[72]
Pesticidi i herbicidi[uredi | uredi izvor]
Mnogi pesticidi su enzimski inhibitori.[73] Acetilholinesteraza (AChE) enzim je koji je prisutan u životinjama od insekata do ljudi.[74][75] Esencijalan je za funkciju nervnih ćelija.[76] Ovaj enzim deluje tako što razlaže neurotransmiter acetilholin u njegove konstituente, acetat i holin.[77][78] Acetilholin je donekle jedinstven među neurotransmiterima u smislu da se većina njih, uključujući serotonin, dopamin, i norepinefrin, apsorbuje iz sinaptičkog otvora umesto da bude razgrađena. Veliki broj AChE inhibitora se koristi u medicini i agrikulturi.[77][78] Reverzibilni konkurentni inhibitori, kao što je edrofonijum,[79] fizostigmin i neostigmin, koriste se za tretman miastenije gravis[80][81][82] i za anesteziju.[83] Karbamatni pesticidi su takođe primeri reverzibilnih AChE inhibitora.[84] Organofosfatni pesticidi kao što su malation, paration i hlorpirifos ireverzibilno inhibiraju acetilholinesterazu.[85]
Herbicid glifosat je inhibitor 3-fosfošikimat 1-karboksiviniltransferaze.[86][87][88] Drugi herbicidi, kao što su sulfonilureje, inhibiraju enzim acetolaktatnu sintazu.[89][90] Oba ova enzima su neophodna da bi biljke pravile aminokiseline sa razgranatim bočnim lancem. Herbicidi inhibiraju mnoge druge enzime, uključujući enzime koji su neophodni za biosintezu lipida[91] i karotenoida,[92] kao i za procese fotosinteze i oksidativne fosforilacije.[93]

Prirodni otrovi[uredi | uredi izvor]
Životinje i biljke su tokom evolucije razvile sposobnost da sintetišu širok opseg otrovnih produkata uključujući sekundarne metabolite,[94] peptide i proteine koji mogu da deluju kao inhibitori. Prirodni toksini su obično mali organski molekuli i toliko su raznovrsni da su verovatno prirodni inhibitori većine metaboličkih procesa.[95][96] Metabolički procesi na koje deluju prirodni otrovi obuhvataju ne samo enzime metaboličkih puteva, nego i inhibiciju receptora, kanala i strukturnih proteinskih funkcija u ćeliji.[97] Na primer, paklitaksel (taksol),[98] organski molekul prisutan u pacifičkoj tisovini, čvrsto se vezuje za tubulinske dimere i inhibira njihovo uklapanje u mikrotubule citoskeletona.[99][100][101]
Mnogi prirodni otrovi deluju kao neurotoksini koji mogu da uzrokuju paralizu dovodeći do smrti i koriste se za odbranu od predatora ili za lov i hvatanje plena. Neki od ovih prirodnih inhibitora su, uprkos svojim toksičnim svojstvima, korisni za terapeutske svrhe pri niskim dozama.[102] Primer neurotoksina su glikoalkaloidi, iz biljnih vrsta familije Solanaceae (koja obuhvata krompir,[103] paradajz i plavi patlidžan), koji su inhibitori acetilholinesteraze. Inhibicija ovog enzima uzrokuje nekontrolisano povišenje nivoa neurotransmitera acetilholina, mišićnu paralizu i zatim smrt. Neurotoksičnost takođe može da bude posledica inhibicije receptora; na primer, atropin iz velebilja (Atropa belladonna) koji funkcioniše kao konkurentni antagonist muskariničkih acetilholinskih receptora.[104]
Iako su mnogi prirodni toksini sekundarni metaboliti, ovi otrovi obuhvataju i mnoge peptide i proteine. Primer toksičnog peptida je alfa-amanitin,[105] koji se nalazi u srodnim vrstama pečurke zelena pupavka. U pitanju je potentan enzimski inhibitor. U ovom slučaju dolazi do sprečavanja enzima RNK polimeraza II da transkribuje DNK.[106] Toksin iz algi mikrocistin je takođe peptid. On inhibira proteinske fosfataze.[107] Ovaj toksin može da kontaminira zalihe vode nakon cvetanja algi; poznati je karcinogen koji uzrokuje akutno krvarenje jetre i smrt pri većim dozama.[108]
Proteini mogu da budu budu prirodni otrovi ili antinutrijenti, kao što su tripsinski inhibitori (opisani iznad), koji su prisutni u nekim mahunama, kao što je prikazano na levoj slici iznad. Manje zastupljena klasa toksina su toksični enzimi: oni deluju kao ireverzibilni inhibitori svojih ciljnih enzima i hemijski modifikuju supstratne enzime. Primer ovakvog enzima je ricin, ekstremno potentan proteinski toksin prisutan u biljci Ricinus communis.[109][110][111] Ovaj enzim je glikozidaza[112][113] koja inaktivira ribozome. Pošto je ricin katalitički ireverzibilan inhibitor, moguć je scenario gde samo jedan molekul ricina može da ubije ćeliju.[114]
Metalni kompleksi kao inhibitori enzima[uredi | uredi izvor]
Jedan od pristupa otkrivanju lekova se sastoji od ispitivanja potencijalnih terapeutskih kompleksa za biološku aktivnost, te naknadnog bavljenja pitanjem mehanizma. Za mnoge lekove, način delovanja još uvek nije jasan, čak ni nakon mnogo godina kliničke upotrebe. U poslednjih nekoliko godina, veliki napredak u rasvetljavanju molekularnih struktura omogućio je precizno određivanje interakcija između proteina i terapijskih sredstva. Ovim je pojašnjen mehanizam mnogih agenasa i omogućeno je informisano predviđanje potencijalnih mesta vezivanja leka. Identifikacija tačne prirode interakcija leka je ključna za kontrolisanje njegove specifičnosti, a time i za smanjenje neželjenih dejstava (nuspojava).[115]
Detaljne strukturne informacije se mogu koristiti za dizajniranje molekula koji se vezuju za specifične ciljeve, a većina ovih napora je usmerena na enzime. Supstratna specifičnost enzima koja omogućava prepoznavanje pojedinačnih molekula, pruža mogućnost konstruisanja lekova sa dobro definisanim ponašanjem.[116] Smatra se da su enzimi prirodne meta neorganskih lekova,[117] pošto metali imaju ključne strukturne uloge u mnogim enzimima, na primer u cinkovim metaloenzimima.[118][119] Perturbacije endogenog metala koji je od vitalnog značaja za enzimsko dejstvo mogu da dovedu do inaktivacije enzima. Ovi poremećaji mogu da budu izazvani uticajima kao što je koordinacija egzogenih liganada za metalom, supstitucija metala, ili uklanjanje metala. Neorganski kompleksi takođe mogu da utiču na enzime koji nisu metaloenzimi. Metali se mogu koordinirati sa ostacima aktivnog mesta i time blokirati supstratnu interakciju, ili se mogu koordinirati sa ostacima izvan aktivnog mesta i time uticati na strukturni integritet. Iako je lista inhibitora enzima koji se koriste kao terapeutski agensi u velikoj meri popunjena organskim molekulima, ti agensi međudeluju sa ciljevima putem slabih veza kao što su vodonične veze i Van der Valsovi kontakti. To potencijalno može da dovede do nuspojava usled kratkog intervala zadržavanja lekova u aktivnom mestu meta, te su moguće nespecifične interakcije sa molekulima koji nisu željena meta. Koordinaciona sposobnost metala može da proizvede jače interakcije, kao što su kovalentne i jonske veze.
Primena na normalnu i abnormalnu fiziologiju[uredi | uredi izvor]
Kancer[uredi | uredi izvor]
Jedan od najznačajnijih uspeha neorganskih lekova je bila efikasnost kompleksa platine protiv raka testisa.[120][121] Taj napredak je podstakao talas istraživanja s ciljem identifikacije novih neorganskih agenasa za upotrebu u hemoterapiji, koji bi imali poboljšanu specifičnost i manje izražene toksične nuspojave. Mehanizam antineoplastičnog dejstva cisplatina i njegovih derivata je identifikovan kao direktna interakcija sa DNK, mada brojni izveštaji sugerišu da platina isto tako ima enzimske mete.[122] Inhibicija RNK polimeraze,[123] DNK polimeraze (mogućeg ometanja funkcionisanja cinkovog prsta),[124] ilealne monoaminske oksidaze (što je vezano za sporedne efekte hemoterapije: mučninu i povraćanje),[125] CTP sintaze,[126] adenilat ciklaze (u vezi sa stepenom ototoksičnosti hemoterapije)[127][128] i drugih respiratornih enzima,[129] bili su uočeni. Preinkubacija prečišćenog enzima sa kompleksima platine pokazala je da dolazi do direktne interakcije između njih, ali je u mnogim slučajevima vezivanje platine za ciljni enzim takođe doprinelo inhibiciji. Inhibicija enzima može da doprinese nekim od neželjenih toksičnih efekata lekova na bazi platine; bolje razumevanje interakcija sa tim kompleksima je potrebno da be se umanjile neželjene posledice hemoterapije.
Platinski lekovi su jedan od primera u kome je primećen terapeutski efekat leka pre nego što je otkriven mehanizam dejstva. Alternativni pristup je dizajn leka sa određenom metom na umu. Traženi su specifični ciljevi koji igraju ključne uloge u metabolizmu ćelija raka, koji su jedinstveni za ćelije kancera ili su različito izraženi u ćelijama raka. Ribonukleotidna reduktaza je jedan takav molekul koji se pokazao kao obećavajuća meta za terapiju raka.
Ribonukleotidna reduktaza obavlja ključni korak koji ograničava brzinu sinteze DNK putem kontrole proizvodnje četiri dezoksiribonukleotidna građevna bloka. Ovaj enzim redukuje 2' ugljenik riboze na difosfatnom nivou.[130] Enzim se sastoji od dve dimerne podjedinice (zvane M1 i M2 u starijim izveštajima, ili R1 i R2 u skorijim publikacijama), koje su kodirane sa dva različita gena pod zasebnom regulatornom kontrolom. Aktivnost samog enzima je zavisna od kompleksne alosterne regulacije različitim nukleotidima. R1 sadrži mesta vezivanja supstrata i regulatornih efektora, dok R2 sadrži ona binuklearnih, nehemni centar gvožđa i slobodnog tirozinskog radikala, koji su neophodni za funkcionisanje enzima. Ribonukleotidna reduktaza kontroliše ravnotežu dezoksiribonukleotide dostupnosti, a promene njene aktivnosti mogu da promene spontanu mutacionu brzinu ćelija.[130] Povećana aktivnost ribonukleotidne redutaze dovodi se u vezu sa stanjima bolesti, uključujući rak;[130][131] inhibicija ovog enzima je atraktivna meta za terapiju raka.
Izvestan napredak je napravljen u korišćenju galijum nitrata u inhibiciji ribonukleotidne reduktaze.[132][133][134] Galijum ima sličan jonski radijus kao i gvožđe i smatra se da ometa dostupnost gvožđa u R2 podjedinici. Inhibitorni efekat galijuma se povećava kada se isporučuje u kompleksu sa esencijalnim molekulom transporta gvožđa, transferinom. Ćelijske studije pokazuju da tretman sa transferin-galijumom (Tf-Ga) blokira ćelijsku apsorpciju 59Fe i inhibira proliferaciju.[133] Umanjena aktivnost ribonukleotidne reduktaze ogleda se u inhibiciji ESR signala iz tirozinskog slobodnog radikala na R2 podjedinicu ribonukleotidne reduktaze. Ovi efekti mogu biti preokrenuti izlaganjem feroamonijum sulfatu, što ukazuje da inhibicija utiče na proces zavisan od gvožđa. Ovi rezultati ne isključuju efekte na drugim putevima zavisnim od gvožđa, što takođe može da utiče na proliferaciju ćelija. Studije u sistemu bez ćelija u kojima se direktno testira aktivnost enzima pokazuju da galijum inhibira aktivnost enzima; autori pretpostavljaju da galijum formira galijum-CDP, ili galijum-ADP komplekse, čime kompetitivno inhibira interakciju supstrata sa enzimom.[134] Ni jedna od ovih studija ne daje odgovor na pitanje da li se galijum može zameniti gvožđem u R2 podjedinici i da li je tako supstituisani enzim i dalje aktivan. Galijum takođe sinergistički deluje sa brojnim drugim inhibitorima ribonukleotidne reduktaze na onemogućavanju ćelijske proliferacije. Njegovo dejstvo je antagonističko u odnosu na druge inhibitore ribonukleotidne reduktaze.[132] Ove opservacije imaju značajne posledice za kombinovanu terapiju, mada precizan mehanizam sinergizma nije poznat.
Drugi joni su takođe istraživani u pogledu uticaja na ribonukleotidne reduktaze. Poznato je da gvožđe, bakar i cink utiču na rast ćelija i regulišu komponente ciklusa transporta gvožđa. Studije o uticaju tih jona na ribonukleotidnu reduktazu u sveže izolovanim normalnim i leukemijskim ljudskim limfocitima pokazale su da cink inhibira enzim u oba tipa ćelija, dok Fe i Cu imaju stimulativne efekte.[130][131] Ovi rezultati mogu imati implikacije za modulaciju efekata inhibitora ribonukleotidne reduktaze tragovima metala.
| Primene na tretman kanceraa | |||
|---|---|---|---|
| Kompleks | Metal | Enzim | |
| transferin-Ga | joni Ga | ribonukleotidna reduktaza[133][134] | |
| karbotioamid | Fe, Cu | ribonukleotidna reduktaza[135][136] | |
| tiosemikarbazoni | Cu | ribonukleotidna reduktaza, RNK- -zavisne DNK polimeraze[137] | |
| joni | Zn | ribonukleotidna reduktaza[131] | |
| joni | Ga | ribonukleotidna reduktaza[132] | |
| antraciklin, joni | Cu | proteinska kinaza C[138] | |
| selenocistein/glutation | Se | proteinska kinaza C[139][140] | |
| metaloceni | Mo, V | proteinska kinaza C, topoizomeraza II[141] | |
| bipiridinski fenantrolin | Pt, Pd | RNK polimeraza[123] | |
| streptonigrin | Fe, Cu, Pd, Cd, Zn | topoizomeraza III, reverzna transkriptaza (putem formiranja slobodnih radikala)[142] | |
| PtCl2, cis-DDP | Pt | DNK polimeraza[124] | |
| cisplatin, bakar sulfat | Pt, Cu | ilealna monoaminska oksidaza[125] | |
| cis-DDP, K2PtCl4 | Pt | CTP sintaza[126] | |
| joni | Zn | kaspaza-3[143][144] | |
| razni | Ga | ornitinska dekarboksilaza[145] | |
| cis-DDP, tetraplatin, karboplatin | Pt | respiratorni enzimi[128] | |
| cisplatin | Pt | adenilatna ciklaza[127] | |
| tetraplatin | Pt | adenilatna ciklaza[128] | |
| vanadat, peroksovanadijum | V | proteinske tirozinske fosfataze[146][147] | |
| jon | Zn | Ser/Thr fosfoproteinska fosfataza[148] | |
| metalni helator | Cd | matrilizin[149] | |
a Napomena: U ovoj i narednim tabelama oksidaciono stanje metalnog jona nije prikazano radi jasnoće. Dodatne informacije su date u tekstu.
| |||
Za metalne komplekse karbotioamida[135][136][150] i tiosemikarbazona[137] je utvrđeno da inhibiraju ribonukleotidnu reduktazu i imaju antikancerogeno dejstvo. Utvrđeno je da metalni kompleksi α-(N)-heterocikličnih karboksialdehidnih tiosemikarbazona (α-HCAT) inhibiraju rast ćelija u većoj meri nego slobodni ligand.[136] Metalni kompleksi 2,2'-bipiridil-6-karbotioamida (BPYTA), koji su strukturno i funkcionalno slični α-HCAT, ne pokazuju tako jasno dejstvo. Studije gvožđa i bakra u kompleksu sa BPYTA su pokazale da BPYTA ima veći afinitet za bakar; bakarni kompleks pokazuje izraženije antitumorsko dejstvo od slobodnog liganda ili kompleksa gvožđa. Studije sa slobodnim ligandom međutim nisu jasne, jer je verovatno da ligand formira komplekse sa raspoloživim metalnim jonima u rastvoru. Smatra se da dozimetrija BPYTA kompleksa može da utiče na učinak. Na primer, bakarni kompleks ima najjači antiproliferativni efekat na kultivisanim mišjim leukemijskim ćelijama nakon pulsnog kontakta, dok je u slučaju kontinuiranog kontakta manje aktivan od slobodnog liganda. Osim toga, izgleda da različiti metalni kompleksi deluju različitim mehanizmima. Dok se antiproliferativni efekat kompleksa gvožđa može objasniti inhibicijom ribonukleotidne reduktaze i veruje se da zapravo uništava R2 podjedinicu, postoje indikacije da kompleks bakra takođe deluje na druge ciljeve.[150][151] Potvrđeno je da BPYTA sinergistički deluje sa inhibitorom ribonukleotidne reduktaze hidroksiurejom (HU), što sugeriše mogućnost kombinovane terapije.
Još jedna enzimska meta za agense protiv kancera je proteinska kinaza C (PKC). PKC je familija serin/treoninskih kinaza koje se aktiviraju sekundarnim glasnicima poput Ca2+ i produktima fosfolipidne hidrolize (iz kaskade inozitol trifosfata). Devet različitih članova ove porodice je do sada okarakterisano i oni učestvuju u različitim ćelijskim aktivnostima, uključujući transdukciju signala, rast ćelija/diferencijaciju i hormonsku sekreciju.[138] Oni su takođe poznati kao receptori forbolnih estara (poznatih hemijskih aktivatora), a aktiviraju se i u odgovoru na oksidativne promotere tumora.[139] Inhibicija PKC je od interesa kao način sprečavanja formiranja tumora. Nedavni dokazi ukazuju na to da je PKC regulatorni domen, koji ima dva homologna regiona sa šest očuvanih cisteina i dva konzervisana histidina, te sadrži nepremošćena Zn2+ mesta.[152] Protivtumorska sredstva koja deluju na PKC obuhvataju antracikline, čije je dejstvo posredovano koordinacijom s prelaznim metalima. Jedna studija na prečišćenom PKC je pokazala da antraciklin-Cu(II) kompleks efikasnije inhibira PKC nego pojedinačne komponente i da je taj efekat posredovan direktnom interakcijom između Cu(II) i PKC (ovaj zaključak je izveden iz EPR studija).[138] Isto tako je pokazano da antraciklini imaju različite efekte na DNK topoizomerazi II,[153] mada još uvek nema izveštaja o dejstvu kompleksa prelaznih metala sa antraciklinima u ovom vidu primene.
Pojedina jedinjenja selenijuma imaju inhibitorni efekat na PKC, a takođe imaju kancerpreventivno dejstvo.[139][140] Rezultati istraživanja sugerišu da ta jedinjenja inaktiviraju PKC putem redoks mehanizma, reagujući sa cisteinima unutar PKC katalitičkog domena.[139] U jednoj studiji je pokazano da jedinjenja selenijuma inhibiraju PKC, dok na druge testirane proteinske kinaze nemaju uticaja (na fosforilaznu kinazu i proteinsku fosfatazu 2A). Međutim, postoji mogućnost da ova jedinjenja reaguju sa drugim proteinima koji sadrže klastere cisteina.
Metaloceni su klasa antitumornih agenasa koji ne sadrže platinu i koji deluju na različit način od lekova baziranih na platini.[154][141] Pojedini metaloceni se vezuju za terminalne fosfate i/ili baze nukleotida, dok drugi ne međudeluju sa nukleotidima.[141][155][156] Iz tog razloga je predložen niz alternativnih ciljeva. Pokazano je da V(IV) i Mo(IV) jedinjenja inhibiraju PKC i topoizomerazu II.[141] Jedinjenja niobijuma (Nb) ne vezuju se za nukleotide ili aminokiseline.[155] Mehanizam dejstva ove klase zahteva dalja istraživanja.
Jedinjenja vanadijuma, koja su najbolje poznata kao insulinski mimetici, isto tako ispoljavaju antikancerne efekte. Ova jedinjenja, konkretno kompleksi vanadata i peroksovanadijuma, kompetitivni su inhibitori proteinske tirozinske fosfataze (PTP). Vanadati deluju kao analozi prelaznog stanja reverzibilnim vezivanjem za tiolnu grupu u katalitičkom domenu, dok peroksovanadijumski kompleksi oksiduju kritične cisteinske ostatke u katalitičkom domenu.[146] U serin/treoninskim fosfatazama, vanadati se vezuju za hidroksilnu grupu u aktivnom mestu, dok su peroksovanadijumski kompleksi neaktivni u odsustvu cisteina. Peroksovanadijumski kompleksi mogu da blokiraju ćelijski ciklus u fazi G2-M tranzicije (G2 = faza rasta 2, preparatorna fazi mitoze; M = mitoza, period aktivne ćelijske podele); smatra se da je to uzrokovano inhibicijom PTP, čije funkcionisanje je esencijalno za progresiju mitoze.[146][147] Moguće je da je ova blokada povezana sa njihovim citotoksičnim dejstvom. Serin/treoninske fosfataze su takođe inhibirane brojnim jonima prelazih metala d-bloka, među kojima su najefektivniji Zn2+, Hg2+, Cu2+, Yb2+ i Sc2+ (μM Ki).[148]
Brojne druge enzimske mete za antikancerne agense takođe su istraživane. Ornitinska dekarboksilaza, koja se može indukovati forbolnim estrima i koja učestvuje u ćelijskoj transformaciji, može se inhibirati jedinjenjima galijuma.[145] Transformacija je povezana sa ćelijskom tranzicijom u kancerozno stanje. Ta jedinjenja inhibiraju rast tumora i smatra se da isto tako deluju na ribonukleotidne reduktaze. Matrične metaloproteinaze učestvuju u remodelovanju ekstracelularne matrice, što je ključno za invaziju tumora i metastazu u tkivima. Ljudska matrična metaloproteinaza matrilizin je enzim cinka za koji je pokazano da se inaktivira u rastvoru kadmijuma, koji formira neaktivni Cd/Zn hibrid.[149] Matrilizin se isto tako može inhibirati agensima metalnog vezivanja, kao što je 1,10-fenantrolin, koji formira enzim-helat-metal kompleks uz naknadno uklanjanje katalitičkog jona cinka.[149]
Apoptoza, koja je postala prominentno polje istraživanja poslednjih godina, proces je „programirane” ćelijske smrti. Postoji korelacija između defekata apoptoznih procesa i brojnih bolesti, uključujući kancer. Poznato je da Zn2+ sprečava apoptozu i pokazano je da do toga dolazi putem inhibiranja kaspaze-3, apoptotičke proteaze koja učestvuje u proteolizi poli(ADP-riboza) polimeraze (PARP).[143][144] Konfliktni izveštaji ne uzimaju u obzir inhibitorno dejstvo cinka na kaspazu-3.[157] Smatra se da su nesuglasice posledica razlika u eksperimentalnim uslovima: inhibicija uočena u slučaju prečišćenog rekombinantnog proteina ali ne i kod proteina u prisustvu E. coli lizata, sugerišu postajanje faktora u lizatu koji ometaju dejstvo cinka.
Postoje brojni agensi koji deluju putem inhibicije enzima koji deluju na DNK. Ova inhibicija je često posledica vezivanja za mesto kojim enzim formira interakcije sa DNK i nije rezultat direktne inaktivacije enzima.[153][158][159][160]
Imajući u vidu prirodu interakcija enzima i supstrata, izbor enzima kao ciljeva antikancernih lekova omogućava izuzetno specifično prepoznavanje ciljeva. Razvoj sofisticiranijih tehnika modelovanja i dostupnost detaljnijih informacija o strukturama enzima doveli su do rigorozne karakterizacije interakcija leka i enzima, te razjašnjavanja mehanizma dejstva. Većina publikacija u literaturi o kanceru se bavi inhibicijom specifičnih enzima, povremeno onih koji učestvuju u metaboličkim procesima. U tim istraživanjima se koriste prečišćeni enzimi ili testovi kojima se ispituju pojedinačni enzimi od značaja. Dok je krucijalno da se odrede inhibitorne osobine na ciljnom molekulu, isto tako je neophodno da se demonstrira da jedinjenje nije aktivno na drugim enzimima. Ovaj tip studija je tegoban pošto se može testirati samo relativno mali broj reprezentativnih enzima, pa se lako može propustiti enzim koji negira specifičnost. Pažljivim razmatranjem mesta delovanja leka može da se omogući izvođenje relativno dobrih prognoza o mogućim interakcijama sa drugim enzimima. Dodatni izazov je da su enzimske mete često prisutne i u normalnim ćelijama. Dizajn efektivnih antikancernih agenasa je komplikovan proces koji ne obuhvata samo inherentna inhibitorna svojstva leka, nego i njegovu isporuku, dozimetriju i vreme zadržavanja in vivo. Metalni kompleksi prevazilaze neke od ovih izazova formiranjem jakih kovalentnih veza sa ciljnim enzimima.
Primene vezane za hem[uredi | uredi izvor]
- Hiperbilirubinemija
| Hiperbilirubinemija | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| joni | Sn | citohrom P-450, ω-hidrolaza[161] | |
| protoporfirin (PP) | Sn, Zn | 11β-hidroksilaza, 21R-hidroksilaza, citohrom P-450, hem oksigenaza[162][163][164] | |
| mezoporfirin (MP) | Sn | hem oksigenaza (tanko crevo)[165] | |
| deuteroporfirin 2,4-bisglikol (BG) | Zn | hem oksigenaza (pacov)[166] | |
| MP | Zn | hem oksigenaza (pacov)[167] | |
| MP | Co | hem oksigenaza slezine (moždane membrane pacova)[168] | |
| PP, BG, MP | Cr | hem oksigenaza (pacov)[169] | |
| razni porfirini | Zn, Sn, Cu | γ-aminolevulinatna sintaza (ćelije jetre kokošjeg embriona), hem oksigenaza 56 | |
| razni porfirini | Zn, Sn, Cr, Mg | hem oksigenaza (epitel tankog creva)[170] | |
| mezoporfirin | Sn | klinička supresija hiperbilirubinemije[171][172] | |


Inhibitor enzima je molekul koji se vezuje za enzim i umanjuje njegovu aktivnost. Pošto blokiranje enzimske aktivnosti može da uzrokuje uginuće patogena ili da koriguje metaboličku neuravnoteženost, stoga su mnogi lekovi inhibitori enzima. Inhibitori enzima se takođe koriste kao pesticidi. Nisu svi molekuli koji se vezuju za enzime inhibitori; aktivatori enzima se vezuju za enzime i povećavaju njihovu aktivnost, dok se enzimski supstrati vezuju i bivaju konvertovani do produkata u normalnom katalitičkom ciklusu enzima.
Vezivanje inhibitora može da spreči pristup supstrata enzimskom aktivnom mestu i/ili omete enzim pri katalizi biohemijske reakcije. Vezivanje inhibitora može da bude reverzibilno ili ireverzibilno. Ireverzibilni inhibitori obično reaguju sa enzimom i hemijski ga menjaju (npr. formiranjem kovalentne veze), te modifikuju ključne aminokiselinske ostatke neophodne za enzimatsku aktivnost. Nasuprot ovome, reverzibilni inhibitori se vezuju nekovalentno, te se različiti tipovi inhibicije javljaju zavisno od toga da li se inhibitori vezuju za enzim, za enzimsko-supstratni kompleks, ili za oboje.[1]
Mnogi molekuli lekova su inhibitori enzima, tako da je njihovo otkrivanje i poboljšanje aktivna oblast istraživanja u biohemiji i farmakologiji. Medicinski enzimski inhibitori se često vrednuju po svojoj specifičnosti (svom odsustvu vezivanja za druge proteine) i svojoj potentnosti (svojoj konstanti disocijacije, koja je indikator koncentracije neophodne za inhibiciju enzima). Visoka specifičnost i potentnost su preduslovi da lek ispoljava mali broj nuspojava i stoga nisku toksičnost.
Enzimski inhibitori se isto tako javljaju u prirodi i učestvuju u regulaciji metabolizma. Na primer, enzimi u metaboličkom putu mogu da budu inhibirani produktima daljih koraka puta. Ovaj tip povratne sprege usporava ćelijsku proizvodnu liniju kad produkti počnu da se nakupljaju, i to je jedan od važnih načina održavanja homeostaze u ćelijama. Drugi ćelijski enzimski inhibitori su proteini, koji se specifično vezuju za i inhibiraju enzimsku metu. To može da pomogne u kontroli enzima, koji bi inače mogli da oštete ćeliju, kao što su proteaze ili nukleaze. Jedna detaljno okarakterisana klasa inhibitornih molekula su ribonukleazni inhibitori, koji se vezuju za ribonukleaze formirajući jednu od najčvršćih poznatih protein—protein interakcija.[2] Prirodni enzimski inhibitori takođe mogu da budu otrovi i da se koriste kao vid odbrane od predatora, ili kao način ubijanja plena.
Reverzibilni inhibitori[uredi | uredi izvor]
Tipovi reverzibilnih inhibitora[uredi | uredi izvor]
Reverzibilni inhibitori se vezuju za enzime putem nekovalentnih interakcija kao što su vodonične veze, hidrofobne interakcije i jonske veze. Višestruke slabe veze između inhibitora i aktivnog mesta se kombinuju i proizvode jako i specifično vezivanje. Za razliku od supstrata i ireverzibilnih inhibitora, reverzibilni inhibitori generalno ne podležu hemijskim reakcijama pri vezivanju za enzim i mogu lako da se uklone razblaživanjem ili dijalizom.
Postoje četiri vrste reverzibilnih enzimskih inhibitora. Klasifikuju se na osnovu uticaja promenljive koncentracije enzimskog supstrata na inhibitor.[3]

- U konkurentnoj inhibiciji, supstrat i inhibitor ne mogu istovremeno da se vežu za enzim, kao što je to prikazano na slici desno. To je obično posledica toga da inhibitor ima afinitet za aktivno mesto enzima za koje se takođe vezuje supstrat; supstrat i inhibitor se nadmeću za pristup aktivnom mestu enzima. Ovaj tip inhibicije se može prevazići primenom dovoljno visokih koncentracija supstrata (Vmax ostaje konstantno), od. putem nadmašivanja koncentracije inhibitora. Međutim, dolazi do povećanja pojavne vrednosti Km, jer je potrebna veća koncentracija supstrata da bi se dosegla tačka Km, ili polovina vrednosti Vmax.[4] Konkurentni inhibitori su obično strukturno slični realnom supstratu (vidi primere ispod).
- U nekonkurentnoj inhibiciji, inhibitor se jedino vezuje za supstratno-enzimski kompleks. Ovaj tip inhibicije uzrokuje sniženje vrednosti Vmax (maksimalna brzina se smanjuje usled uklanjanja aktiviranog kompleksa) i vrednosti Km (usled povećane efikasnosti vezivanja koja proizilazi iz Le Šateljeovog principa i efektivne eliminacije ES kompleksa čime se umanjuje Km, što je indikator povećanog afiniteta vezivanja).[4]
- U beskonkurentnoj inhibiciji, vezivanjem inhibitora za enzim redukuje se njegova aktivnost, mada to nema uticaja na vezivanje supstrata. Rezultat ovoga je da stepen inhibicije jedino zavisi od koncentracije inhibitora. Vrednost Vmax se smanjuje, jer se reakcija odvija manje efikasno, dok se vrednost Km ne menja, pošto se samo vezivanje supstrata — po definiciji — i dalje normalno odvija.[4]
- U mešovitoj inhibiciji, inhibitor se može vezati za enzim istovremeno sa supstratom enzima. Međutim, ovakvo vezivanje inhibitora utiče na vezivanje supstrata, i obrnuto. Ova vrsta inhibicije se može umanjiti, ali ne i prevazići povećanjem koncentracije supstrata. Mada postoji mogućnost da se inhibitori mešovitog tipa vežu na aktivnom mestu, ovaj tip inhibicije generalno proizilazi iz alosternog dejstva, pri čemu se inhibitor vezuje na različitom mestu na enzimu. Vezivanje inhibitora za alosterno mesto menja konformaciju (tj. tercijarnu strukturu ili trodimenzionalni oblik) enzima, tako da je afinitet supstrata za aktivno mesto umanjen.[4]
Kvantitativni opis reverzibilne inhibicije[uredi | uredi izvor]
Reverzibilna inhibicija se može kvantitativno opisati u pogledu vezivanja inhibitora za enzim i za enzimsko-supstratni kompleks, kao i njegovog uticaja na kinetičke konstante enzima. U klasičnoj Mihaelis—Menteninoj šemi ispod, enzim (E) vezuje se za svoj supstrat (S) i formira enzimsko-supstratni kompleks ES. Nakon katalize, ovaj kompleks se razlaže i oslobađaju se produkt P i slobodni enzim. Inhibitor (I) može se vezati ili za E ili za ES sa konstantama disocijacije Ki ili Ki′, redom.
Kada enzim ima višestruke supstrate, inhibitori mogu da ispolje različite tipove inhibicije u zavisnosti od toga koji se supstrat posmatra. Do ovoga dolazi zato što aktivno mesto sadrži dva različita mesta vezivanja, po jedno za svaki supstrat. Na primer, inhibitor se može nadmetati sa supstratom A za prvo mesto vezivanja, a biti beskonkurentni inhibitor supstrata B u drugom mestu vezivanja.[5]
Merenje konstanti disocijacije reverzibilnog inhibitora[uredi | uredi izvor]
Kao što je napomenuto iznad, enzimski inhibitor se opisuje putem svojih dveju konstanti disocijacije: Ki i Ki′, za enzim i enzimsko-supstratni kompleksa, redom. Enzimsko-inhibitorska konstanta Ki se može direktno meriti različitim metodima. Jedan od izuzetno preciznih metoda je izotermalna titraciona kalorimetrija, u kojoj se inhibitor titrira u rastvor enzima; potom se meri oslobođena ili apsorbovana toplota.[6] Međutim, drugu konstantu disocijacije Ki′ je teško direktno meriti, pošto je enzimsko-supstratni kompleks kratkotrajan i podleže hemijskoj reakciji kojom se formira produkt. Stoga se Ki′ obično indirektno meri, i to putem posmatranja enzimske aktivnosti pri različitim koncentracijama supstrata i inhibitora, te postavljanjem podataka[7] u modifikovanu Mihaelis—Menteninu jednačinu.
gde su modifikujući faktori α i α′ definisani putem koncentracije inhibitora i njegovih dveju konstanti disocijacije:

Stoga, u prisustvu inhibitora, enzimske efektivne vrednosti Km i Vmax postaju (α/α′)Km i (1/α′)Vmax, redom. Treba imati u vidu da modifikovana Mihaelis—Mentenina jednačina podrazumeva da je ostvarena ravnoteža vezivanja inhibitora za enzim, što može da bude veoma spor proces za inhibitore sa podnanomolarnim konstantama disocijacije. U tim slučajevima, obično je praktičnije da se tretira čvrsto vezujući inhibitor kao ireverzibilni inhibitor (vidi ispod); mada, još uvek može da postoji opcija kinetičkog procenjivanja Ki′, ako se nezavisno izmeri Ki.
Uticaji različitih tipova reverzibilnih inhibitora enzima na enzimatsku aktivnost se mogu prikazati koristeći grafičke reprezentacije Mihaelis—Mentenine jednačine, kao što su Lajnviver—Berkov i Edi—Hofstijev dijagram. Na primer, na Lajnviver—Berkovom dijagramu prikazanom desno, linije konkurentne inhibicije seku se na y-osi, što ilustruje da takvi inhibitori nemaju uticaja na Vmax. Analogno, linije beskonkurentne inhibicije seku se na x-osi, što pokazuje da ovi inhibitori ne utiču na Km. Međutim, često je teško precizno proceniti Ki i Ki′ sa dijagrama,[8] pa se preporučuje korišćenje pouzdanijih metoda nelinearne regresije za procenu konstanti (opisano iznad).
Reverzibilni inhibitori[uredi | uredi izvor]
Tradicionalno se reverzibilni inhibitori enzima klasifikuju kao konkurentni, nekonkurentni ili beskonkurentni, na osnovu njihovog uticaja na parametre Km i Vmax. Ti različiti uticaji direktno proizilaze iz načina vezivanja inhibitora za enzim E, enzimsko-supstratni kompleks ES, ili oba. Podela u ove klase proističe iz problema sa određivanjem parametara i stvara potrebu za korišćenjem različitih konstanti vezivanja za opisivanje čina vezivanja. Vezivanje inhibitora i njegov uticaj na enzimatsku aktivnost su dve potpuno različite svari, što je još jedan problem koji tradicionalne jednačine ne odražavaju. Kod nekonkurentne inhibicije vezivanje inhibitora sledstveno jednačinama jedino dovodi do potpune (100%) inhibicije enzima, i jednačine ne ostavljaju mogućnost postojanja bilo čega između tih krajnosti.[9] Zajednički oblik inhibitornog člana takođe zamagljuje odnos između vezivanja inhibitora za enzim i njegovog odnosa sa drugim članovima vezivanja, bilo da je to Mihaelis—Mentenina jednačina ili dozno-responsna kriva asocirana sa vezivanjem liganda za receptor. Da bi se demonstrirao odnos, može se stvoriti sledeće preraspoređivanje:
Dodajući nulu na dno ([I]−[I]):
... i deleći sa [I]+Ki dobija se:
Ova jednačina demonstrira da je slično Mihaelis—Menteninoj jednačini, gde brzina reakcije zavisi od procenta enzimske populacije koja međudeluje sa supstratom:
razlomak enzimske populacije vezane supstratom
razlomak enzimske populacije vezane inhibitorom
... uticaj inhibitora rezultat procenta populacije enzima koja međudeluje sa inhibitorom. Jedini problem sa ovom jednačinom u njenoj trenutnoj formi je što podrazumeva apsolutnu inhibiciju enzima vezivanjem inhibitora, dok se u stvarnosti može javiti širok opseg uticaja: od 100% inhibicije supstrata do samo izvesnog procenta, > 0%. Da bi se ovo uzelo u obzir, jednačina se može jednostavno modifikovati uvođenjem člana delta Vmax, tako da dozvoljava različite stepene inhibicije:
... ili:
Ovaj član može onda da definiše rezidualni procenat enzimatske aktivnosti kad inhibitor interaguje sa individualnim enzimima u populaciji. Uvrštavanje ovog člana ima dodatnu prednost dozvoljavanja mogućnosti aktivacije ako se ispostavi da je sekundarni član Vmax veći od inicijalnog člana. Da bi se u obzir takođe uzela mogućnost aktivacije, jednačina se može prilagoditi zamenjivanjem inhibitorske oznake „I” opštom oznakom odnosno modifikatorskim članom koji je ovde označen sa „X”:
Dok ova terminologija dovodi do pojednostavljenog načina rukovanja kinetičkim efektima vezanim za maksimalnu brzinu Mihaelis—Mentenine jednačine, ona isto tako naglašava potencijalne probleme sa članovima koji se koriste za opisivanje efekata vezanih za Km. Vrednost Km vezana za afinitet enzima za supstrat je u većini slučaja povezana sa mogućim promenama mesta vezivanja enzima, što je direktna posledica interakcije enzima i inhibitora. Stoga je član sličan gorenavedenom članu za korekciju Vmax podesan u većini slučajeva:[10][11]
Specijalni slučajevi[uredi | uredi izvor]
- Mehanizam parcijalno konkurentne inhibicije je sličan onom beskonkurentne, izuzev što EIS kompleks ima katalitičku aktivnost, koja može da bude niža ili čak viša (parcijalno kompetitivna aktivacija) od aktivnosti enzimsko-supstratnog (ES) kompleksa. Ova inhibicija tipično ispoljava nižu vrednost Vmax, dok se vrednost Km ne menja.[5][12]
- Nekonkurentna inhibicija se javlja kada se inhibitor vezuje samo za enzimsko-supstratni kompleks, ne i za slobodni enzim; kompleks EIS je katalitički neaktivan. Ovaj način inhibicije je redak i uzrokuje smanjivanje obeju vrednosti, i Vmax i Km.[5]
- Inhibicija supstrata i produkata se javlja kad bilo supstrat ili produkt enzimatske reakcije inhibira enzimsku aktivnost. Ovaj oblik inhibicije može da sledi kompetitivne, nekompetitivne ili mešovite obrasce. Pri supstratnoj inhibiciji dolazi do progresivnog smanjenja aktivnosti pri visokim koncentracijama supstrata. To može da bude indikacija postojanja dva mesta vezivanja supstrata na enzimu. Pri niskim koncentracijama supstrata, mesto visokog afiniteta je okupirano i normalna kinetika dolazi do izražaja. Međutim, pri višim koncentracijama dolazi do zauzeća sekundarnog, inhibitornog mesta, čime se inhibira enzim.[13] Produkt inhibicije često služi kao regulatorno svojstvo pri metabolizmu i može da formira negativnu povratnu spregu.[14]
- Spora nepropusna inhibicija se javlja kad inicijalni kompleks enzima i inhibitora (EI) podleže izomerizaciji do drugog, čvršće pakovanog (nepropusnog) kompleksa, EI*, iako je sveukupni proces inhibicije reverzibilan.[15] Ovo se manifestuje kao sporo rastuća inhibicija enzima. Pod ovim uslovima, tradicionalna Mihaelis—Mentenina kinetika daje pogrešnu vrednost za Ki, jer je ona zavisna od vremena. Tačna vrednost Ki se može dobiti putem kompleksnije analize konstanti brzina asocijacije (kon) i disocijacije (koff) inhibitora. Dodatne informacije su dostupne u odeljku o ireverzibilnoj inhibiciji.
Primeri reverzibilnih inhibitora[uredi | uredi izvor]

Enzimi su evoluciono razvili sposobnost čvrstog vezivanja svojih supstrata; kako se većina reverzibilnih inhibitora vezuje za aktivno mesto enzima, nije iznenađujuće da neki od tih inhibitora imaju veoma slične strukture sa supstratima svoje mete. Jedan od primera oponašanja supstrata su proteazni inhibitori. Oni su veoma uspešna klasa antiretroviralnih lekova koji se koriste za lečenje infekcije HIV.[16] Struktura ritonavira, proteaznog inhibitora koji je baziran na peptidu i koji sadrži tri peptidne veze, prikazana je sa desne strane. Ovaj lek nalikuje na protein koji je supstrat HIV proteaze; nadmeće sa ovim supstratom za pristup aktivnom mestu enzima.
Enzimski inhibitori se često dizajniraju tako da oponašaju prelazno stanje ili intermedijer enzimski katalizovane reakcije. Time se osigurava da inhibitor iskoristi stabilizujući efekat prelaznog stanja enzima, što dovodi do poboljšanog afiniteta vezivanja (niže Ki vrednosti) nego što je to slučaj sa dizajnima zasnovanim na supstratu. Primer ovakvog inhibitora prelaznog stanja je antiviralni lek oseltamivir; ovaj lek oponaša planarnu strukturu prstena oksonijumskog jona u reakciji viralnog enzima neuraminidaze.[17]

Međutim, nisu svi inhibitori bazirani na strukturama supstrata. Na primer, struktura drugog inhibitora HIV proteaze tipranavira prikazana je na levoj strani. Ovaj molekul nije zasnovan na peptidu i nije očiglednu strukturnu sličnost sa proteinskim supstratom. Ovi nepeptidni inhibitori mogu da budu stabilniji od inhibitora koji sadrže peptidne veze, pošto oni ne mogu da budu supstrati peptidaza i mnogo manje su skloni degradaciji.[18]
Pri dizajnu lekova je važno da se uzmu u obzir koncentracije supstrata kojima su izloženi ciljni enzimi. Na primer, neki inhibitori proteinskih kinaza imaju hemijske strukture koje su slične adenozin-trifosfatu, jednom od supstrata pomenutih enzima. Međutim, lekovi koji su jednostavni kompetitivni inhibitori će morati da se nadmeću sa visokim koncentracijama ATP molekula u ćeliji. Proteinske kinaze se isto tako mogu inhibirati konkurisanjem za mesta vezivanja na kojima kinaze međudeluju sa svojim supstratnim proteinima, a većina proteina je prisutna u ćelijama sa daleko nižim koncentracijama od koncentracije ATP molekula. Posledično, ako se dva inhibitora proteinske kinaze vezuju za aktivna mesta sa sličnim afinitetom — a samo jedan od njih treba da se nadmeće sa ATP molekulima, onda će kompetitivni inhibitor na mestu proteinskog vezivanja efektivnije inhibirati enzim.[19]
Ireverzibilni inhibitori[uredi | uredi izvor]
Tipovi ireverzibilne inhibicije (kovalentna inaktivacija)[uredi | uredi izvor]

Ireverzibilni inhibitori obično kovalentno modifikuju enzim, te inhibicija stoga ne može da bude povratna. Ireverzibilni inhibitori često sadrže reaktivne funkcionalne grupe, kao što su azotni iperiti, aldehidi, haloalkani, alkeni, Majklovi akceptori, fenil sulfonati ili fluorofosfonati. Te elektrofilne grupe reaguju sa aminokiselinskim bočnim lancima i formiraju kovalentne dodatke. Modifikovani ostaci su oni sa bočnim lancima koji sadrže nukleofile kao što su hidroksilne ili sulfhidrilne grupe; tu se ubrajaju aminokiseline serin (npr. DFP molekuli, prikazano na desnoj strani), cistein, treonin ili tirozin.[20]
Ireverzibilna inhibicija se razlikuje od ireverzibilne enzimske inaktivacije. Ireverzibilni inhibitori su generalno specifični za jednu klasu enzima i ne inaktiviraju sve proteine; ne funkcionišu uništavajući proteinske strukture nego specifičnim izmenjivanjem aktivnog mesta svoje mete. Na primer, ekstremi vrednosti pH ili temperature obično uzrokuju denaturaciju svih proteinskih struktura, što je nespecifičan efekat. Pojedini nespecifični hemijski tretmani analogno uništavaju proteinsku strukturu: na primer, zagrevanje u koncentrovanoj hlorovodoničnoj kiselini će hidrolizovati peptidne veze koje proteine drže na okupu, oslobađajući ovime slobodne aminokiseline.[21]
Ireverzibilni inhibitori ispoljavaju vremenski zavisnu inhibiciju i njihova potentnost se stoga ne može okarakterisati pomoću IC50 vrednosti. Razlog za ovo je što se količina aktivnog enzima pri datoj koncentraciji ireverzibilnog inhibitora razlikuje u zavisnosti od toga koliko dugo je inhibitor bio preinkubiran sa enzimom. Zbog ovoga, umesto IC50 koriste se kobs/[I] vrednosti,[22] gde je kobs uočena brzina inaktivacije pseudoprvog reda (izvedena is grafika zavisnosti logaritamske vrednosti postotne aktivnosti od vremena) a [I] koncentracija inhibitora. Parameter kobs/[I] je validan dokle god se inhibitor ne zasiti vezivanjem za enzim (u kom slučaju je kobs = kinact).
Analiza ireverzibilne inhibicije[uredi | uredi izvor]

Kao što je prikazano na šemi levo, ireverzibilni inhibitori formiraju reverzibilni nekovalentni kompleks sa enzimom (EI ili ESI), i zatim dolazi do reakcije kojom se formira kovalentno modifikovani neaktivni kompleks EI*. Brzina kojom se EI* formira se naziva brzinom inaktivacije, ili kinact. Pošto formiranje EI može da se nadmeće sa ES, vezivanje ireverzibilnih inhibitora se može sprečiti konkurencijom bilo sa supstratom ili sa drugim, reverzibilnim inhibitorom. Ovaj protekcioni efekat je dobra potvrda specifičnosti reakcije ireverzibilnog inhibitora sa aktivnim mestom.
Koraci vezivanja i inaktivacije ove reakcije se ispituju putem inkubacije enzima sa inhibitorom i utvrđivanjem stepena aktivnosti koja preostaje tokom vremena. Aktivnost će opadati na vremenski zavisan način, obično sledeći eksponencijalni raspad. Uklapanjem ovih podataka u jednačinu brzine dobija se brzina inaktivacije pri datoj koncentraciji inhibitora. Ovo se radi za nekoliko različitih koncentracija inhibitora. Ako dolazi do formiranja reverzibilnog EI kompleksa, biće uočljivo zasićenje brzine inaktivacije i iz odgovarajuće krive biće moguće izvesti kinact i Ki.[23]
Drugi metod koji je u širokoj upotrebi u ovim analizama je masena spektrometrija. Ovde precizno merenje mase nemodifikovanog prirodnog enzima i inaktiviranog enzima daje povećanje mase uzrokovano reakcijom sa inhibitorom i pokazuje stehiometriju reakcije.[24] To se obično radi koristeći MALDI-TOF maseni spektrometar. U komplementarnoj tehnici zvanoj peptidni maseni otisci prstiju vrši se razlaganje prirodnog i modifikovanog proteina dejstvom proteaze, kao što je tripsin. Time nastaje set peptida koji se mogu analizirati koristeći maseni spektrometar. Peptidi koji promene masu nakon reakcije sa inhibitorom su oni koji sadrže mesto modifikacije.
Specijalni slučajevi[uredi | uredi izvor]

Ne formiraju svi ireverzibilni inhibitori kovalentne dodatke na svojim enzimskim metama. Neki reverzibilni inhibitori se tako čvrsto vežu za svoje ciljne enzime da su u suštini ireverzibilni. Ovi potentno vezujući inhibitori mogu da ispolje kinetiku sličnu kovalentnim ireverzibilnim inhibitorima. Neki od ovih inhibitora se brzo vezuju za enzim u EI kompleksu niskog afiniteta i zatim dolazi do sporog preraspoređivanja do veoma čvrsto vezanog EI* kompleksa (pogledajte levu sliku iznad). Ovakvo kinetičko ponašanje se naziva sporim vezivanjem.[26] Spori rearanžman nakon vezivanja često obuhvata konformacionu promenu pri čemu se enzim obavije oko molekula inhibitora. Primeri sporo vezujućih inhibitora su neki važni lekovi, kao što je metotreksat,[27] alopurinol[28] i aktivirani oblik aciklovira.[29]
Primeri ireverzibilnih inhibitora[uredi | uredi izvor]

Diizopropilfluorofosfat (DFP) prikazan je kao primer ireverzibilnog proteaznog inhibitora na desnoj slici iznad. Enzim hidrolizuje fosforno-fluornu vezu, ali fosfatni ostatak ostaje vezan za serin u aktivnom mestu, čime se enzim deaktivira.[30] Slično ovome, DFP takođe reaguje sa aktivnim mestom acetilholinske esteraze u sinapsama neurona; posledično je potentan neurotoksin, sa smrtnom dozom manjom od 100 mg.[31]
Samoubilačka inhibicija je neobični tip ireverzibilne inhibicije gde enzim konvertuje inhibitor u reaktivnu formu u svom aktivnom mestu. Primer takvog jedinjenja je inhibitor poliaminske biosinteze, α-difluorometilornitin ili DFMO, koji je analogan aminokiselini ornitin i koristi se za lečenje afričke tripanosomijaze (bolest spavanja). Ornitinska dekarboksilaza može da katalizuje dekarboksilaciju DFMO umesto ornitina, kao što je prikazano iznad. Međutim, ovoj reakciji dekarboksilacije sledi eliminacija atoma fluora, čime se ovaj katalitički intermedijer konvertuje u konjugovani imin, koji je veoma elektrofilno jedinjenje. Ova reaktivna forma DFMO molekula zatim reaguje ili sa cisteinom ili sa lizinom u aktivnom mestu, da bi se enzim ireverzibilno inaktivirao.[25]
Pošto ireverzibilna obično obuhvata prvobitno formiranje nekovalentnog EI kompleksa, ponekad je moguće da se inhibitor veže za enzim na više od jednog načina. Na primer, na slici levo na kojoj je prikazana tripanotionska reduktaza iz ljudskog protozoanskog parazita Trypanosoma cruzi, dva molekula inhibitora zvanog kvinakrinski iperit vezana su u aktivnom mestu ovog enzima. Gornji molekul je reverzibilno vezan, dok je donji vezan kovalentno pošto je reagovao sa aminokiselinskim ostatkom putem azotnoiperitne grupe.[32]
Otkriće i dizajn inhibitora[uredi | uredi izvor]

Novi lekovi su produkti dugotrajnog procesa razvoja lekova. Prvi korak u tom procesu je često otkriće novog enzimskog inhibitora. U prošlosti je jedini način da se otkriju novi inhibitori bio pristup pokušaja i greške: testiranje ogromnih kolekcija jedinjenja na ciljnom enzimu u nadi da će se doći korisnih molekula. Ovaj pristup grube sile je još uvek uspešan i bio je unapređen primenom pristupa kombinatorne hemije kojima se omogućava brza proizvodnja ogromnog broja novih jedinjenja, kao i tehnologijom visokopropusnog skrininga da bi se brzo testirale ogromne hemijske kolekcije (biblioteke) s ciljem nalaženja inhibitora.[33]
Jedan od skorašnjih alternativnih pristupa je racionalni dizajn lekova, pri čemu se koristi trodimenzionalna struktura aktivnog mesta enzima da bi se predvidelo koji molekuli bi mogli da budu inhibitori.[34] Ta predviđanja se zatim testiraju. Novi inhibitori se nakon toga koriste za dobijanje strukture enzima u kompleksu inhibitor/enzim, da bi se potvrdilo na koji način su molekuli vezani za aktivno mesto. Na bazi struktura je moguće dizajnirati izmenjene inhibitore s ciljem dalje optimizacije vezivanja. Ovaj ciklus testiranja i poboljšanja se zatim ponavlja dok se ne dođe do dovoljno potentnih inhibitora.[35] Niz pristupa baziranih na primeni računara za predviđanje afiniteta inhibitora za enzim takođe je u razvoju. Primeri ovakvih metoda su molekularni doking[36] i molekulska mehanika.[37][38]
Upotrebe inhibitora[uredi | uredi izvor]
Enzimski inhibitori se mogu naći u prirodi. Osim njih postoji i znatan broj inhibitora koji su dizajnirani i proizvode se za farmakološke svrhe i biohemijska istraživanja. Prirodni otrovi su često enzimski inhibitori koji su evoluirali da štite biljke ili životinje od predatora. Ti prirodni toksini obuhvataju neke od najsmrtonosnijih otrova. Veštački inhibitori se često koriste kao lekovi, mada isto tako mogu da budu i insekticidi kao što je malation, herbicidi kao što je glifosat, ili dezinfektanti kao što je triklosan. Deo veštačkih enzimskih inhibitora blokira acetilholinesterazu, enzim koji razlaže acetilholin; koriste se kao nervni agensi u bojnim otrovima.
Hemioterapija[uredi | uredi izvor]
 |
 |
 |
Enzimski inhibitori se najčešće koriste kao lekovi za tretman bolesti. Mnogi od njih deluju na ljudske enzime s ciljem korigovanja patološkog stanja. Međutim, nisu svi lekovi enzimski inhibitori. Neki, kao što su antiepileptički lekovi, menjaju aktivnost enzima uzrokujući da se enzim proizvodi u manjoj ili većoj količini. Ovi efekti se nazivaju enzimska indukcija i inhibicija[42] i predstavljaju promene u izražavanju gena. To nije direkno povezano sa tipom enzimske inhibicije o kojem se ovde govori. Drugi lekovi međudeluju sa ćelijskim metama koje nisu enzimi, kao što su jonski kanali ili membranski receptori.
Primer medicinskog enzimskog inhibitora je sildenafil (vijagra), popularni lek za mušku erektilnu disfunkciju. Ovo jedinjenje je potentni inhibitor cGMP specifične fosfodiesteraze tipa 5, enzima koji degradira signalni molekul ciklični guanozin monofosfat.[43] Ovaj signalni molekul podstiče relaksaciju glatkih mišića i omogućava protok krvi u corpus cavernosum, što uzrokuje erekciju. Pošto lek umanjuje aktivnost enzima koji zaustavlja signal, produžava se trajanje signala.
Još jedan primer strukturne sličnosti pojedinih inhibitora sa supstratima enzima na koje deluju je prikazan na slici desno na kojoj se poredi lek metotreksat sa folnom kiselinom (vitamin B9). Folna kiselina je supstrat dihidrofolatne reduktaze, enzima koji učestvuje u formiranju nukleotida i koji biva potentno inhibiran metotreksatom. Metotreksat blokira dejstvo dihidrofolatne reduktaze i time zaustavlja produkciju nukleotida. Ova blokada nukleotidne biosinteze je toksičnija za brzorastuće ćelije nego za one koje se ne dele, zato što brzorastuće ćelije moraju da izvode replikaciju DNK. Stoga se metotreksat obično koristi za hemoterapiju kancera.[44]
Antibiotici[uredi | uredi izvor]
Lekovi se isto tako koriste za inhibiranje enzima neophodnih za opstanak patogena.[45][46] Na primer, bakterije su okružene debelim ćelijskim zidom sačinjenim iz polimera koji nalikuje na mrežu i zove se peptidoglikan. Mnogi antibiotici, kao što su penicilin i vankomicin, inhibiraju enzime koji proizvode i potom umrežavaju niti tog polimera.[47] Posledica njihovog dejstva je da bakterijski ćelijski zid gubi jačinu i bakterije se rasprsnu.[48] Na slici, molekul penicilina (prikazan u formi „kugli i štapića”) vezan je za svoj ciljni enzim, transpeptidazu iz bakterije Streptomyces R61 (protein je prikazan kao trakasti dijagram).[49]
Antibiotički dizajn lekova je olakšan kad je enzim koji je esencijalan za opstanak patogena odsutan ili veoma različit kod ljudi.[50] U primeru iznad, ljudsko telo ne pravi peptidoglikan, i stoga su inhibitori tog procesa selektivno toksični za bakterije. Selektivna toksičnost se takođe ostvaruje kod antibiotika kroz iskorišćavanje razlika u strukturi ribozoma kod bakterija,[51] ili načina na koji prave masne kiseline.[52]
Metabolička kontrola[uredi | uredi izvor]
Enzimski inhibitori su važni u metaboličkoj kontroli.[53] Mnogi ćelijski metabolički putevi su inhibirani metabolitima, koji kontrolišu enzimsku aktivnost putem alosterne regulacije ili inhibicije supstrata. Dobar primer je alosterna regulacija glikolitičkog puta.[54] Ovaj katabolički put konzumira glukozu i proizvodi ATP, NADH i piruvat.[55][56] Ključni korak u regulaciji glikolize je jedna rana reakcija puta koja je katalizovana fosfofruktokinazom-1 (PFK1).[57][58] Kad se ATP nivo povisi, ATP se vezuje za alosterno mesto na PFK1 čime se smanjuje brzina enzimske reakcije; glikoliza se inhibira i opada produkcija ATP. Ovaj oblik kontrole negativnom povratnom spregom pomaže u održavanju stabilnog nivoa koncentracije ATP molekula u ćeliji.[59] Međutim, metabolički putevi se ne regulišu samo inhibicijom, već je aktivacija enzima jednako važna. U odnosu na PFK1, fruktoza 2,6-bisfosfat i ADP predstavljaju primere metabolita koji deluju kao alosterini aktivatori.[60]
Fiziološka enzimska inhibicija se takođe može proizvesti putem specifičnih proteinskih inhibitora. Ovaj mehanizam se javlja u pankreasu, koji sintetiše mnoštvo digestivnih prekursorskih enzima, poznatih kao zimogeni.[61][62] Mnogi od njih se aktiviraju dejstvom proteaze tripsin,[63] tako da je važno da se inhibira aktivnost tripsina u pankreasu da bi se sprečila mogućnost da organ počne da probavlja sam sebe.[64] Jedan način kontrole aktivnosti tripsina je produkcija specifičnog i potentnog proteinskog inhibitora tripsina u pankreasu.[65] Taj inhibitor se čvrsto vezuje za tripsin, sprečavajući aktivnost tripsina koja bi inače bila štetna za organ.[66] Mada je tripsinski inhibitor protein, on izbegava da postane supstrat proteaze tako što uklanja vodu iz aktivnog mesta tripsina i time destabilizuje prelazno stanje.[67] Drugi primeri fizioloških enzimskih inhibitornih proteina su barstar koji je inhibitor bakterijske ribonukleaze barnaze[68][69][70][71] i inhibitori proteinskih fosfataza.[72]
Pesticidi i herbicidi[uredi | uredi izvor]
Mnogi pesticidi su enzimski inhibitori.[73] Acetilholinesteraza (AChE) enzim je koji je prisutan u životinjama od insekata do ljudi.[74][75] Esencijalan je za funkciju nervnih ćelija.[76] Ovaj enzim deluje tako što razlaže neurotransmiter acetilholin u njegove konstituente, acetat i holin.[77][78] Acetilholin je donekle jedinstven među neurotransmiterima u smislu da se većina njih, uključujući serotonin, dopamin, i norepinefrin, apsorbuje iz sinaptičkog otvora umesto da bude razgrađena. Veliki broj AChE inhibitora se koristi u medicini i agrikulturi.[77][78] Reverzibilni konkurentni inhibitori, kao što je edrofonijum,[79] fizostigmin i neostigmin, koriste se za tretman miastenije gravis[80][81][82] i za anesteziju.[83] Karbamatni pesticidi su takođe primeri reverzibilnih AChE inhibitora.[84] Organofosfatni pesticidi kao što su malation, paration i hlorpirifos ireverzibilno inhibiraju acetilholinesterazu.[85]
Herbicid glifosat je inhibitor 3-fosfošikimat 1-karboksiviniltransferaze.[86][87][88] Drugi herbicidi, kao što su sulfonilureje, inhibiraju enzim acetolaktatnu sintazu.[89][90] Oba ova enzima su neophodna da bi biljke pravile aminokiseline sa razgranatim bočnim lancem. Herbicidi inhibiraju mnoge druge enzime, uključujući enzime koji su neophodni za biosintezu lipida[91] i karotenoida,[92] kao i za procese fotosinteze i oksidativne fosforilacije.[93]

Prirodni otrovi[uredi | uredi izvor]
Životinje i biljke su tokom evolucije razvile sposobnost da sintetišu širok opseg otrovnih produkata uključujući sekundarne metabolite,[94] peptide i proteine koji mogu da deluju kao inhibitori. Prirodni toksini su obično mali organski molekuli i toliko su raznovrsni da su verovatno prirodni inhibitori većine metaboličkih procesa.[95][96] Metabolički procesi na koje deluju prirodni otrovi obuhvataju ne samo enzime metaboličkih puteva, nego i inhibiciju receptora, kanala i strukturnih proteinskih funkcija u ćeliji.[97] Na primer, paklitaksel (taksol),[98] organski molekul prisutan u pacifičkoj tisovini, čvrsto se vezuje za tubulinske dimere i inhibira njihovo uklapanje u mikrotubule citoskeletona.[99][100][101]
Mnogi prirodni otrovi deluju kao neurotoksini koji mogu da uzrokuju paralizu dovodeći do smrti i koriste se za odbranu od predatora ili za lov i hvatanje plena. Neki od ovih prirodnih inhibitora su, uprkos svojim toksičnim svojstvima, korisni za terapeutske svrhe pri niskim dozama.[102] Primer neurotoksina su glikoalkaloidi, iz biljnih vrsta familije Solanaceae (koja obuhvata krompir,[103] paradajz i plavi patlidžan), koji su inhibitori acetilholinesteraze. Inhibicija ovog enzima uzrokuje nekontrolisano povišenje nivoa neurotransmitera acetilholina, mišićnu paralizu i zatim smrt. Neurotoksičnost takođe može da bude posledica inhibicije receptora; na primer, atropin iz velebilja (Atropa belladonna) koji funkcioniše kao konkurentni antagonist muskariničkih acetilholinskih receptora.[104]
Iako su mnogi prirodni toksini sekundarni metaboliti, ovi otrovi obuhvataju i mnoge peptide i proteine. Primer toksičnog peptida je alfa-amanitin,[105] koji se nalazi u srodnim vrstama pečurke zelena pupavka. U pitanju je potentan enzimski inhibitor. U ovom slučaju dolazi do sprečavanja enzima RNK polimeraza II da transkribuje DNK.[106] Toksin iz algi mikrocistin je takođe peptid. On inhibira proteinske fosfataze.[107] Ovaj toksin može da kontaminira zalihe vode nakon cvetanja algi; poznati je karcinogen koji uzrokuje akutno krvarenje jetre i smrt pri većim dozama.[108]
Proteini mogu da budu budu prirodni otrovi ili antinutrijenti, kao što su tripsinski inhibitori (opisani iznad), koji su prisutni u nekim mahunama, kao što je prikazano na levoj slici iznad. Manje zastupljena klasa toksina su toksični enzimi: oni deluju kao ireverzibilni inhibitori svojih ciljnih enzima i hemijski modifikuju supstratne enzime. Primer ovakvog enzima je ricin, ekstremno potentan proteinski toksin prisutan u biljci Ricinus communis.[109][110][111] Ovaj enzim je glikozidaza[112][113] koja inaktivira ribozome. Pošto je ricin katalitički ireverzibilan inhibitor, moguć je scenario gde samo jedan molekul ricina može da ubije ćeliju.[114]
Metalni kompleksi kao inhibitori enzima[uredi | uredi izvor]
Jedan od pristupa otkrivanju lekova se sastoji od ispitivanja potencijalnih terapeutskih kompleksa za biološku aktivnost, te naknadnog bavljenja pitanjem mehanizma. Za mnoge lekove, način delovanja još uvek nije jasan, čak ni nakon mnogo godina kliničke upotrebe. U poslednjih nekoliko godina, veliki napredak u rasvetljavanju molekularnih struktura omogućio je precizno određivanje interakcija između proteina i terapijskih sredstva. Ovim je pojašnjen mehanizam mnogih agenasa i omogućeno je informisano predviđanje potencijalnih mesta vezivanja leka. Identifikacija tačne prirode interakcija leka je ključna za kontrolisanje njegove specifičnosti, a time i za smanjenje neželjenih dejstava (nuspojava).[115]
Detaljne strukturne informacije se mogu koristiti za dizajniranje molekula koji se vezuju za specifične ciljeve, a većina ovih napora je usmerena na enzime. Supstratna specifičnost enzima koja omogućava prepoznavanje pojedinačnih molekula, pruža mogućnost konstruisanja lekova sa dobro definisanim ponašanjem.[116] Smatra se da su enzimi prirodne meta neorganskih lekova,[117] pošto metali imaju ključne strukturne uloge u mnogim enzimima, na primer u cinkovim metaloenzimima.[118][119] Perturbacije endogenog metala koji je od vitalnog značaja za enzimsko dejstvo mogu da dovedu do inaktivacije enzima. Ovi poremećaji mogu da budu izazvani uticajima kao što je koordinacija egzogenih liganada za metalom, supstitucija metala, ili uklanjanje metala. Neorganski kompleksi takođe mogu da utiču na enzime koji nisu metaloenzimi. Metali se mogu koordinirati sa ostacima aktivnog mesta i time blokirati supstratnu interakciju, ili se mogu koordinirati sa ostacima izvan aktivnog mesta i time uticati na strukturni integritet. Iako je lista inhibitora enzima koji se koriste kao terapeutski agensi u velikoj meri popunjena organskim molekulima, ti agensi međudeluju sa ciljevima putem slabih veza kao što su vodonične veze i Van der Valsovi kontakti. To potencijalno može da dovede do nuspojava usled kratkog intervala zadržavanja lekova u aktivnom mestu meta, te su moguće nespecifične interakcije sa molekulima koji nisu željena meta. Koordinaciona sposobnost metala može da proizvede jače interakcije, kao što su kovalentne i jonske veze.
Primena na normalnu i abnormalnu fiziologiju[uredi | uredi izvor]
Kancer[uredi | uredi izvor]
Jedan od najznačajnijih uspeha neorganskih lekova je bila efikasnost kompleksa platine protiv raka testisa.[120][121] Taj napredak je podstakao talas istraživanja s ciljem identifikacije novih neorganskih agenasa za upotrebu u hemoterapiji, koji bi imali poboljšanu specifičnost i manje izražene toksične nuspojave. Mehanizam antineoplastičnog dejstva cisplatina i njegovih derivata je identifikovan kao direktna interakcija sa DNK, mada brojni izveštaji sugerišu da platina isto tako ima enzimske mete.[122] Inhibicija RNK polimeraze,[123] DNK polimeraze (mogućeg ometanja funkcionisanja cinkovog prsta),[124] ilealne monoaminske oksidaze (što je vezano za sporedne efekte hemoterapije: mučninu i povraćanje),[125] CTP sintaze,[126] adenilat ciklaze (u vezi sa stepenom ototoksičnosti hemoterapije)[127][128] i drugih respiratornih enzima,[129] bili su uočeni. Preinkubacija prečišćenog enzima sa kompleksima platine pokazala je da dolazi do direktne interakcije između njih, ali je u mnogim slučajevima vezivanje platine za ciljni enzim takođe doprinelo inhibiciji. Inhibicija enzima može da doprinese nekim od neželjenih toksičnih efekata lekova na bazi platine; bolje razumevanje interakcija sa tim kompleksima je potrebno da be se umanjile neželjene posledice hemoterapije.
Platinski lekovi su jedan od primera u kome je primećen terapeutski efekat leka pre nego što je otkriven mehanizam dejstva. Alternativni pristup je dizajn leka sa određenom metom na umu. Traženi su specifični ciljevi koji igraju ključne uloge u metabolizmu ćelija raka, koji su jedinstveni za ćelije kancera ili su različito izraženi u ćelijama raka. Ribonukleotidna reduktaza je jedan takav molekul koji se pokazao kao obećavajuća meta za terapiju raka.
Ribonukleotidna reduktaza obavlja ključni korak koji ograničava brzinu sinteze DNK putem kontrole proizvodnje četiri dezoksiribonukleotidna građevna bloka. Ovaj enzim redukuje 2' ugljenik riboze na difosfatnom nivou.[130] Enzim se sastoji od dve dimerne podjedinice (zvane M1 i M2 u starijim izveštajima, ili R1 i R2 u skorijim publikacijama), koje su kodirane sa dva različita gena pod zasebnom regulatornom kontrolom. Aktivnost samog enzima je zavisna od kompleksne alosterne regulacije različitim nukleotidima. R1 sadrži mesta vezivanja supstrata i regulatornih efektora, dok R2 sadrži ona binuklearnih, nehemni centar gvožđa i slobodnog tirozinskog radikala, koji su neophodni za funkcionisanje enzima. Ribonukleotidna reduktaza kontroliše ravnotežu dezoksiribonukleotide dostupnosti, a promene njene aktivnosti mogu da promene spontanu mutacionu brzinu ćelija.[130] Povećana aktivnost ribonukleotidne redutaze dovodi se u vezu sa stanjima bolesti, uključujući rak;[130][131] inhibicija ovog enzima je atraktivna meta za terapiju raka.
Izvestan napredak je napravljen u korišćenju galijum nitrata u inhibiciji ribonukleotidne reduktaze.[132][133][134] Galijum ima sličan jonski radijus kao i gvožđe i smatra se da ometa dostupnost gvožđa u R2 podjedinici. Inhibitorni efekat galijuma se povećava kada se isporučuje u kompleksu sa esencijalnim molekulom transporta gvožđa, transferinom. Ćelijske studije pokazuju da tretman sa transferin-galijumom (Tf-Ga) blokira ćelijsku apsorpciju 59Fe i inhibira proliferaciju.[133] Umanjena aktivnost ribonukleotidne reduktaze ogleda se u inhibiciji ESR signala iz tirozinskog slobodnog radikala na R2 podjedinicu ribonukleotidne reduktaze. Ovi efekti mogu biti preokrenuti izlaganjem feroamonijum sulfatu, što ukazuje da inhibicija utiče na proces zavisan od gvožđa. Ovi rezultati ne isključuju efekte na drugim putevima zavisnim od gvožđa, što takođe može da utiče na proliferaciju ćelija. Studije u sistemu bez ćelija u kojima se direktno testira aktivnost enzima pokazuju da galijum inhibira aktivnost enzima; autori pretpostavljaju da galijum formira galijum-CDP, ili galijum-ADP komplekse, čime kompetitivno inhibira interakciju supstrata sa enzimom.[134] Ni jedna od ovih studija ne daje odgovor na pitanje da li se galijum može zameniti gvožđem u R2 podjedinici i da li je tako supstituisani enzim i dalje aktivan. Galijum takođe sinergistički deluje sa brojnim drugim inhibitorima ribonukleotidne reduktaze na onemogućavanju ćelijske proliferacije. Njegovo dejstvo je antagonističko u odnosu na druge inhibitore ribonukleotidne reduktaze.[132] Ove opservacije imaju značajne posledice za kombinovanu terapiju, mada precizan mehanizam sinergizma nije poznat.
Drugi joni su takođe istraživani u pogledu uticaja na ribonukleotidne reduktaze. Poznato je da gvožđe, bakar i cink utiču na rast ćelija i regulišu komponente ciklusa transporta gvožđa. Studije o uticaju tih jona na ribonukleotidnu reduktazu u sveže izolovanim normalnim i leukemijskim ljudskim limfocitima pokazale su da cink inhibira enzim u oba tipa ćelija, dok Fe i Cu imaju stimulativne efekte.[130][131] Ovi rezultati mogu imati implikacije za modulaciju efekata inhibitora ribonukleotidne reduktaze tragovima metala.
| Primene na tretman kanceraa | |||
|---|---|---|---|
| Kompleks | Metal | Enzim | |
| transferin-Ga | joni Ga | ribonukleotidna reduktaza[133][134] | |
| karbotioamid | Fe, Cu | ribonukleotidna reduktaza[135][136] | |
| tiosemikarbazoni | Cu | ribonukleotidna reduktaza, RNK- -zavisne DNK polimeraze[137] | |
| joni | Zn | ribonukleotidna reduktaza[131] | |
| joni | Ga | ribonukleotidna reduktaza[132] | |
| antraciklin, joni | Cu | proteinska kinaza C[138] | |
| selenocistein/glutation | Se | proteinska kinaza C[139][140] | |
| metaloceni | Mo, V | proteinska kinaza C, topoizomeraza II[141] | |
| bipiridinski fenantrolin | Pt, Pd | RNK polimeraza[123] | |
| streptonigrin | Fe, Cu, Pd, Cd, Zn | topoizomeraza III, reverzna transkriptaza (putem formiranja slobodnih radikala)[142] | |
| PtCl2, cis-DDP | Pt | DNK polimeraza[124] | |
| cisplatin, bakar sulfat | Pt, Cu | ilealna monoaminska oksidaza[125] | |
| cis-DDP, K2PtCl4 | Pt | CTP sintaza[126] | |
| joni | Zn | kaspaza-3[143][144] | |
| razni | Ga | ornitinska dekarboksilaza[145] | |
| cis-DDP, tetraplatin, karboplatin | Pt | respiratorni enzimi[128] | |
| cisplatin | Pt | adenilatna ciklaza[127] | |
| tetraplatin | Pt | adenilatna ciklaza[128] | |
| vanadat, peroksovanadijum | V | proteinske tirozinske fosfataze[146][147] | |
| jon | Zn | Ser/Thr fosfoproteinska fosfataza[148] | |
| metalni helator | Cd | matrilizin[149] | |
a Napomena: U ovoj i narednim tabelama oksidaciono stanje metalnog jona nije prikazano radi jasnoće. Dodatne informacije su date u tekstu.
| |||
Za metalne komplekse karbotioamida[135][136][150] i tiosemikarbazona[137] je utvrđeno da inhibiraju ribonukleotidnu reduktazu i imaju antikancerogeno dejstvo. Utvrđeno je da metalni kompleksi α-(N)-heterocikličnih karboksialdehidnih tiosemikarbazona (α-HCAT) inhibiraju rast ćelija u većoj meri nego slobodni ligand.[136] Metalni kompleksi 2,2'-bipiridil-6-karbotioamida (BPYTA), koji su strukturno i funkcionalno slični α-HCAT, ne pokazuju tako jasno dejstvo. Studije gvožđa i bakra u kompleksu sa BPYTA su pokazale da BPYTA ima veći afinitet za bakar; bakarni kompleks pokazuje izraženije antitumorsko dejstvo od slobodnog liganda ili kompleksa gvožđa. Studije sa slobodnim ligandom međutim nisu jasne, jer je verovatno da ligand formira komplekse sa raspoloživim metalnim jonima u rastvoru. Smatra se da dozimetrija BPYTA kompleksa može da utiče na učinak. Na primer, bakarni kompleks ima najjači antiproliferativni efekat na kultivisanim mišjim leukemijskim ćelijama nakon pulsnog kontakta, dok je u slučaju kontinuiranog kontakta manje aktivan od slobodnog liganda. Osim toga, izgleda da različiti metalni kompleksi deluju različitim mehanizmima. Dok se antiproliferativni efekat kompleksa gvožđa može objasniti inhibicijom ribonukleotidne reduktaze i veruje se da zapravo uništava R2 podjedinicu, postoje indikacije da kompleks bakra takođe deluje na druge ciljeve.[150][151] Potvrđeno je da BPYTA sinergistički deluje sa inhibitorom ribonukleotidne reduktaze hidroksiurejom (HU), što sugeriše mogućnost kombinovane terapije.
Još jedna enzimska meta za agense protiv kancera je proteinska kinaza C (PKC). PKC je familija serin/treoninskih kinaza koje se aktiviraju sekundarnim glasnicima poput Ca2+ i produktima fosfolipidne hidrolize (iz kaskade inozitol trifosfata). Devet različitih članova ove porodice je do sada okarakterisano i oni učestvuju u različitim ćelijskim aktivnostima, uključujući transdukciju signala, rast ćelija/diferencijaciju i hormonsku sekreciju.[138] Oni su takođe poznati kao receptori forbolnih estara (poznatih hemijskih aktivatora), a aktiviraju se i u odgovoru na oksidativne promotere tumora.[139] Inhibicija PKC je od interesa kao način sprečavanja formiranja tumora. Nedavni dokazi ukazuju na to da je PKC regulatorni domen, koji ima dva homologna regiona sa šest očuvanih cisteina i dva konzervisana histidina, te sadrži nepremošćena Zn2+ mesta.[152] Protivtumorska sredstva koja deluju na PKC obuhvataju antracikline, čije je dejstvo posredovano koordinacijom s prelaznim metalima. Jedna studija na prečišćenom PKC je pokazala da antraciklin-Cu(II) kompleks efikasnije inhibira PKC nego pojedinačne komponente i da je taj efekat posredovan direktnom interakcijom između Cu(II) i PKC (ovaj zaključak je izveden iz EPR studija).[138] Isto tako je pokazano da antraciklini imaju različite efekte na DNK topoizomerazi II,[153] mada još uvek nema izveštaja o dejstvu kompleksa prelaznih metala sa antraciklinima u ovom vidu primene.
Pojedina jedinjenja selenijuma imaju inhibitorni efekat na PKC, a takođe imaju kancerpreventivno dejstvo.[139][140] Rezultati istraživanja sugerišu da ta jedinjenja inaktiviraju PKC putem redoks mehanizma, reagujući sa cisteinima unutar PKC katalitičkog domena.[139] U jednoj studiji je pokazano da jedinjenja selenijuma inhibiraju PKC, dok na druge testirane proteinske kinaze nemaju uticaja (na fosforilaznu kinazu i proteinsku fosfatazu 2A). Međutim, postoji mogućnost da ova jedinjenja reaguju sa drugim proteinima koji sadrže klastere cisteina.
Metaloceni su klasa antitumornih agenasa koji ne sadrže platinu i koji deluju na različit način od lekova baziranih na platini.[154][141] Pojedini metaloceni se vezuju za terminalne fosfate i/ili baze nukleotida, dok drugi ne međudeluju sa nukleotidima.[141][155][156] Iz tog razloga je predložen niz alternativnih ciljeva. Pokazano je da V(IV) i Mo(IV) jedinjenja inhibiraju PKC i topoizomerazu II.[141] Jedinjenja niobijuma (Nb) ne vezuju se za nukleotide ili aminokiseline.[155] Mehanizam dejstva ove klase zahteva dalja istraživanja.
Jedinjenja vanadijuma, koja su najbolje poznata kao insulinski mimetici, isto tako ispoljavaju antikancerne efekte. Ova jedinjenja, konkretno kompleksi vanadata i peroksovanadijuma, kompetitivni su inhibitori proteinske tirozinske fosfataze (PTP). Vanadati deluju kao analozi prelaznog stanja reverzibilnim vezivanjem za tiolnu grupu u katalitičkom domenu, dok peroksovanadijumski kompleksi oksiduju kritične cisteinske ostatke u katalitičkom domenu.[146] U serin/treoninskim fosfatazama, vanadati se vezuju za hidroksilnu grupu u aktivnom mestu, dok su peroksovanadijumski kompleksi neaktivni u odsustvu cisteina. Peroksovanadijumski kompleksi mogu da blokiraju ćelijski ciklus u fazi G2-M tranzicije (G2 = faza rasta 2, preparatorna fazi mitoze; M = mitoza, period aktivne ćelijske podele); smatra se da je to uzrokovano inhibicijom PTP, čije funkcionisanje je esencijalno za progresiju mitoze.[146][147] Moguće je da je ova blokada povezana sa njihovim citotoksičnim dejstvom. Serin/treoninske fosfataze su takođe inhibirane brojnim jonima prelazih metala d-bloka, među kojima su najefektivniji Zn2+, Hg2+, Cu2+, Yb2+ i Sc2+ (μM Ki).[148]
Brojne druge enzimske mete za antikancerne agense takođe su istraživane. Ornitinska dekarboksilaza, koja se može indukovati forbolnim estrima i koja učestvuje u ćelijskoj transformaciji, može se inhibirati jedinjenjima galijuma.[145] Transformacija je povezana sa ćelijskom tranzicijom u kancerozno stanje. Ta jedinjenja inhibiraju rast tumora i smatra se da isto tako deluju na ribonukleotidne reduktaze. Matrične metaloproteinaze učestvuju u remodelovanju ekstracelularne matrice, što je ključno za invaziju tumora i metastazu u tkivima. Ljudska matrična metaloproteinaza matrilizin je enzim cinka za koji je pokazano da se inaktivira u rastvoru kadmijuma, koji formira neaktivni Cd/Zn hibrid.[149] Matrilizin se isto tako može inhibirati agensima metalnog vezivanja, kao što je 1,10-fenantrolin, koji formira enzim-helat-metal kompleks uz naknadno uklanjanje katalitičkog jona cinka.[149]
Apoptoza, koja je postala prominentno polje istraživanja poslednjih godina, proces je „programirane” ćelijske smrti. Postoji korelacija između defekata apoptoznih procesa i brojnih bolesti, uključujući kancer. Poznato je da Zn2+ sprečava apoptozu i pokazano je da do toga dolazi putem inhibiranja kaspaze-3, apoptotičke proteaze koja učestvuje u proteolizi poli(ADP-riboza) polimeraze (PARP).[143][144] Konfliktni izveštaji ne uzimaju u obzir inhibitorno dejstvo cinka na kaspazu-3.[157] Smatra se da su nesuglasice posledica razlika u eksperimentalnim uslovima: inhibicija uočena u slučaju prečišćenog rekombinantnog proteina ali ne i kod proteina u prisustvu E. coli lizata, sugerišu postajanje faktora u lizatu koji ometaju dejstvo cinka.
Postoje brojni agensi koji deluju putem inhibicije enzima koji deluju na DNK. Ova inhibicija je često posledica vezivanja za mesto kojim enzim formira interakcije sa DNK i nije rezultat direktne inaktivacije enzima.[153][158][159][160]
Imajući u vidu prirodu interakcija enzima i supstrata, izbor enzima kao ciljeva antikancernih lekova omogućava izuzetno specifično prepoznavanje ciljeva. Razvoj sofisticiranijih tehnika modelovanja i dostupnost detaljnijih informacija o strukturama enzima doveli su do rigorozne karakterizacije interakcija leka i enzima, te razjašnjavanja mehanizma dejstva. Većina publikacija u literaturi o kanceru se bavi inhibicijom specifičnih enzima, povremeno onih koji učestvuju u metaboličkim procesima. U tim istraživanjima se koriste prečišćeni enzimi ili testovi kojima se ispituju pojedinačni enzimi od značaja. Dok je krucijalno da se odrede inhibitorne osobine na ciljnom molekulu, isto tako je neophodno da se demonstrira da jedinjenje nije aktivno na drugim enzimima. Ovaj tip studija je tegoban pošto se može testirati samo relativno mali broj reprezentativnih enzima, pa se lako može propustiti enzim koji negira specifičnost. Pažljivim razmatranjem mesta delovanja leka može da se omogući izvođenje relativno dobrih prognoza o mogućim interakcijama sa drugim enzimima. Dodatni izazov je da su enzimske mete često prisutne i u normalnim ćelijama. Dizajn efektivnih antikancernih agenasa je komplikovan proces koji ne obuhvata samo inherentna inhibitorna svojstva leka, nego i njegovu isporuku, dozimetriju i vreme zadržavanja in vivo. Metalni kompleksi prevazilaze neke od ovih izazova formiranjem jakih kovalentnih veza sa ciljnim enzimima.
Primene vezane za hem[uredi | uredi izvor]
- Hiperbilirubinemija
| Hiperbilirubinemija | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| joni | Sn | citohrom P-450, ω-hidrolaza[161] | |
| protoporfirin (PP) | Sn, Zn | 11β-hidroksilaza, 21R-hidroksilaza, citohrom P-450, hem oksigenaza[162][163][164] | |
| mezoporfirin (MP) | Sn | hem oksigenaza (tanko crevo)[165] | |
| deuteroporfirin 2,4-bisglikol (BG) | Zn | hem oksigenaza (pacov)[166] | |
| MP | Zn | hem oksigenaza (pacov)[167] | |
| MP | Co | hem oksigenaza slezine (moždane membrane pacova)[168] | |
| PP, BG, MP | Cr | hem oksigenaza (pacov)[169] | |
| razni porfirini | Zn, Sn, Cu | γ-aminolevulinatna sintaza (ćelije jetre kokošjeg embriona), hem oksigenaza 56 | |
| razni porfirini | Zn, Sn, Cr, Mg | hem oksigenaza (epitel tankog creva)[170] | |
| mezoporfirin | Sn | klinička supresija hiperbilirubinemije[171][172] | |

Hiperbilirubinemija je oboljenje koje uzrokuje prekomernu akumulaciju bilirubina u krvi i tkivima.[173] Bilirubin je produkt katabolizma hema, pri čemu se hem degradira posredstvom hem oksigenaze (HO) i formira se biliverdin, koji se zatim redukuje pomoću biliverdin reduktaze do bilirubina.[174] Nakon konjugacije sa glukuronskom kiselinom, pomoću enzima bilirubin glukuronid transferaza, i formiranja rastvorljivijeg konjugata, bilirubin se izlučuje. Prekomerno razlaganje hema i nedovoljna aktivnost transferaze mogu da dovedu do akumulacije bilirubina. Ovo nakupljanje je poznato kao neonatalna žutica kod beba sa nedovoljno razvijenom jetrom i prevremeno rođene dece, koja brzo razgrađuju hem (pri prelazu sa fetalnog na regularni hemoglobin) ali im nedostaju adekvatne transferaze. Hiperbilirubinemija se takođe javlja kod genetičkog Krigler—Najarovog sindroma, gde dolazi do kompletnog odsustva transferaznog dejstva u jetri[171] i drugih bolesti kao što su talasemija i kongenitalne anemije.[174] Inhibicija razlaganja hema u hem oksigenaznom koraku je mogući način sprečavanja hiperbilirubinemije.
Metaloporfirini su ekstenzivno izučavani i dobro poznati inhibitori hem oksigenaze. Ovi inhibitori se vezuju za katalitičko mesto, ali nisu efektivni supstrati. Znatan broj metaloporfirina ima inhibitorno dejstvo, a ima i onih koji indukuju hem oksigenazu. Najznačajniji inhibitori hem oksigenaze su kalajni i cinkovi porfirini. Neki od ovih porfirina su našli kliničku primenu u suzbijanju produkcije bilirubina.[171][172] Nedavna istraživanja su razjasnila prirodu inhibicije, uticaj na druge biohemijske puteve, kao i opseg biodistribucije lekova.
Studije cinkovih i kalajnih protoporfirina indiciraju da je kalajni protoporfirin (Sn-PP) isto tako efektivan inhibitor adrenalne steroidogeneze, dok cinkov protoporfirin (Zn-PP) nema uticaja na taj put.[162][163] Sinteza steroida je posredovana brojnim hemoproteinima, citohromima P-450, te postoji kompleksna međuzavisnost između puta sinteze hema i steroidogeneze. Koncentracija citohroma je vezana za promene u sintezi i degradaciji hema. U testovima, koristeći modele na pacovima, utvrđeno je da Sn-PP znatno redukuje aktivnost steroidnih biosintetičkih enzima mitohondrijske 11β-hidroksilaze i mikrozomalne 21R-hidroksilaze; takođe je uočeno smanjenje sadržaja mikrozomalnog citohroma P-450.[162][163] U pomenutoj studiji je isto tako zapaženo drastično smanjenje sadržaja HO-2, neinducibilnog izozima hem oksigenaze koji je daleko prevalentniji od inducibilnog HO-1, te se pretpostavlja da Sn-PP zapravo uništava HO-2 umesto da ga inhibira. Zn-PP, nasuprot ovoga, inhibira aktivnost HO ali nema uticaja na enzime steroidne biosinteze.[162][163]
Dalja istraživanje poređenjem dejstva Zn-PP i Sn-PP sa HO-1 i HO-2 pokazala su da su oba jednako inhibitorna za HO-1 bez uticaja na integritet proteina (što je utvrđeno vestern blot analizom), kao i da indukuju povišenje nivoa HO-1 transkripije. Međutim, Sn-PP i Zn-PP se razlikuju u pogledu svoje aktivnosti spram HO-2.[164] Mada oba inhibiraju HO-2, razlikuju se u stepenu inhibicije. Stepen inhibicije Zn-PP je isti za obe forme HO, dok Sn-PP ispoljava znatniju inhibiciju HO-2 nego HO-1. Smatra se da Sn-PP poremećuje integritet HO-2 proteina (vestern blot), dok Zn-PP nema taj efekat. Mehanizam koji uzrokuje razlike aktivnosti Sn-PP i Zn-PP na HO formama nije poznat.
Utvrđeno je da razni porfirini inhibiraju intestinalnu hem oksigenazu i umanjuju preuzimanje gvožđa iz creva, dovodeći do povećanog izlučivanja ovog metala. To može da bude korisno u tretmanu slučajeva hemohromatoze.[170][165] Ovaj efekat je uočen kod svih parenteralno administriranih porfirina, ali su samo Sn-MP, Sn-PP i Cr-MP bili oralno efektivni (na intestinalnoj HO; nisu nađeni na renalnim, splinskim ili hepatičim tkivima). Pokazano je da je Zn-MP efektivan u tretmanu akutne porfirije (poremećaja izazvanog deficijencijom hema), a studije distribucije u tkivu su pokazale da brzo biva uklonjen iz plazme i da se prvenstveno zadržava u jetri i slezini, gde inhibira HO tokom perioda od skoro nedelju dana nakon jedne injekcije.[167] Zn-MP ne prolazi kroz krvno-moždanu barijeru, za razliku od Sn-PP za koji je pokazano da štetno utiče na HO-2 integritet i aktivnost u mozgu pacova.[175] Metaloporfirini deluju kao pojačivači fotosenzitivnosti s varirajućim stepenima[176] (oni se takođe koriste u fotodinamičkoj terapiji). Poznato je da Zn-PP u manjoj meri podstiče fotosenzitivnost od Sn-PP, što je još jedno svojstvo koje sugeriše da su cinkove forme inhibitora verovatno podesnije za kliničku primenu.[166]
Co-MP i Cr-MP takođe efektivno inhibiraju HO.[168][169] Utvrđeno je da Co-MP ne posreduje lipidnu peroksidaciju u moždanim membranama pacova nakon fotoiradijacije (što je pokazano koristeći malondialdehidni test); stoga, on ne podstiče fotosenzitivnost.[168] Cr-MP efektivno inhibira hepatičku HO nakon oralne administracije, dok na splinsku HO nema uticaja.[169] Pokazano je da Zn-MP inhibira hepatičku 5-aminolevulinatnu sintazu (ALAS), enzim koji ograničava brzinu puta biosinteze hema. Ovaj efekat se uvećava kad se hem doda sa porfirinom.[177] Poznato je da gvožđe i hem povratno regulišu ALAS putem inhibiranja mRNK transkripcije/transporta.[178] Uočeno je da je ALAS translacija pod kontrolom elemenata resposivnih na gvožđe.[179]
Upotreba metaloporfirina za tretman hiperbilirubinemije je uznapredovala dalje u procesu razvoja lekova u odnosu na antikancerne agense opisane u prethodnom odeljku. Ovi porfirini imaju poznat biološki cilj, hem oksigenazu, te je njihova klinička efektivnost već pokazana. Međutim, njihova glavna biološka meta je deo kompleksnog puta, koji je u velikoj meri povezan sa drugim procesima, kao što je steroidna sinteza. Neophodno je praćenje tih drugih procesa da bi se sprečili neželjeni uticaji na njih.
- Transdukcija azot-monoksidnog signala
| Transdukcija azot-monoksidnog signala | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| PP | Zn | rastvorna guanilatna ciklaza (prečišćena)[180] | |
| PP, BG | Zn, Sn | rastvorna guanilatna ciklaza (pacovi)[181] | |
| natrijum nitroprusid (SNP) | Fe | azot-monoksid sintaza (neutrofili pacova)[182] | |
| SNP | Fe | NOS (cerebralni kortikalni sinaptozomi)[183] | |
| joni | Cu, Zn, Co, Ni, Fe | NOS (prečišćena)[184] | |
| jon | Zn | NOS (prečišćeni nNOS)[185] | |
| SNP | Fe | ekto-5'-nukleotidaza (renalno epitelijalna)[186] | |
| SNP | Fe | indolamin 2,3-dioksigenaza (mononuklearni fagociti)[187] | |
| SNP | Fe | metionin sintaza[188] | |
| SNP | Fe | (Na+/K+)-ATPaza[189] | |
Azot-monoksid (NO) igra ulogu glasnika u mnoštvu sistema. U imunskom sistemu, NO posreduje respons belih krvnih zrnaca na patogene; u kardiovaskularnom sistemu, NO indukuje relaksaciju ćelija glatkih mišića u krvnim sudovima; i u nervnom sistemu, NO učestvuje u neurotransmisiji i neuromodulaciji.[190][188][191] NO se formira iz L-arginina posredstvom azot-monoksidne sintaze (NOS), hem proteina koji se javlja u više izoformi i za čije dejstvo je neophodan NADPH kao donor elektrona. Postoje tri NOS izoforme: konstitutivne izoforme prisutne u mozgu (nNOS, tip I) i endotelnim ćelijama (eNOS, tip III) za čije dejstvo je neophodan kalcijum/kalmodulin, i citokinom indukovane forme (iNOS, tip II) za čije dejstvo nije neophodan kalcijum ali koje imaju kalmodulin kao čvrsto vezanu podjedinicu.[192] Obe klase se javljaju u obliku homodimera pri čemu svaka podjedinica sadrži 1 ekvivalent FAD, FMN, (6R)-5,6,7,8-tetrahidro-L-biopterina (H4B) i protoporfirin IX hema.[184][193] Postoji duga lista NOS inhibitora koja obuhvata selenoorganska jedinjenja (koja se vezuju za tiolne grupe), Zn porfirine, te cink (vezuje se za hem mesta).[193] U kaskadi prenosa signala, poznato je da NO stimuliše guanilatnu ciklazu i da indukuje akumulaciju sekundarnog glasnika, cAMP. Mnogi aspekti NO signalizacije su ispitani studiranjem ramifikacija uvođenja NO donora u sistem ili putem NOS inhibiranja NOS čime se obustavlja NO produkcija.
NO je našao široku primenu kao ligand u gvožđe-hemnim kompleksima u neorganskoj hemiji, i stoga se nameće pitanje da li NO može da bude autoregulisan NOS inhibicijom (hemni je protein).[192] Studije sa NO donorom, natrijum nitroprusidom (SNP), Na2Fe(CN)5NO•2H2O, pokazuju da NO može da inhibira NOS.[182][182] U studijama sa neutrofilima pacova, lipopolisaharid se koristi za indukovanje aktivnosti NOS i ova indukcija se inhibira pomoću SNP.[182] SNP ispitivanja koristeći kortikalne sinaptozome pacova su ukazala na postojanje koncentraciono zavisne NOS inhibicije NOS aktivnosti.[182] U ovim studijama se NOS aktivnost određuje praćenjem formiranja [3H]citrulina iz [3H]arginina.[194] Poznato je da prelazni metali inhibiraju NOS,[184] kao i da prečišćeni Cu2+, Ni2+, Zn2+ i Co2+ deluju kao inhibitori inducibilnog NOS enzima, dok nehemno gvožđe povećava katalitičku aktivnost. Za Cu2+ jon je utvrđeno da inhibira prečišćeni neuronalni NOS (drugi metali nisu testirani na nNOS). Iz ovih nalaza proizilazi da nehemno gvožđe NOS enzima učestvuje u katalizi, te da NOS verovatno sadrži aktivno mesto za nehemno gvožđe/H4B.
Zn2+ reverzibilno inhibira aktivnost nNOS (Ki = 30 μM).[185] Uočena je inhibicija NADPH-zavisne redukcije gvožđa hema i od kalmodulina (CaM)-zavisna redukcija citohroma c. Nije uočena inhibicija CaM-nezavisne reduktaze citohrom c reduktaze (mereno relativnim brojem katalitičkih ciklusa citohroma c). Međutim, čak i u odsustvu Zn2+, CaM-nezavisni put ima više nego deset puta slabiju aktivnost od CaM-zavisnog puta. nNOS spektri razlika tipa II demonstriraju smanjenje količine visokospinskog gvožđa hema u prisustvu Zn2+. Na osnovu ovih rezultata, zaključeno je da do inaktivacije enzima dolazi usled vezivanja Zn2+ za sulfhidrile u blizini hem liganda i naknadnog poremećaja okruženja oko gvožđa hema.
SNP i NO produkcija doprinose inhibiciji niza drugih enzima. Indolamin 2,3-dioksigenaza (IDO) enzim je koji sadrži hem i koji je deo interferonom γ (IFNγ) indukovanog responsa mononuklearnih fagocita na patogene.[187] IDO je enzim koji ograničava brzinu u putu degradacije triptofana. Iscrpljivanje triptofana, najmanje dostupne esencijalne aminokiseline, može da doprinese antipatogenoj aktivnosti mononuklearnih fagocita. U studijama na izolovanim IFNγ-tretiranim ljudskim perifernim krvnim mononuklearnim ćelijama i iz monocita izvedenim makrofagama, uočeno je da SNP inhibira IDO aktivnost.[187] Takođe je pokazano da se IDO može inhibirati dejstvom Zn-MP.[195] Drugi enzimi koje inhibira SNP obuhvataju metioninsku sintazu u hepatocitima pacova,[188] (Na+/K+)-ATPaze[189] i ekto-5'-nukleotidaze u renalnim epitelijalnim ćelijama.[186] Metioninska sintaza se sastoji od metilkobalamina kao kofaktora, derivata vitamina B-12 koji je u znatnoj meri sličan hemoglobinu, a do inhibicije može doći putem formiranja NO-kobalaminskog kompleksa. Smatra se da do inhibicije ekto enzima dolazi putem S-nitrozilacije. Mehanizam inhibicije (N+/K+)-ATPaze nije poznat.
Postoje indikacije da je ugljen-monoksid (CO) fiziološki regulator, koji deluje na sličan način kao i NO, uključujući sposobnost stimulacije guanilil ciklaze. CO se formira posredstvom HO, pri konverziji hema do biliverdina i CO. Mnoge studije uloge CO su izvršene koristeći HO inhibitore, kao što su Zn-PP i Sn-PP, da bi se pokazalo da supresija HO (i stoga CO produkcije) inhibira guanilil ciklazu. Međutim, nedavne studije su pokazale da sami metaloporfirini inhibiraju guanilil ciklazu, te stoga studije koje koriste te komplekse za ispitivanje uticaja CO verovatno treba preispitati.[180][181] U drugim studijama su korišćeni porfirini za ispitivanje uloge CO u prostornom učenju i dugoročnoj potencijaciji u hipokampusu.[196][197] Porfirini su korišćeni pod pretpostavkom da oni isključivo deluju kao supresori CO produkcije posredstvom HO; međutim, imajući u vidu da je dejstvo porfirina višestrano, teško je pretpostaviti ulogu CO isključivo na bazi tih eksperimenata. Ove studije demonstriraju neke od problema sa kojima se istraživači suočavaju kad specifičnost inhibitora nije apsolutna i ilustruju neke od komplikujućih faktora u analizi podataka kad se koriste „indirektni” efektori (npr. inhibiranje enzima koji formira CO, umesto direktnog uklanjanja CO).
Hipertenzivne primene[uredi | uredi izvor]
| Hipertenzivne primene | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| sulfonamid | Cu | karbonatna anhidraza[198] | |
| heterociklični sulfonamidi | Zn, Cu | karbonatna anhidraza[199] | |
| heterociklični merkaptani, sulfenamidi, sulfonamidi | Zn, Cu | karbonatna anhidraza[200] | |
| razni sulfonamidi | Ge, Sb | karbonatna anhidraza[201] | |
| hlorotiazid | Hg, Pb | karbonatna anhidraza[202] | |
| kaptopril | Zn | angiotenzin konvertujući enzim[203] | |
| lisinopril | Cu | angiotenzin konvertujući enzim[204] | |
Sistemi vezani za hem koji su razmatrani u prethodnom odeljku blisko su povezani sa hipertenzivnim primenama. Natrijum nitroprusid je u širokoj upotrebi kao hipotenzivni agens,[188][205] a hem oksigenaza je implicirana u održavanje krvnog pritiska.[161] Utvrđeno je da SnCl2 indukuje HO-1 transkripciju i stoga inhibira dejstvo citohrom P450-arahidonska kiselina ω/ω-1 hidroksilaze, što dovodi do smanjenog formiranja ö/ö-1 hidroksilaznih metabolita i nižeg krvnog pritiska.[161] Hidroksilaza je hemni protein čiji su nivoi kontrolisani dostupnošću hema. Kad se indukuje hem oksigenaza iscrpi se dostupni hem; tome sledi opadanje nivoa enzima, a time i količine enzimskih metabolita. Metaboliti, odnosno 19[S]-hidroksieikozatetraenoinska kiselina (HETE) i 20-HETE, deluju kao prohipertenzivi jer stimulišu Na+/K+-ATPazu i konstrikciju krvnih sudova.
Još jedan od primarnih enzimskih ciljeva za hipertenziju je karbonatna anhidraza (CAs). Ona katalizuje hidraciju CO2 do bikarbonata i učestvuje u širokom opsegu bioloških procesa, uključujući pH homeostazu, produkciju okularnih i cerebrovaskularnih fluida, te sekreciju elektrolita. U očima, na primer, karbonatna anhidraza igra kritičnu ulogu u održavanju intraokularnog pritiska. Poznato je sedam izoenzima karbonatne anhidraze i nekoliko srodnih proteina. Ovi izoenzimi su prisutni u citosolu (CA I, II, III i VII), vezani za ćelijske membrane (CA IV), u mitohondrijama (CA V) i u sekretornoj formi u pljuvački (CA VI).[206][207] Oni imaju različite uloge i veoma različitu tkivnu distribuciju, kinetička svojstva i osetljivost na inhibitore. CA enzimi su metaloenzimi, a mnogi inhibitori tih enzima su metal kompleksirajući anjoni koji se direktno koordiniraju sa cinkom u aktivnom mestu enzima.
Karbonatne anhidraze, izuzev CA III, takođe inhibiraju sulfonamidi koji se vezuju za cink putem supstitucije katalitički važnog molekula vode.[200] Sulfonamidi su korišćeni za tretman glaukoma dugi niz godina jer snižavaju intraokularni pritisak (IOP). Precizni mehanizam snižavanja pritiska nije poznat, ali se smatra da do toga dolazi usled redukcije koncentracije bikarbonata u posteriornoj komori oka, te da prateće premeštanje bikarbonatnih jona dovodi do kretanja fluida i smanjenja koncentracije natrijuma.[208] Metalni kompleksi sulfonamida takođe potentno inhibiraju karbonatne anhidraze. Zn(II), Cu(II), Ni(II), Co(II), Fe(III) i Al-(III) kompleksi adamantil sulfonamidnih derivata imaju inhibitorno dejstvo na tri CA izozima (hCA I, hCA II i bCA IV) sa nM Ki vrednostima.[199] Zn(II) i Cu(II) kompleksi, najjači inhibitori u seriji, topikalno su bili primenjivani na zečji model oka i utvrđeno je da snižavaju IOP. Topikalno primenjeni sulfonamid ne snižava IOP, iz čega sledi da prisustvo metalnih jona kritično menja svojstva inhibitora. Pretpostavlja se da metal menja rastvorljivost kompleksa, čime se povećava dostupnost leka. Hg(II) kompleksi hlorotiazida, diuretika koji se koristi kao antihipertenziv, isto tako pokazuju jaku inhibiciju CA[202] kao i Ge(IV) i Sb(III) kompleksi arilsulfonilamida[201] i Cu(II) kompleksi acetazolamidnih derivata.[198] Za metalne komplekse se smatra da deluju na CA na dva načina: 1. inhibicijom sa slobodnim sulfonamidom i 2. interakcijom metalnih jona sa histidinom u aktivnom mestu.[198]
Veliki deo literature o hipertenzivnim agensima je posvećen inhibitorima angiotenzin-konvertujućeg enzima (ACE), komponenti renin-angiotenzin sistema. Renin-angiotenzin sistem učestvuje u održavanju krvnog pritiska. ACE katalizuje konverziju angiotenzina I do angiotenzina II, vazokonstriktora koji učestvuje u hipertenziji. Angiotenzin I se formira konverzijom jetrenog produkta posredstvom renina, enzima koji izlučuju bubrezi.[209][210] Postoje receptorska mesta na mnogim organima za angiotenzin II. Taj sistem može da bude blokiran na više nivoa, poznati β-blokatori blokiraju otpuštanje renina, analozi renin-supstrata i reninski inhibitori blokiraju renin, angiotenzin II receptore blokira salarzin, a ACE inhibitori blokiraju ACE. Većina pomenutih jedinjenja ne sadrži metale, mada neki ACE inhibitori formiraju metalne kompleksie in vivo. Na primer, kaptopril je dizajniran da se nadmeće sa angiotenzinom za jone cinka u enzimu i da vezuje cink putem tiolne grupe.[203] Lisinopril, još jedan ACE inhibitor, vezuje cink putem aminokarboksilatne gurpe.[204] Lisinopril se konjuguje sa Rh(III) i Pd(II) (iminofosforano)fosfinima, a konjugati imaju nešto veću inhibitornu aktivnost od roditeljskog jedinjenja (dolazi do 18-strukog smanjenja vrednosti IC50, nanomolarni opseg).[211] Ova derivatizacija u vidu sinteze 105Rh i 109Pd radio-obeleženih jedinjenja omogućava in vivo praćenje distribucije leka.
Tretmani za hipertenziju su obično dugoročni i stoga je stabilnost interakcija koju pruža kovalentno vezivanje metalnih kompleksa privlačna opcija. Najveći deo literature u ovoj oblasti se bavi organskim jedinjenjima; međutim, znatan broj tih jedinjenja je zavisan od interakcije sa metalima za ispoljavanje svog dejstva.
Serinskoproteazne primene[uredi | uredi izvor]
| Serinskoproteazne primene | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| aminokiselinske i peptidne ligacije | Co | α-himotripsin[212][213] | |
| Šifova baza | Co | trombin, termolizin[214][215][216] | |
| razne boronske kiseline | B | tripsin[217] | |
| peptid | B | α-litička proteaza[218] | |
| fenilboronska kiselina | B | α-himotripsin[219] | |
| tripeptid | B | tripsin, α-litička proteaza, tripsinu slične proteaze[220] | |
| BABIM | Zn | serinske proteaze[221][222][223][224] | |
| titanil sulfati | Ti | tripsin[225] | |
Serinske proteaze obuhvataju glavnu familiju proteolitičkih enzima sa raznovrsnim opsegom funkcija. Serinske proteaze igraju ključne uloge u kaskadi koagulacije krvi, u aktivaciji komplementa, bakterijskoj patogenezi, te fibrinolizi.[217] Serinske proteaze su postale prominentni ciljevi za dizajn lekova u antivirusnim i antibakterijskim istraživanjima.[225] Velika klasa inhibitora serinskih proteaza su boronske kiseline i peptid-boronske kiseline.[157][200][226][227] Smatra se da boronil grupe oponašanju prelazno stanje reakcije, dok peptidna porcija usmerava specifičnost na specifične proteaze.
Serije 15N i 1H studija kompleksa proteaznih inhibitora dale su uvid u interakcije između tripsina ili α-litičkih proteaza i raznih boronskokiselinskih inhibitora. U α-litičkim proteazama i tripsinu, supstratni analozi teže da formiraju serinske adukte, dok nesupstratni analozi obično formiraju histidinske adukte,[217] mada i supstratni analozi mogu ponekad da formiraju histidinske adukte.[218][228] Dalje, 11B NMR studije na histidinskim aduktima α-litičkih proteaza i serinskih adukata himotripsina i α-litičkih proteaza pokazale su da je atom bora tetraedralan u histidinskim i serinskim aduktima.[218] Iz rada sa fenilboronskom kiselinom proizilazi da adicija šećera (D-monosaharida) povećava inhibitorno dejstvo na α-himotripsin.[219] Taj zaključak je izveden na osnovu acidifikacije atoma bora putem samokompleksacije sa D-monosaharidima. Ovaj sinergistički efekat je pH zavisan i nije uočen iznad pH 9,5 (enzimska inhibicija dejstvom same borne kiseline takođe nije uočena). Do jake inhibicije enzima dolazi između pH 4 i pH 9 u prisustvu fenilborne kiseline i fruktoze sa najvećim šećerno indukovanim pojačanjem inhibicije na približno neutralnom pH. Razni tripeptidi boronatnih estara takođe deluju kao inhibitori serinske proteaze.[220] Utvrđeno je da dodatni peptidno-metalni kompleksi deluju kao serin proteazni inhibitori. Poznato je da Co(III)-vezane aminokiseline i dipeptidi mogu da inhibiraju himotripsin i tripsin.[212][213] Ove studije su provođene da bi se ispitali efekti pentamin kobalta(III), koji se koristi kao hidrofilna karboksilna zaštitna grupa u enzimatskoj peptidnoj sintezi. Ranije je primećeno da prisustvo ove grupe na aminokiselinama neposredno pored veze koja je podložna enzimskom dejstvu blokira katalitičku konverziju. Inhibicija prečišćenog himotripsina i tripsina ligiranim peptidima je kompetitivna i reverzibilna. Naknadne studije ove hemijske grupe sugerišu da se ligirani peptidi vezuju za enzim putem Kulonovih interakcija.[213] Kobalt(III)-ligirani peptidi raznih dužina su testirani na tripsinu, himotripsinu i proteinazi K. Na osnovu rezultata modelovanja himotripsina, rastojanje između dva negativno naelektrisana Asp ostatka (Asp-35 i Asp-64) u S' vezujućem i Ser-195 u aktivnom mestu odgovara dužini inhibitora peptida optimalne dužine. Redosled inhibicionih efikasnosti je metalopeptid > amid > slobodni peptid, što se podudara sa očekivanjima imajući u vidu postojanje dva negativno naelektrisana bočna lanca u mestu vezivanja. U prisustvu povišenih koncentracija NaCl, inhibicija metalopeptidima je manje efikasna, dok se inhibicija slobodnih peptida poboljšava. Do promene inhibicije amida ne dolazi. Ovi rezultati su konzistentni sa elektrostatičkim interakcijama između inhibitora i aktivnog mesta. Nasuprot ovome, tripsin ima dva pozitivno naelektrisana ostatka (Lys-60 i Arg-62) u S' vezujućem regionu i shodno tome inhibicija slobodnim peptidima je efektivnija od pozitivno naelektrisanih metalopeptida. Opservacije na proteinazi K nisu konzistentne sa obrascem efikasnosti uočenim za druga dva enzima, što sugeriše da jedno pozitivno naelektrisanje (Arg-218) u S' regionu ne određuje vezivanje. Te studije demonstriraju da adicija metalnog jedinjenja može da promeni afinitet vezivanja supstrata putem elektrostatičkih efekata.
U studijama kompleksa Co(III) Šifove baze i peptidnih konjugata tih kompleksa pokazano je da efektivno inhibiraju trombin i termolizin.[214][215][216] Peptidni konjugat selektivno inhibira trombin u smeši sa dve druge serinske proteaze (Ki = μM). Selektivnost proističe iz interakcije peptidne komponente, dok je sama inhibicija posledica kobalt(III) koordinacije sa histidinima aktivnog mesta. Alternativno, kobalt se može koordinirati sa histidinima u blizini ali ne i u samom aktivnom mestu, čime se peptid zaključava u mestu vezivanja supstrata. Takođe, pokazano je da ovi kompleksi imaju sposobnost vezivanja histidina u model sistemu peptida iz cinkovog prsta HIV nukleokapsidnog proteina.[229] U ovim studijama je pomoću 1H NMR spektroskopije demonstrirana direktna interakcija između kobaltnih kompleksa i histidina u cinkovom prstu, što dovodi do remećenja strukture cinkovog prsta. Iz pomenutih studija proističe da ovi kompleksi mogu da inhibiraju cinkove metaloproteaze.
Nakon što je klasa inhibitora cink-posredovanih serinskih proteaza okarakterisana,[221][222][223][224] u kristalografskim studijama na tripsinu je uočeno da se ti inhibitori tetraedralno koordiniraju sa egzogenim jonom cinka između dva helirajuća atoma azota inhibitora i dva ostatka aktivnog mesta (His57 i Ser195).[222] Prisustvo cinka pojačava inhibiciju za skoro tri reda veličine, i u slučaju pojedinih inhibitora proizvodi selektivnost. Ova klasa inhibitora predstavlja jedinstven pristup u kojem sam inhibitor nije metalni kompleks ali je prisustvo prelaznog metala od ključnog značaja za inhibiciju.
Serinske proteaze su implicirane u procese brojnih bolesti, a inhibicija ovih enzima aktivno je polje izučavanja.[222][224] Prisustvo histidina u aktivnom mestu i afinitet jakih kiselina za azot čini inhibiciju serinskih proteaza pomoću metalnih kompleksa logičnim izborom. Nov pristup dizajnu inhibitora, kao što je opisano iznad, vezuje organska jedinjenja za aktivna mesta putem cinkovog jona kao „mosta” (granične Luisove kiseline), što sugeriše da cink možda deluje kao regulatorni element. Ovi mali molekuli predstavljaju potencijalni okvir za konstruisanje brojnih drugih inhibitora, gde inhibitorna porcija molekula ostaje nepromenjena, dok se ostatak molekula može prilagođavati da bi se promenila specifičnost.
Neurološke primene[uredi | uredi izvor]
| Neurološke primene | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| jon | Li | adenilatna ciklaza, triptofanska hidroksilaza, Ca2+-ATPaza[230] | |
| jon | Al | serinske proteaze, α-himotripsin[231] | |
| jon | Al | monoaminooksidaza A[232] | |
| jon | Al | kalpain[233] | |
| jon | Al | kalpain, heksokinaza, glukoza-6-fosfat dehidrogenaza[234] | |
| porfirini | Fe, Zn | acetilholinesteraza[235] | |
| porfirini | Cr, Zn | hem oksigenaza, azot-monoksid sintaza[196] | |
| protoporfirin | Sn | hem oksigenaza[197] | |
| cisplatin, copper sulfate | Pt, Cu | monoaminooksidaza[125] | |
| jon | Cu, Cd, Pb, Mg, Zn | lizozomna, citoplasmična proteinaza, kalpain I i II[236] | |
| jon | Zn | matrične metaloproteinaze, sekretaze, citohrom c oksidaza, azot-monoksidna sintaza, endonukleaza[237] | |
Jedna od najbolje poznatih oblasti primene metalnih inhibitora u neurologiji je upotreba litijuma kao tretmana za bipolarni poremećaj (manično-depresivnu bolest). Litijumska terapija je uvedena 1949. godine, ali precizni mehanizam njenog terapeutskog dejstva nije bio poznat. Poslednjih godina su objavljeni izveštaji koji indiciraju da litijum utiče na puteve inozitol fosfolipidne hidrolize (mada nije jasno da li je to usled inhibicije inozitol-1-fosfataze) i da inhibira adenilatnu ciklazu.[230]
Uloga aluminijuma u Alchajmerovoj bolesti i detaljni mehanizam njegovog učešća u razvoju bolesti nisu potpuno razjašnjeni. Povezanost aluminijuma sa bolešću je implicirana sticajem okolnosti usled povišenih nivoa aluminijuma u mozgu pacijenata sa Alchajmerovom bolešću i amiotrofičnom lateralnom sklerozom.[231][234][233] Aluminijumski sadržaj je visok u plakovima, neurofibrilarnim svežnjevima i neuritskim naslagama karakterističnim za pomenuta oboljenja. Aluminijum inhibira moždane heksokinaze[238] i nekompetitivno inhibira moždanu mitohondrijsku monoaminsku oksidazu-A (MAO-A)[232] (kao što je to slučaj sa crevnom MAO, u kontekstu kancera). Postoje indikacije da aluminijum aktivira serinske proteaze, i da su tako aktivirane proteaze naknadno otporne na dejstvo drugih inhibitora.[231][234] Serinske proteaze presecaju β-amiloidne prekursorske proteine (APP) i formiraju β-amiloidne peptide. Predložen je model po kojem aluminijum supresuje inhibitorski domen proteaza, čime pospešuje proteolitičko formiranje peptida koji se zatim akumuliraju i iniciraju formiranje plakova.[231]
Niz drugih metala je bio impliciran u formiranje amiloidnih plakova. Primećeno je da Zn2+, Fe2+ i Cu2+ (μM), kao i Al2+ (mM), uzrokuju agregaciju pri fiziološkim koncentracijama β-amiloidnih proteina.[239][240][237][241][242][243] Histidinski modifikovan ljudski A beta(1-40) ne podleže agregaciji posredstvom Zn2+, Fe2+ ili Cu2+, iz čega proizilazi da histidini učestvuju u metalom indukovanoj agregaciji.[239] Postoje indikacije da metali deluju putem različitih mehanizama. Fe2+-indukovana agregacija je inhibirana prisustvom antioksidanasa, dok oni nemaju uticaja na Zn2+-indukovanu agregaciju. Ovaj nesklad sugeriše da Fe2+ uzrokuje agregaciju putem oksidativnog mehanizma.[240] Poznato je da oksidacija može da indukuje agregaciju,[244] te da β-amiloidi imaju prooksidantna svojstva — posebice u prisustvu aluminijuma.[245] Azot-monoksidni donori kao što je SNP (koji NO formiraju usled oksidativnog stresa) mogu da posreduju akumulaciju cinka u hipokampalnim ćelijama, te postoji mogućnost da su oksidativni efekti povezani sa cinkovim efektima.[237] Za razliku od toga, mehanizam Zn2+-indukovane agregacije nije zavisan od oksidacije, nego se zasniva na direktnim interakcijama sa peptidima.[239][240][242][243] Pored svog agregacionog dejstva, Zn2+ inhibira brojne proteolitičke enzime koji učestvuju u transformacijama amiloida, uključujući matriks metaloproteinaze (MMP) odgovorne za degradaciju amiloidnih peptida, a verovatno i α-sekretaze odgovorne za presecanje amiloidnog prekursorskog proteina.[237] Inhibicija proteolize se ostvaruje putem dva različita vida dejstva metala na supstrate: 1. APP ima mesto vezivanja za Zn2+ i nakon vezivanja dolazi do inhibicije presecanja na α-sekretaznom mestu, i 2. MMP enzimi ne presecaju agregirane amiloide. Za bakar i kobalt (50 μM) utvrđeno je da inhibiraju APP presecanje.[246] Direktna interakcija sa sekretazama nije potvrđena u APP studijama.
Osim amiloidnih plakova, Alchajmerovo moždano tkivo karakterišu neurofibrilarni spletovi. Istražuje se mnoštvo različitih faktora da bi se utvrdio uzrok ovog fenomena, uključujući abnormalni transport neurofilamenata i abnormalnu degradaciju. Pokazano je da aluminijum inhibira kalcijumom aktiviranu neutralnu proteinazu (kalpain II) koja posreduje razlaganje neurofilamentnih podjedinica i citoskeletalnih proteina.[233] AlCl3 i aluminijum laktat inhibiraju prečišćeni kalpain II, iz ljudskog cerebralnog korteksa, sa IC50 vrednošću od 200 μM i 400 μM, redom. Inhibicija dejstva kalpaina je posledica direktne interakcije sa enzimom, pošto preinkubacija supstrata [14C]metilazokazeina sa aluminijumom nema efekta na inhibitornu efikasnost. Aluminijumska inhibicija isto tako obuhvata interakciju sa citoskeletalnim proteinima, i u nekim slučajevima (npr. kod neurofilamentnih podjedinica NF-H i NF-M) aluminijum indukuje formiranje nerastvornih kompleksa uree. Stoga je inhibicija proteolize aluminijumom višestruki proces koji obuhvata direktno vezivanje za enzim, vezivanje za supstrat čime se ometa proteoliza, te formiranje supstratnih kompleksa koji su otporni na proteolizu. Aluminijum ima visok afinitet za fosfate i smatra se da se vezuje za fosforilisane grupe na neurofilamentnim proteinima.[233] Uprkos ovim interakcijama, mehanizam inhibicije kalpainina nije rasvetljen.
Takođe je pokazano da aluminijum inhibira metaboličke enzime u mozgu, čime se proizvode metaboličke greške. Moguće je da akumulacija takvih metaboličkih grešaka doprinosi neurološkim poremećajima kao što je Alchajmerova bolest. Heksokinaza, Mg(II)-zavisni enzim, katalizuje prvi korak u ciklusu glikolize, kojim se glukoza razlaže uz oslobađanje energije. Inhibicija heksokinaze je posredovana vezivanjem aluminijuma za supstrat; ATP ima 107 puta veći afinitet za Al(III) nego Mg(II).[234] Dok najveći deo glukoze podleže glikolizi, 15—20% se podvrgava heksozomonofosfatnom šantu. Jedan od ključnih enzima u ovom putu, glukoza-6-fosfat dehidrogenaza (G6PD), inhibira se posredstvom Al(III) (μM raspon).[234] Do toga dolazi usled direktne interakcije sa enzimom; Al(III)-vezani enzim podleže konformacionoj promeni do nasumičnije uređene strukture (sudeći po nalazima cirkularne dihroizne spektroskopije).

Trenutno se organski acetilholinesterazni inhibitori koriste u tretmanu Alchajmerove bolesti; međutim, porfirini cinka i gvožđa isto tako inhibiraju acetilholinesterazu.[235] Broj i pozicije fluorinskih grupa na porfirinskom prstenu imaju ogroman efekat na inhibitornu aktivnost.[247]
S obzirom da postoji evidencija da dolazi do akumulacije metalnih jona u nekoliko bolesti centralnog nervnog sistema (CNS), od znatnog interesa je da se utvrdi da li ova akumulacija ima ulogu u patogenezi bolesti, a ako je to slučaj i da se odredi biohemijska priroda njihovog učešća. U jednoj nedavnoj studiji, veliki broj lizozomalnih i citoplazmičnih proteinaza koje su prisutne u cerebralnom korteksu testiran je za inhibiciju metalnim jonima.[236] Utvrđeno je da milimolarne koncentracije Cu2+, Cd2+, Pb2+, Hg2+ i Zn2+ inhibiraju sve testirane lizozomalne proteinaze. Ovi joni isto tako inhibiraju citoplazmične proteinaze u različitim merama a u zavisnosti od metalnog jona. Prolinska endonukleaza i leucilna aminopeptidaza se inhibiraju 50% ili više sa Zn2+ i Cu2+, redom. Alanil-, leucil- i tripeptidilaminopeptidaze su inhibitirane sa 0,05 mM Fe2+. Piroglutamilna peptidaza se inhibira sa 0,05 mM Cu2+, Cd2+, Mn2+, Hg2+ ili Zn2+. Alanil- i ripeptidilaminopeptidaze, prolinska endopeptidaza, te piroglutamil aminopeptidaza, inhibirane su u različim merama sa Co2+ i Mn2+. Cd2+, Hg2+, Mn2+, Zn2+ i Al3+ inhibiraju kalpain I i II u različitim merama pri koncentraciji 5 mM. Implikacije ovih nalaza o metalnim jonama su predment istraživanja.
Iz ovih radova sledi da je uloga metalnih jona u neurološkim bolestima kompleksna i raznolika. Metalni joni demonstriraju raznovrstan asortiman efekata, od kinetičkih do strukturnih. Kinetički efekti mogu da budu inhibitorni ili aktivirajući. Strukturni efekti mogu da podstaknu agregaciju ili otežaju vezivanje. Ovi efekti nagoveštavaju da metalni joni mogu da budu intimatno uključeni u proces enzimske regulacije. Da bi se sprovela in vivo ispitivanja bilo bi neophodno da se ostvare milimolarne koncentracije metala u tkivima, što je normalno slučaj pod fiziološkim uslovima. Drugim rečima, potrebno je praviti razliku između potencijalno regulatornih procesa i toksičnih efekata.
Artritisne primene[uredi | uredi izvor]
| Artritisne primene | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| Auranofin, natrijum tiomalat | Au | proteinska kinaza C[248][249] | |
| trimetilaminski karboksiborani | B, Cu, Fe | elastaza, kolagenaza, lipoksigenaza, katepsin, ciklooksigenaza[250] | |
| jon | Al | kalpain I[251] | |
| aminski karboksiboranei i njihovi estri | B | inozin monofosfat, de novo regulatorni enzimi u sintezi lipida[252] | |
Jedinjenja zlata, kao što je auranofin, ekstenzivno su korišćena za tretman reumatoidnog artritisa, mada mehanizam njihovog dejstva još uvek nije utvrđen. Mnoge studije su demonstrirale inhibiciju lizozomalnih enzima[253][254] i proteinske kinaze C, što može da objasni imunosupresivno dejstvo soli zlata.[248][249]
Kompleksi bakra[255][256] i bakarni kompleksi antiinflamatornih lekova[257] pokazali su se efektivnim kao antiinflamatorni agensi. Postoje indikacije da ovi kompleksi utiču na više enzimskih sistema, a moguće je i da sam bakar ima ulogu u patogenezi bolesti. Oboleli od artritisa imaju povišene prosečne serumske ili plazmene koncentracije bakra, što je u direktnoj korelaciji sa jačinom i aktivnošću bolesti.[255] Utvrđeno je da bakar inhibira glutation-S-transferazu, a umanjena GST aktivnost je simptomatična za hronični artritis. Poznato je da su brojni od bakra zavisni enzimi neophodni za oporavak od upale tkiva.
Enzimi proteolitičkog puta su frekventno implicirani u destrukciju hrskavice obolelih od artritisa. Oni su metaloproteinaze, serinske proteaze i cisteinske proteaze, generalno prisutni u vezanom obliku sa prirodnim inhibitorima. Sistem kalpain-kalpastatina je značajan jer je kalpastatin (inhibitor kalpaina) autoantigen kod skoro 50% reumatoidnih artritisnih pacijenata i postoji evidencija da je kalpain prekomerno izražen kod artritisnih bolesnika.[258] Kalpain je Ca(II)-zavisna cisteinska proteaza koja se javlja u vidu dve izoforme: 1. kalpain I, za čiju aktivaciju se neophodne niske koncentracije kalcijuma, i 2. kalpain II, kome su potrebne visoke koncentracije. Joni aluminijuma različito utiču na ove dve izoforme u kalcijum-zavisnom maniru.[259] U prisustvu milimolarne koncentracije kalcijuma, Al inhibira kalpain II u koncentraciono zavisnom maniru, dok je kalpain I maksimalno inhibiran unutar uskog koncentracionog opsega (0,1—0,5 mM Al). U odsustvu kalcijuma, aluminijum aktivira kalpain II (koji je inače neaktivan).
Imajući u vidu efektivnost borana kao serinskoproteaznih inhibitora, ali i ulogu proteaza u artritisu, nije iznenađujuće da je utvrđeno da su brojni aminski karboksiborani antiinflamatorni agensi. Kompleksi bakra i gvožđa trimetilaminskih karboksiborana inhibiraju aktivnost lizozomalnih i proteolitičkih enzima u makrofagama,[250] kao i neki od samih aminskih karboksiborana.[252] Među inhibiranim enzimima su neutralni katepsin, tripsin, elastaza, kolagenaze I i II, prostaglandinska sintaza, ciklooksigenaza (indukovana kod inflamatornog artritisa)[260] i 5'-lipoksigenaza. Svi su inhibirani pri mikromolarnim koncentracijama.[250] Takođe je utvrđeno da aminski karboksiborani imaju mnoštvo drugih efekata, uključujući inhibiciju regulatornih enzima koji učestvuju u de novo sintezi lipida, DNK i RNK. Putem in vivo eksperimenata je isto tako utvrđeno da aminski karboksiborani vrše različite uticaje, uključujući snižavanje serumskog holesterola, blokiranje kalcijumske resorpcije (što je problematično kod osteoporoze) i redukovanje inflamacija.[252] Dalja istraživanja su neophodna da bi se utvrdila specifičnost ovih agenasa i strukturna svojstva koja utiču na razna terapeutska svojstva. Artritis je dobar primer bolesti u kojoj su metalni kompleksi ekstenzivno korišćeni kao terapija iako mehanizam dejstva nije poznat.
Primena na infekcije[uredi | uredi izvor]
Viralne primene[uredi | uredi izvor]
| Viralne primene | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| polioksovolframati | W | HIV reverzna transkriptaza, RNK polimeraza, DNK polimeraza[261] | |
| tiosemikarbazoni | Sn | reverzna transkriptaza virusa leukemije[262] | |
| TSAO | Si | HIV reverzna transkriptaza[263] | |
| trifluoperazin | V, Cu, Ni, Pd, Sn | reverzna transkriptaza virusa leukemije[264] | |
| streptonigrin | Zn | topoizomeraza, HIV reverzna transkriptaza[142] | |
| joni | Fe, U, V, Ti, Pb, Cu, Pd | proteinaza[265] | |
| batokuproinska disulfonska kiselina | Cu | proteaza, integraza[266] | |
| joni | Zn | proteaza[267] | |
| joni | Zn | renin, proteaza[265] | |
| inhibitorni helat | Cu | proteaza[268] | |
| fenantrolin, neokuproin, batokuproinski kompleksi | Cu | integraza[269] | |
| aromatični polihidroksilati | Mn | integraza, drugi enzimi kojima je potreban metal[270] | |
| porfirini | Fe, Co | hem oksigenaza[195] | |


Virusi koriste relativno mali broj, jedinstvenih enzima za održavanje svog životnog ciklusa, što čini te enzime atraktivnim metama za antivirusne lekove.[271] Na primer, genom virusa ljudske imunodeficijencije (HIV) kodira tri kritična enzima: 1. reverznu transkriptazu koja konvertuje infekcionu viralnu ssRNK u dsDNK, 2. integrazu koja umeće dsDNK u domaćinov genom, i 3. proteazu koja preseca virusne genske produkte do njihovih krajnjih formi.[272] Virusni enzimi su generalno u većoj meri konzervirani, a to je posebno slučaj sa njihovim aktivnim mestima u odnosu na pokrovne proteine, još jednu klasu metalekova; stoga su manje skloni razvoju mutacione otpornosti na lekove. Tokom poslednjih nekoliko dekada ogromni napori su uloženi u istraživanje načina sprečavanja propagacije HIV virusa, a jedan od glavnih terapijskih ciljeva je bila reverzna transkriptaza.
Reverzna transkriptaza (RT) prominentna je meta za inhibitore jer je distinktna u odnosu na normalne polimeraze ćelija domaćina i fizički odvojena od replikacione mašinerije domaćina (viralna transkriptaza je citoplazmatična, a ne jedrena). Reverzna transkriptaza je multifunkcionalni enzim. Ona deluje kao polimeraza koja formira plus i minus lance DNK i kao ribonukleaza H koja razlaže RNK porciju RNK-DNK hibrida.[273] Inhibicija može da bude usmerena na bilo koju od tih funkcija ili mesta vezivanja enzima, mada svi trenutno odobreni inhibitori utiču na polimeraznu funkciju.[274] Mnogi nukleozidni analozi i nenukleozidni inhibitori su razvijeni tokom poslednjih godina, ali relativno mali broj tih inhibitora su metalni kompleksi.
Polioksovolframati, a posebno serije silikovolframata iz keginske grupe, klasa su neorganskih jedinjenja za koje je pokazano da imaju antiviralno dejstvo.[261] Ova jedinjenja inhibiraju viralnu replikaciju u HIV-om infektiranim ćelijama i ispoljavaju kompetitivnu i nekompetitivnu inhibiciju prečišćene ili poli(etilen glikolom) precipitirane reverzne transkriptaze. Inhibicija RNK-zavisne DNK polimerazne funkcije se ostvaruje na 3—6 puta nižoj koncentraciji nego za DNK-zavisnu DNK polimeraznu aktivnost. Testovi na drugim prečišćenim DNK polimerazama indiciraju da su silikovolframova jedinjenja najsenzitivnija protiv virusa leukemije miševa (IC50 = 0,0035 μM), manje efektivna protiv HIV-1 RT (IC50 = 3 μM) i relativno neefektivna protiv ljudske DNK polimeraze 1 (IC50 = 43 μM). Mada je DNK polimeraza α donekle senzitivnija na inhibiciju od HIV-1 RT, testovi u kulturi su pokazali antiviralnu aktivnost bez citotoksičnosti; koncentracije neophodne za proizvodnju citotoksičnosti su nekoliko redova veličine više od koncentracije neophodne za eliminaciju virusa. Mada specifičnost tih jedinjenja protiv RT nije ustanovljena i tačno mesto inhibicije na RT nije poznato, njihovo antiviralno dejstvo u kulturama podstiče dalja istraživanja.
Tiosemikarbazoni su već duže vreme poznati kao antiviralni agensi. Diorganokalaj(IV) kompleksi piridil tiosemikarbazona su nedavno okarakterisani i utvrđeno je da inhibiraju RT.[262] Kompleksi bakra i kobalta istog liganda (L) takođe su ispitani.[275] Sn(Bu)2(L) i Sn(Ph)2(L) kompleksi su najefektivniji protiv RT, ali nisu testirani na drugim polimerazama da bi se utvrdila specifičnost inhibicije. Stoga se na bazi ovih studija antiviralno dejstvo jedinjenja ne može isključivo pripisati njihovoj inhibiciji RT. Takođe je poznato da tiosemikarbazoni inhibiraju ribonukleotidne reduktaze, RNK-zavisnu DNK polimerazu, te dihidrofolatnu reduktazu.[137]
Trifluoperazini (TFP), derivati psihoterapeutskog leka fenotiazina, takođe imaju potvrđeno antiviralno dejstvo. Metalni kompleksi TFP su testirani na RT virusa leukemije miševa, i ustanovljeno je da metali pospešuju inhibiciju u redosledu VO(IV) > Ni(II) > Pd(II) > Cu(II) > Sn(IV) > slobodni ligand.[264] Ovi kompleksi su efektivni protiv reverznih transkriptaza više retrovirusa. Streptonigrin je antibiotik koji je potencijalno mogao da deluje kao antitumorski agens za razne ljudske kancere; međutim, toksične nuspojave tretmana streptonigrinom su dovele do prekida kliničkih ispitivanja. Streptonigrin takođe selektivno inhibira TT ptičjeg mijeloblastoznog virusa (AMV) i HIV bez inhibiranja ćelijskih polimeraza.[142] Mehanizam dejstva streptonigrina je ispitan nakon prekida kliničkih ispitivanja. Pregled rezultata tih studija, uključujući detaljnu strukturnu karakterizaciju nekoliko metalnih kompleksa leka, pokazao je da je metalna jompleksacija ključna za biološku aktivnost leka.[142] Međutim, precizni mehanizam njegovog terapeutskog efekta je još uvek nepoznat.
Primena metal-helirajućih derivata TSAO-T, a [2',5'-bis-O-(tert-butildimetilsilil)-β-dribofuranozil]-3'-spiro-5-(4-amino-1,2-oksatiol-2,2-dioksid) nukleozidnog derivata timina predstavlja jedan drugačiji pristup poboljšanju inhibicije reverzne transkriptaze.[276] Roditeljsko jedinjenje, TSAO, vezuje se za alosterno mesto locirano pored RT katalitičkog mesta.[263] Ovo mesto vezivanja inhibitora formira interakcije sa obližnjim Mg2+ mestom vezivanja.[277] Nova klasa jedinjenja je dizajnirana sa vezanim inhibitorom, TSAO-T, za metalnu helirajuću grupu, jer se smatralo da će formirati bidentatni inhibitor sa većim afinitetom za enzim. Nekoliko derivata je bilo sintetisano, a za one sa kratkim alkilnim lancima je utvrđeno da su znatno efektivniji antiviralni agensi. Nekoliko derivata koji su jednako aktivni kao roditeljsko jedinjenje ima znatno manju toksičnost (10 puta manje koncentracije rezultuju sa 50% povećanja ćelijske održivosti). Ova klasa jedinjenja je primer inhibitora koji ne sadrže metal i inhibiraju putem formiranja metalnog kompleksa.
HIV-1 proteaza je aspartilna proteaza koja formira zrele proteine iz produkata gag gena (grupno specifičnih gena) i pol gena (DNK polimeraze). Otpornost na proteazne inhibitore se teže ostvaruje kod virusa nego otpornost na RT inhibitore,[278] te su razvijeni mnogi peptidni inhibitori.[227] Utvrđeno je da brojni metalni joni deluju kao inhibitori HIV-1 proteaze, a da su najefektivniji teški joni (Fe3+, UO22+, VO3−/VO43−, TiCp2Cl2, Pb2+), kao i da su oni uglavnom tetraedralno koordinirani.[265] Metali nekompetitivno inhibiraju enzim, tako što simultano sa supstratom zauzimaju aktivno mesto. Smatra se da se metali koordiniraju sa karboksilatnim bočnim lancima aktivnih ostataka Asp25 i Asp125, mada to nije definitivno potvrđeno. Moguće je da će ove obzervacije podstaći dizajn inhibitora HIV-1 proteaza koji će sadržati metale koji se vezuju za enzim jonskim ili kovalentnim vezama, te da će stoga biti znatno jače vezani od peptidnih inhibitora.
Goreopisana studija metalnih jona je naizgled u konfliktu sa rezultatima jedne ranije studije koja je pokazala da joni cinka i srebra nekompetitivno — a joni bakra kompetitivno inhibiraju proteaze i renin iz HIV-1.[265] Ranija studija je sprovedena na rekombinantnoj proteazi izolovanoj iz E. coli, dok je kasnija studija koristila sintetičku SF2 sekvencu proteaze, u kojoj je aminobutirna kiselina zamenjena cisteinskim ostatkom.[183][227][279][280] Nije sasvim jasno u kojoj meri sintetički enzim oponaša prirodni enzim. Isto tako, studije su izvedene na različitim pH vrednostima, ranije studije na neutralnom pH a kasnije na pH 5. Ranije studije su zapravo pokazale da je inhibicija cinkom u velikoj meri zavisna od pH. Procenjuje se dolazi do nadmetanja cinka sa protonom za grupu sa pKa = 7,0. Molekularne dinamičke simulacije izvedene na proteazi u prisustvu cinka indiciraju da se joni cinka vezuju za katalitički aktivno mesto na ostacima Asp25 i Asp25' bez poremećaja strukture enzima.[267]
Utvrđeno je da je CuCl2 efektivan inhibitor proteaze, ali ne i mutirane proteaze u kojoj su alanini supstituisani cisteinima.[281] Mutirana proteaza može inhibirati CuCl2 u prisustvu bakarnih helatora. Utvrđeno je da je batokuproin sulfonska kiselina Cu(I), BCSD-Cu(I), kompetitivni inhibitor proteaze.[266] Sama BCSD ne inhibira enzim, niti inhibicija kompleksa može da bude blokirana pomoću EDTA. Iz ovoga sledi da je metalni kompleks aktivni inhibitor, a ne slobodni ligand niti slobodni metal. Kompleks isto tako inhibira mutiranu proteazu kojoj nedostaju cisteni. Drugi bakarni helati inhibraju HIV-1 proteazu. Utvrđeno je da je diakva[bis(2-piridilkarbonil)amido]bakar(II) nitrat dihidrat kompetitivni inhibitor proteaze.[268] Ova studija takođe sugeriše da su molekuli vode u aktivnom mestu koji su prisutni između Asp25 i Asp125 važni za strukturu enzima. Ova činjenica može da utiče na dizajn inhibitora koji ne sadrže hidroksilne supstituente.
Utvrđeno je da bakarni kompleksi inhibiraju HIV integrazu.[269] Dolazi do nekompetitivne inhibicije mehanizmom koji se razlikuje od jednostavnog blokiranja vezivanja supstrata ili vezivanja DNK. Inhibicija mutanata C- i N-terminalnog brisanja ovim kompleksima ukazuje na činjenicu da se ovi kompleksi vezuju za sržni region integraze. Selektivnost kompleksa za integraze do sada nije demonstrirana. Integraze sadrže motive cinkovog prsta u blizini N-terminusa i konzervirani motiv aspartatnih i glutamatnih ostataka koji verovatno učestvuju u DNK vezivanju ili presecanju.[272] Oni takođe mogu da predstavljaju mesta potencijalnih interakcija sa metalnim kompleksima. Za veliki broj antrahinona i srodnih polihidroksilisanih fenolnih molekula je pokazano da inhibiraju integraze pri nanomolarnim koncentracijama.[270] Ova jedinjenja reaguju i sa drugim enzimima za čije dejstvo su neophodni metali (reverzne transkriptaze mišjeg leukemijskog virusa, MoMLV, i restrikcioni enzimi Pvu II i EcoRI), ali ne i sa enzimima kojima nisu potrebni metali. Iz ove činjenice proizilazi da metali učestvuju u inhibitornom mehanizmu. Za neka od testiranih jedinjenja je poznato da su metalni helatori. MoMLV inhibicija je efikasnija u prisustvu Mn2+ nego Mg2+ (do 26 puta manje vrednosti IC50 u zavisnosti od jedinjenja). Ovaj efekat je uočen i kod integraze.[282] Poznato je da katalitički domen integraze vezuje metale, a inhibicija može da obuhvati formiranje tercijarnog kompleksa inhibitora, metala i enzima; međutim, to ovo još uvek nije dokazano.
Opisani inhibitori viralnih enzima uglavnom nemaju ekskluzivnu specifičnost. Izuzev derivata TSOA-T, inhibitori ove klase nisu dizajnirani za interakciju sa specifičnim mestima. Mnogi inhibitori su identifikovani skriningom prvo za inhibiciju viralne replikacije a zatim za aktivnost na prečišćenim enzimima.
Neviralne primene[uredi | uredi izvor]
- Bakterije, glijvice i paraziti
| Antimikrobne primene | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| 1-amino-3-(2-piridil)izohinolin, joni | Cu | NADH oksidaza, laktatna dehidrogenaza[283] | |
| sulfadiazin | Ag | fosfomanozna izomeraza[284] | |
| trovalentna jedinjenja arsena | As | tripanotionska reduktaza, glutationska reduktaza[285] | |
| [XxMxOoHh]n- | Mo, V | kiselinska fosfataza[286] | |
| šećerni kompleksi | Ni | hitinaza[287] | |
| trovalentna jedinjenja amonijaka | Sb | fosfofruktokinaza[288] | |
| pentostam | Sb | klinički demo[289] | |
| tiosemikarbazoni | Cu | dihidrofolatna reduktaza[137] | |
| jon | V | ektokiselinska fosfataza[290] | |
| titanil sulfati | Ti | serinske proteaze[225] | |
Neke od najranijih primena neorganskih jedinjenja u medicini su bile u vidu antiseptika i antimikrobnih agenasa.[205][226][291] Zapravo, organoarsenična jedinjenja su bila prva jedinjenja koja su uspešno primenjena za tretman sifilisa (ona su kasnije zamenjena penicilinom), a korišćena su kao aditivi stočne hrane za sprečavanje bakterijskih i parazitskih infekcija.[226] Sulfanilamidi su velika klasa jedinjenja koja ispoljava antibakterijsku efektivnost, a poznato je i nekoliko metalnih jona koji imaju antimikrobno dejstvo.[292] Organometalna jedinjenja se rutinski testiraju za antimikrobne efekte radi identifikacije mogućih lekova. Osim agenasa koji inhibiraju enzime, postoji mnoštvo agenasa čiji mehanizam nije poznat.[293][294][295][296][279]
Jedna nedavna studija se bavila ispitivanjem inhibicije serinskih proteaza kod bakterija i gljivica radi razvoja antimikrobinih agenasa. Skrining velikog broja metalnih jona na tripsinu iz raznih izvora (prečišćenih i u bakterijskim lizatima) i goveđem pankreasnom himotripsininu pokazao je da samo Ti(IV) u obliku titanilnog sulfata inhibira tripsin, dok drugi metali ili uvećavaju aktivnost (Ca2+, Mn2+) ili nemaju efekta.[225] Ova inhibicija je kompetitivna, što znači da se inhibitor vezuje za aktivno mesto. Inhibicija himotripsina nije uočena, te je predloženo da se Ti(IV) vezuje za Asp-198 u supstratnom mestu vezivanja za ostatak koji nije prisutan kod himotripsina. Utvrđeno je da su titanilni alkoholni kompleksi manje inhibitorni (25% inhibitorne aktivnosti) nego sulfati. Petokoordinatna geometrija Ti(IV) bila je razmatrana kao moguće objašnjenje uočene aktivnosti Ti(IV) protiv bakterija u odnosu na druge metalne jone i geometrije.
Trivalentni arsenični lekovi, kao što je melarzoprol, još uvek se rutinski koriste u tretmanu tripanozomom posredovanih bolesti, kao što je afrička bolest spavanja. Mehanizam njihovog dejstva nije ispitan, mada se smatra da je posledica interakcije sa proteinskim ditiolima. Poznato je da trivalentna jedinjenja arsena formiraju stabilne adukte sa ditiol tripanotionom, te da se ti adukti efektivnije nadmeću za aktivno mesto tripanotion reduktaze.[297] Tripanotion, koji je analogan glutationu kod sisara, jedinstven je za tripanozome. Jedna nedavna studija je ispitala uticaj nekoliko jedinjenja arsenika na tripanotionsku i glutationsku reduktazu, dva enzima koja sadrže katalitičke sulfidrilne grupe.[285] Inhibicija oba enzima je znatno senzitivnija u prisustvu NADPH, što je indikacija da cisteinski sulfidrili moraju da budu redukovani da bi formirali interakcije sa lekovima. Tripanotionska reduktaza je senzitivnija na inhibiciju od glutationske reduktaze. Inhibiciju obustavlja dihidrotripanotion. Iako jedinjenja arsena inhibiraju enzim, pošto je dihidrotripanotion in vivo dostupan u znatno višim koncentracijama od tripanotionske reduktaze, malo je verovatno da bi inhibicija ovog enzima mogla da ima terapeutski učinak na tripanozomijazu.
Antimonijali su dugo korišćeni kao antiparazitici,[226][291] i još uvek se koriste u tretmanu sluzokožne lišmanijaze.[289] Niz drugih metala se ispituje za njihovu aktivnost protiv lišmanijaze. Postoje indikacije da kiselinske fosfataze (ACP) doprinose patogenosti tripanosoma Leishmania. Te fosfataze mogu da inhibiraju brojni prelazni metali i njihovi kompleksi, kao što su arsenat i vanadat.[290] Studije u kojima je korišćena tartratno senzitivna kiselinska fosfataza iz ljudskog semenog fluida i tartratno rezistentna fosfataza iz protozoe Leishmania donovani demonstrirale su da heteropolianjonski kompleksi molibdena (sa Ge, Fe, As, Ce, Th) selektivno inhibiraju ove enzime.[286] Testirane su četiri klase kompleksa, koje sadrže 4, 6—8, 12 ili 18 atoma Mo. Selektivnost je procenjena na osnovu inhibicije pomenutih enzima i odsustva ACP inhibicije iz ljudske slezine. β-glukuronidaze i α-manozidaze iz slezine su takođe ispoljile malo ili nimalo inhibicije usled dejstva molibdenat-heteropolianjona. Studije unakrsnog nadmetanja između ovih inhibitora indiciraju da se neki od kompleksa vezuju za aktivno mesto, dok se drugi vezuju za drugo mesto koje utiče na aktivno mesto. Na primer, vezivanje vanadata i jednog od kompleksa Mo nije bilo uzajamno isključivo, a vanadat je pojačavao inhibiciju Mo kompleksa.
Antimon se takođe primenjuje kao antišistozomijalni agens. Nedavnim istraživanjima je utvrđeno da razni antimonijali inhibiraju fosfofruktokinazu (PFK) iz metilja Schistosoma mansoni.[288] Opstanak šistozoma je zavisan od velike brzine glikolize, a PFK je ključni enzim u glikolitičkom putu — sadrži 20 cisteina. Upoređivanjem šistozomalne i sisarske PFK je utvrđeno da antimoniltartarat kalijum preferentno inhibira parazitov enzim. Mehanizam ove selektivnosti nije razjašnjen.
Metalni joni i metalni kompleksi su efektivni antifungalni agensi protiv patogenog kvasca Candida albicans. Kompleksi srebra inhibiraju fosfomanoznu izomerazu (PMI), ključni enzim u biosintezi kvaščanih ćelijskih zidova, sa nM Ki.[284] PMI mutant kod koga je Cys150 zamenjen sa alaninom ponaša se na sličan način kao i prirodni enzim, ali ne biva inhibiran jedinjenjima srebra i 1000 puta je manje senzitivan na živu. Iz ovoga proizilazi da je Cys150 mesto interakcije inhibitora. Joni srebra inhibiraju PMI sa 210 puta višom bimolekularnom konstantom brzine za ljudski enzim. Ova jedinjenja redukuju specifičnost za ljudski enzim do 1,3 : 1. I dok ih ovo ne kvalifikuje kao inhibitore koji su selektivni za parazite, može se pretpostaviti da je moguće razviti lek putem modifikacija organskih grupa. Kompleksi nikla inhibiraju hitinazu, koja takođe učestvuje u biohemiji ćelijskog zida kvasca-gljive C. albicans.[287] Pomenuti kompleksi sadrže N-glikozide izvedene iz aminošećera, koji inhibiraju u kompetitivnom maniru.
Mikoplazmi nedostaje čvrst ćelijski zid. Jonski bakar je efektivan inhibitor mikoplazične aktivnosti i pokazano je da inhibira enzime u glikolitičkom putu, NADH oksidazu i laktatnu dehidrogenazu.[283] 2,2'-bipiridinski tip liganda olakšava transport bakra kroz mikoplazmičnu membranu, pa je antimikoplazmično dejstvo bakra znatno povećano u prisustvu ovih liganda — mada prisustvo liganda umanjuje inhibitorni efekat na prečišćenim, izolovanim enzimima. Ova opažanja potvrđuju da je jon bakra toksičan materijal, a da ligand samo služi kao prenosnik.
- Tretman čireva
| Tretman čireva | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| joni | Bi | fekalna sluzokožna sulfataza[298] | |
| joni | Bi | H. pylori ATPaza[299] | |
Bizmutove soli su korišćene u terapiji čireva. Poznato je da one inhibiraju adenozintrifosfatazu iz želučane bakterije H. pylori (koja učestvuje u razviću peptičnog čira),[299] kao i fekalnu sluzokožnu sulfatazu (čije je izražavanje povišeno kod ulceroznog kolitisa).[298]
Toksičnost primene[uredi | uredi izvor]
| Toksičnost primene | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| ions | Al | γ-aminolevulinska kiselina[300] | |
| joni | Al | heksokinaza[301] | |
| joni | Cd, Cu, Hg, Zn, Pb | heksokinaza[302] | |
| joni | Al | glicerolna kinaza[303] | |
| joni | Al, Cd, Pb | ATPaza[304] | |
| joni | As | poli-(ADP-riboza) polimeraza[305] | |
| joni | As | piruvatna dehidrogenaza, DNK ligaza[306] | |
| joni | As | metiltransferaza[307] | |
| joni | As | metiltransferaza[308] | |
| arsenoglutation | As | glutationska reduktaza[309] | |
| 3-arsonopiruvat | As | Fosfoenolpiruvatna mutaza[310] | |
| jon | Ni | DNK polimeraza[311] | |
| jon | Zn, Cd | DNK ligaza[312] | |
| jon | Cd | O6-metilguanin-DNA metiltransferaya, DNK polimeraza β[313] | |
| cis-DDP | Pt | respiratorni enzimi[129] | |
| joni | V | peroksidaza rena, superoksid dismutaza[280] | |
| jon | Ni | MutT-dGTPaza[314] | |
| jon | Pb | γ-aminolevulinatna dehidrataza[315] | |

Velika količina rada je uložena da bi se odredio molekularni mehanizam metalne toksičnosti. Uzrok smrtnosti je kombinacija više faktora. Razumevanje puteva na koje metali utiču je prerekvizit za sprečavanje toksičnosti, te pruža uvid u potencijalne primene u kojima se toksičnost iskorišćava za proizvodnju korisnih efekata. Aluminijumska toksičnost indukuje anemiju, a smatra se da do ovoga dolazi usled perturbacije biosintetičkog puta hema.[300] Uočeno je da aluminijum inhibira brojne enzime in vitro, uključujući dehidratazu δ-aminolevulinske kiseline (aka porfobilinogenu sintazu),[300] heksokinaze,[301] glicerolne kinaze[303] i ATPazu.[304] Mehanizam inhibicije se razlikuje od enzima do enzima. Dehidrataza δ aminolevulinske kiseline koja katalizuje drugi korak biosinteze hema je metaloprotein koji vezuje osam jona cinka. Aluminijum nekompetitivno inhibira ove enzime, iz čega sledi da se ne vezuje za aktivno mesto, te da se verovatno nadmeće sa nekim ili svim jonima cinka.[300] Jonski prečnik Al3+ je sličan prečniku Mg2+ ili Fe3+, a moguće je da aluminijum inhibira Mg2+-zavisne enzime putem supstitucije za Mg2+ (na primer u heksokinazi),[303] mada ovo nije bilo uočeno u svim studijama.[301] Za glicerolne kinaze i heksokinaze je takođe postulirano da se aluminijum nadmeće sa MgATP supstratom u obliku aluminijum-ATP helatnog kompleksa.[301][303] Kinetika inhibicije može da pomogne u određivanju prirode inhibicionog mesta, ali su strukturne studije neophodne za određivanje preciznog toka interakcije.
Druge studije su demonstrirale da Cd2+, Cu2+, Hg2+, Zn2+ i Pb2+ inhibiraju heksokinazu (u niskom μM opsegu).[302] Cd2+ i Cu2+ su mnogo efektivniji od drugih metala. Inhibicija pomoću Cu2+ dovodi do pratećeg sniženja nivoa redukovanog glutationa (GSH). Preinkubacija uzorka sa GSH zaštićuje enzim od Cu2+ inhibicije. Poznato je da GSH formira GSH-Cu(I) komplekse, a zaštitni efekti GSH kompleksa su verovatno posledica jednostavnog uklanjanja Cu2+ iz rastvora. Predloženi su brojni modeli za relaciju između heksokinaze, GSH i toksičnosti teških metala in vivo.
Postoje indikacije da je arsenična toksičnost redoks zavisna, tako da je pentavalentni As(V) znatno manje toksičan od trivalentne forme elementa, As(III).[309][307] Arsenik je karcinogen, mada direktno ne oštećuje DNK. Najprominentnija hipoteza za njegov mehanizam delovanja je inhibicija enzima putem vezivanja za sulfhidrile, te je znatan broj studija bio usredsređen na ispitivanje dejstva arsenika na enzime popravke i ligacije DNK. Utvrđeno je da As(III) inhibira enzim poli-(ADP-riboza) polimerazu, koji sadrži dva vicinalna ditiola koji posreduju vezivanje enzima za prekide DNK lanaca.[305] Mehanizam inhibicije još uvek nije utvrđen. Piruvatnu dehidrogenazu inhibira As(III) pri mikromolarnim koncentracijama, ali ne i As(V). Nekoliko drugih enzima za DNK popravku je testirano i utvrđeno je da na njih As(III) nema uticaja, mada neki sadrže SH grupe od presudnog značaja za svoju funkciju.[306] Arsenit može da inhibira ligaznu aktivnost u kultivisanim ćelijama ali ne i u nuklearnim ekstraktima iz tih ćelija, iz čega sledi da inhibicija ligaza nije direktna već se javlja na nekom drugom nivou popravke.[306] Spektroskopske studije As(III) inhibicije metiltransferaze (enzima koji učestvuje u modifikaciji i popravci nepodudarnih DNK segmenata) indiciraju da se As(III) vezuje za Cys223, čime indukuje efekat teškog atoma (HAE) na obližnjem Trp ostatku. Ovo je potvrđeno opservacijom da se HAE ne javlja kod mutanta sa Cys223 zamenjenim Ser223 ostatkom.[307][308] Pojava HAE je zasnovana na nalazima crvenog pomaka fosforescentnog spektra i znatnog skraćenja životnog veka tripletnog stanja As(III)-perturbiranog triptofana. Ova interakcija ne utiče na enzimsku aktivnost, tako da je inhibicija koja je uočena u prisustvu viška arsenita verovatno posledica vezivanja za druge cistenske ostatke enzima.
Inhibicija glutationske reduktaze sa As(III) konzistentna je sa oksidacijom tiolnih grupa u aktivnom mestu enzima.[309] Arsen formira arsenoglutationske komplekse sa glutationom, i oni deluju kao inhibitori mešovitog tipa na glutationskoj reduktazi. Enzimi koji deluju na forsfornim jedinjenjima često prepoznaju arsenske analoge, npr. adenilatna ciklaza i RNK polimeraza. Pokazano je da 3-arsonopiruvat kompetitivno inhibira fosfoenolpiruvatnu (PEP) mutazu sa Ki = 27 μM.[310] PEP mutaza je glavni enzim u biosintetičkom putu formiranja C-P veza. Nikl je poput arsena genotoksičan karcinogen, mada precizni mehanizam toksičnosti Ni nije poznat. Ni(II) služi kao slaba zamena za Mg(II) u nekim polimerazama, dok druge polimeraze bivaju jako inhibirane.[311] Efekat jona nikla na inkorporaciju nukleotida, procesivnost i misinkorporaciju proučavan je kod sedam različitih polimeraza; izveden je zaključak da je njegov primarni efekat inhibicija (mikromolarni opseg). Međutim, ovo zavisi od brojnih faktora čiji značaj varira od enzima do enzima. Dejstvo nikla je kompleksno, a precizni mehanizam ometanja polimerazne funkcije nije ustanovljen. Inhibicija replikacije i popravke DNK povezana je sa mutagenošću i karcinogenošću metalnih jona.[313] Uočeno je da Ni(II) inhibira MutT-dGTPazu, koja učestvuje u popravci 8-okso-dGTP oštećenja na DNK (milimolarni Ki).[314] Ćelije izložene oksidativnom stresu formiraju 8-okso-dGTP; prisustvo nukleotida povišava mutacionu frekvenciju A u C transverzijama usled 8-okso-dG-dA nesparivanja. Inhibicija Mg(II)-zavisnog MutT enzima popravke može da dovede do povišene mutageneze. Studije molekulskim modelovanjem ukazuju da se Ni(II) ne vezuje za mesto vezivanja Mg(II), nego da indukuje konformacione promene za koje je predviđeni uzrok vezivanje za histidinske ostatke.[314]
Uočeno je da cink i kadmijum takođe inhibiraju enzime DNK popravke.[313] Prečišćena DNK ligaza se inhibira sa 0,8 mM ZnCl2 i 0,04 mM CdCl2.[312] Oba metala inhibiraju formiranje intermedijera, transferazno dejstvo i ligaciono dejstvo, a nemaju efekta na brzinu misligacije. Drugim rečima, inhibicija jedino utiče na enzimsku aktivnost dok se tačnost rada lizage ne menja. Ligazama je neophodan magnezijum kao kofaktor; Mg je neophodan za sve tri koraka ligacione reakcije koja inhibira kadmijum i cink. Joni Cd i Zn mogu da deluju putem supstituisanja jona Mg u mestu vezivanja metala.
Jedan od metala s lošom reputacijom u očima javnosti je olovo. Trovanje olovom zauzima istaknuto mesto u javnoj svesti zbog mnoštva incidenata uzrokovanih primenom olova na radnim mestima, kao i zbog trovanja dece olovnim bojama.[315] Jedan od mehanizama toksičnosti je inhibicija cink metaloenzima, odnosno γ-aminolevulinatne dehidrataze (ALAD) koja je takođe nekompetitivno inhibirana aluminijumom. U slučaju olova, inhibicija se odvija putem supstitucije cinka olovom. Dva alela ALAD enzima su identifikovana kod ljudi (ALAD1 i ALAD2) i oni kodiraju tri distinktna izozima. Testiranje velikog broja dece (izložene niskim nivoima olova u životnoj sredini) i radnika iz olovoprerađivačkih fabrika pokazala su da ALAD2 pozitivni imaju povišene nivoe olova u krvi nakon sličnih izlaganja i da su znatno senzitivniji na trovanje olovom. Pretpostavlja se da ALAD2 jače vezuje olovo.[315]
Metalna toksičnost može da bude rezultat oksidativnih reakcija. Vanadat učestvuje u mnoštvu takvih reakcija, a nedavno je objavljena studija u kojoj je izučavano njegovo dejstvo na antioksidantne enzime.[280] Četiri različita enzima su razmatrana i utvrđeno je da vanadat inhibira peroksidazu rena. Ovi nalazi doduše ne daju jasnu indikaciju o relaciji između antioksidantske enzimske inhibicije i toksičnosti.
Znatan deo literature se bavi jednim drugim mehanizmom inhibicije enzimske aktivnosti metalnim jonima: redukcijom količine enzima usled inhibiranja transkripcije gena koji kodiraju enzim.[318][319] Najvećim delom, rezultati ispitivanja naglašavaju da je toksičnost uzrokovana metalnim jonima posledica inhibicije koja se javlja na mnogim nivoima u mnogim sistemima, te da je malo verovatno da bilo koja pojedinačna promena može da bude samostalno odgovorna za toksične efekte.
Vidi još[uredi | uredi izvor]
- Analog prelaznog stanja
- Antimetabolit
- Farmakofor
- Inhibicija enzimskih reakcija
- Proteomika bazirana na aktivnosti — grana proteomike koja koristi kovalentne inhibitore enzima kao indikatore pri izučavanju enzimske aktivnosti
Reference[uredi | uredi izvor]
- ^ а б Robert A. Copeland (06. 05. 2013). Evaluation of Enzyme Inhibitors in Drug Discovery: A Guide for Medicinal Chemists and Pharmacologists (II izd.). ISBN 9781118488133. doi:10.1002/9781118540398.
- ^ а б Shapiro, R; Vallee, BL (1991). „Interaction of human placental ribonuclease with placental ribonuclease inhibitor”. Biochemistry. 30 (8): 2246—55. PMID 1998683. doi:10.1021/bi00222a030.
- ^ а б Berg J.; Tymoczko J.; Stryer L. (2002). Biochemistry. W. H. Freeman and Company. ISBN 978-0-7167-4955-4.
- ^ а б в г д ђ е ж з и Cleland WW (1963). „The kinetics of enzyme-catalyzed reactions with two or more substrates or products. II. Inhibition: nomenclature and theory”. Biochim. Biophys. Acta. 67: 173—87. PMID 14021668. doi:10.1016/0926-6569(63)90226-8.
- ^ а б в г д ђ Segel, Irwin H. (1993). Enzyme Kinetics : Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems (New izd.). Wiley-Interscience. ISBN 978-0-471-30309-1.
- ^ а б Holdgate, GA (2001). „Making cool drugs hot: isothermal titration calorimetry as a tool to study binding energetics” (PDF). BioTechniques. 31 (1): 164—6, 168, 170. PMID 11464510.
- ^ а б Leatherbarrow, RJ (1990). „Using linear and non-linear regression to fit biochemical data”. Trends in Biochemical Sciences. 15 (12): 455—8. PMID 2077683. doi:10.1016/0968-0004(90)90295-M.
- ^ а б Tseng, SJ; Hsu, JP (1990). „A comparison of the parameter estimating procedures for the Michaelis-Menten model”. Journal of Theoretical Biology. 145 (4): 457—64. PMID 2246896. doi:10.1016/S0022-5193(05)80481-3.
- ^ а б Walsh, R.; Martin, E.; Darvesh, S. (2011). „Limitations of conventional inhibitor classifications”. Integrative Biology. Royal Society of Chemistry. 3 (12): 1197—1201. PMID 22038120. doi:10.1039/c1ib00053e.
- ^ а б Walsh, R.; Martin, E.; Darvesh, S. (2007). „A versatile equation to describe reversible enzyme inhibition and activation kinetics: Modeling β-galactosidase and butyrylcholinesterase”. Biochimica et Biophysica Acta (BBA) – General Subjects. 1770 (5): 733—746. PMID 17307293. doi:10.1016/j.bbagen.2007.01.001.
- ^ а б Walsh, Ryan (2012). „Ch. 17. Alternative Perspectives of Enzyme Kinetic Modeling”. Ur.: Ekinci, Deniz. Medicinal Chemistry and Drug Design (PDF). InTech. str. 357—371. ISBN 978-953-51-0513-8.
- ^ а б Chris G Whiteley (30. 06. 2010). „Enzyme Kinetics: Partial and Complete Competitive Inhibition”. Biochemical Education. 25 (3).
- ^ а б Dixon, M.; Webb, E.C.; Thorne, C.J.R.; Tipton K.F. (1979). Enzymes (III izd.). London: Longman. str. 126. ASIN B001MVGNNO.
- ^ а б „Hormonal Regulation of Metabolism: The levels of glucose in the blood are regulated by the hormones insulin and glucagon from the pancreas, and T3 and T4 from the thyroid”. 26. 05. 2016.
- ^ а б John F. Morrison (1982). „The slow-binding and slow, tight-binding inhibition of enzyme-catalysed reactions”. Trends in Biochemical Sciences. 7 (3): 102—105. doi:10.1016/0968-0004(82)90157-8.
- ^ а б Hsu, JT; Wang, HC; Chen, GW; Shih, SR (2006). „Antiviral drug discovery targeting to viral proteases”. Current pharmaceutical design. 12 (11): 1301—14. PMID 16611117. doi:10.2174/138161206776361110.
- ^ а б Lew W, Chen X, Kim CU (2000). „Discovery and development of GS 4104 (oseltamivir): an orally active influenza neuraminidase inhibitor”. Curr. Med. Chem. 7 (6): 663—72. PMID 10702632. doi:10.2174/0929867003374886.
- ^ а б PM, Fischer (2003). „The design, synthesis and application of stereochemical and directional peptide isomers: a critical review”. Curr. Protein Pept. Sci. 4 (5): 339—56. PMID 14529528. doi:10.2174/1389203033487054.
- ^ а б Bogoyevitch, MA; Barr, RK; Ketterman, AJ (2005). „Peptide inhibitors of protein kinases-discovery, characterisation and use”. Biochimica et Biophysica Acta. 1754 (1—2): 79—99. PMID 16182621. doi:10.1016/j.bbapap.2005.07.025.
- ^ а б L., Lundblad R. (2004). Chemical Reagents for Protein Modification. CRC Press Inc. ISBN 978-0-8493-1983-9.
- ^ а б Price, N.; Hames, B.; Rickwood, D., ur. (1996). Proteins LabFax. Academic Press. ISBN 978-0-12-564710-6.
- ^ а б Adam, GC; Cravatt, BF; Sorensen, EJ (2001). „Profiling the specific reactivity of the proteome with non-directed activity-based probes”. Chemistry & Biology. 8 (1): 81—95. PMID 11182321. doi:10.1016/S1074-5521(00)90060-7.
- ^ а б Maurer, T; Fung, HL (2000). „Comparison of methods for analyzing kinetic data from mechanism-based enzyme inactivation: application to nitric oxide synthase”. AAPS PharmSci. 2 (1): 68—77. PMC 2751003
 . PMID 11741224. doi:10.1208/ps020108.
. PMID 11741224. doi:10.1208/ps020108.
- ^ а б Loo JA, DeJohn DE, Du P, Stevenson TI, Ogorzalek LR (1999). „Application of mass spectrometry for target identification and characterization”. Med Res Rev. 19 (4): 307—19. PMID 10398927. doi:10.1002/(SICI)1098-1128(199907)19:4<307::AID-MED4>3.0.CO;2-2.
- ^ а б в г Poulin, R; Lu, L; Ackermann, B; Bey, P; Pegg, AE (1992). „Mechanism of the irreversible inactivation of mouse ornithine decarboxylase by alpha-difluoromethylornithine. Characterization of sequences at the inhibitor and coenzyme binding sites”. The Journal of Biological Chemistry. 267 (1): 150—8. PMID 1730582.
- ^ а б Szedlacsek, SE; Duggleby, RG (1995). „Kinetics of slow and tight-binding inhibitors”. Enzyme Kinetics and Mechanism Part D: Developments in Enzyme Dynamics. Methods in Enzymology. 249. str. 144—80. ISBN 978-0-12-182150-0. PMID 7791610. doi:10.1016/0076-6879(95)49034-5.
- ^ а б Stone, SR; Morrison, JF (1986). „Mechanism of inhibition of dihydrofolate reductases from bacterial and vertebrate sources by various classes of folate analogues”. Biochimica et Biophysica Acta. 869 (3): 275—85. PMID 3511964. doi:10.1016/0167-4838(86)90067-1.
- ^ а б Pick, FM; McGartoll, MA; Bray, RC (1971). „Reaction of formaldehyde and of methanol with xanthine oxidase”. European Journal of Biochemistry / FEBS. 18 (1): 65—72. PMID 4322209. doi:10.1111/j.1432-1033.1971.tb01215.x.
- ^ а б Reardon, JE (1989). „Herpes simplex virus type 1 and human DNA polymerase interactions with 2'-deoxyguanosine 5'-triphosphate analogues. Kinetics of incorporation into DNA and induction of inhibition”. The Journal of Biological Chemistry. 264 (32): 19039—44. PMID 2553730.
- ^ а б Cohen, J.A.; Oosterbaan, R.A.; Berends, F. (1967). „[81] Organophosphorus compounds”. Enzyme Structure. Methods in Enzymology. 11. str. 686. ISBN 978-0-12-181860-9. doi:10.1016/S0076-6879(67)11085-9.
- ^ а б Brenner, G. M. (2000). Pharmacology. Philadelphia, PA: W.B. Saunders Company. ISBN 978-0-7216-7757-6.
- ^ а б Saravanamuthu, A; Vickers, TJ; Bond, CS; Peterson, MR; Hunter, WN; Fairlamb, AH (2004). „Two interacting binding sites for quinacrine derivatives in the active site of trypanothione reductase: a template for drug design”. The Journal of Biological Chemistry. 279 (28): 29493—500. PMC 3491871
 . PMID 15102853. doi:10.1074/jbc.M403187200.
. PMID 15102853. doi:10.1074/jbc.M403187200.
- ^ а б Koppitz M, Eis K; Eis (2006). „Automated medicinal chemistry”. Drug Discov. Today. 11 (11—12): 561—8. PMID 16713909. doi:10.1016/j.drudis.2006.04.005.
- ^ а б G, Scapin (2006). „Structural biology and drug discovery”. Curr. Pharm. Des. 12 (17): 2087—97. PMID 16796557. doi:10.2174/138161206777585201.
- ^ а б Gohlke H, Klebe G; Klebe (2002). „Approaches to the description and prediction of the binding affinity of small-molecule ligands to macromolecular receptors”. Angew. Chem. Int. Ed. Engl. 41 (15): 2644—76. PMID 12203463. doi:10.1002/1521-3773(20020802)41:15<2644::AID-ANIE2644>3.0.CO;2-O.
- ^ а б Glen RC, Allen SC; Allen (2003). „Ligand-protein docking: cancer research at the interface between biology and chemistry”. Curr. Med. Chem. 10 (9): 763—7. PMID 12678780. doi:10.2174/0929867033457809.
- ^ а б Allinger NL, Burkert U (1982). Molecular Mechanics. An American Chemical Society Publication. ISBN 978-0-8412-0885-8.
- ^ а б VG, Box (1997). „The Molecular Mechanics of Quantized Valence Bonds”. J Mol Model. 3 (3): 124—41. doi:10.1007/s008940050026.
- ^ а б „Sildenafil Citrate”. The American Society of Health-System Pharmacists. Pristupljeno 01. 12. 2014.
- ^ а б Peters GJ, van der Wilt CL, van Moorsel CJ, Kroep JR, Bergman AM, Ackland SP (2000). „Basis for effective combination cancer chemotherapy with antimetabolites”. Pharmacol. Ther. 87 (2—3): 227—53. PMID 11008002. doi:10.1016/S0163-7258(00)00086-3.
- ^ а б Silvaggi, N.R.; Josephine, H.R.; Kuzin, A.P.; Nagarajan, R.; Pratt, R.F.; Kelly, J.A. (2005). „Crystal structures of complexes between the R61 DD-peptidase and peptidoglycan-mimetic beta-lactams: a non-covalent complex with a "perfect penicillin"”. J.Mol.Biol. 345: 521—533. PMID 15581896. doi:10.1016/j.jmb.2004.10.076.
- ^ а б Park BK, Breckenridge AM (1981). „Clinical implications of enzyme induction and enzyme inhibition.”. Clin Pharmacokinet. 6 (1): 1—24. PMID 6113907. doi:10.2165/00003088-198106010-00001.
- ^ а б Maggi, M; Filippi, S; Ledda, F; Magini, A; Forti, G (2000). „Erectile dysfunction: from biochemical pharmacology to advances in medical therapy”. European Journal of Endocrinology. Bioscientifica. 143 (2): 143—54. PMID 10913932. doi:10.1530/eje.0.1430143.
- ^ а б McGuire, JJ (2003). „Anticancer antifolates: current status and future directions”. Current pharmaceutical design. 9 (31): 2593—613. PMID 14529544. doi:10.2174/1381612033453712.
- ^ а б „Antibiotics”. NHS. 05. 06. 2014. Pristupljeno 17. 01. 2015.
- ^ а б „Factsheet for experts”. European Centre for Disease Prevention and Control. Pristupljeno 24. 12. 2014.
- ^ а б Katz, AH; Caufield, CE (2003). „Structure-based design approaches to cell wall biosynthesis inhibitors”. Current pharmaceutical design. 9 (11): 857—66. PMID 12678870. doi:10.2174/1381612033455305.
- ^ а б Tan, Siang Yong; Tatsumura, Yvonne (01. 07. 2015). „Alexander Fleming (1881—1955): Discoverer of penicillin”. Singapore Medical Journal. 56 (7): 366—367. ISSN 0037-5675. PMC 4520913
 . PMID 26243971. doi:10.11622/smedj.2015105.
. PMID 26243971. doi:10.11622/smedj.2015105.
- ^ а б Gualerzi, Claudio O.; Brandi, Letizia; Fabbretti, Attilio; Pon, Cynthia L. (04. 12. 2013). Antibiotics: Targets, Mechanisms and Resistance. John Wiley & Sons. ISBN 9783527333059.
- ^ а б Calderon, C. B.; Sabundayo, B. P. (2007). Schwalbe, R.; Steele-Moore, L.; Goodwin, A. C., ur. Antimicrobial Classifications: Drugs for Bugs. Antimicrobial Susceptibility Testing Protocols. CRC Press. Taylor & Frances group. ISBN 978-0-8247-4100-6.
- ^ а б Srivastava A, Talaue M, Liu S, Degen D, Ebright RY, Sineva E, Chakraborty A, Druzhinin SY, Chatterjee S, Mukhopadhyay J, Ebright YW, Zozula A, Shen J, Sengupta S, Niedfeldt RR, Xin C, Kaneko T, Irschik H, Jansen R, Donadio S, Connell N, Ebright RH (2011). „New target for inhibition of bacterial RNA polymerase: 'switch region'”. Curr. Opin. Microbiol. 14 (5): 532—43. PMC 3196380
 . PMID 21862392. doi:10.1016/j.mib.2011.07.030.
. PMID 21862392. doi:10.1016/j.mib.2011.07.030.
- ^ а б Cunha, B. A. (2009). Antibiotic Essentials. Jones & Bartlett Learning. str. 180. ISBN 978-0-7637-7219-2.
- ^ а б Nicholson, Donald E. (1971). An Introduction to Metabolic Pathways by S. DAGLEY (Vol. 59, No. 2 izd.). Sigma Xi, The Scientific Research Society. str. 266.
- ^ а б Reece, Jane B. (2011). Campbell biology / Jane B. Reece ... [et al.]. (IX izd.). Boston: Benjamin Cummings. str. 143. ISBN 978-0-321-55823-7.
- ^ а б Bailey, Regina. „10 Steps of Glycolysis”.
- ^ а б Romano, AH; Conway, T (1996). „Evolution of carbohydrate metabolic pathways”. Res Microbiol. 147 (6—7): 448—55. PMID 9084754. doi:10.1016/0923-2508(96)83998-2.
- ^ а б Wegener G, Krause U (2002). „Different modes of activating phosphofructokinase, a key regulatory enzyme of glycolysis, in working vertebrate muscle”. Biochem. Soc. Trans. 30 (2): 264—270. PMID 12023862. doi:10.1042/bst0300264.
- ^ а б Raben N, Exelbert R, Spiegel R, Sherman JB, Nakajima H, Plotz P, Heinisch J (1995). „Functional expression of human mutant phosphofructokinase in yeast: genetic defects in French Canadian and Swiss patients with phosphofructokinase deficiency”. Am. J. Hum. Genet. 56 (1): 131—141. PMC 1801305
 . PMID 7825568.
. PMID 7825568.
- ^ а б Cannon, W. B. (1926). „Physiological regulation of normal states: some tentative postulates concerning biological homeostatics”. Ur.: A. Pettit(ed.). A Charles Richet : ses amis, ses collègues, ses élèves. Paris: Les Éditions Médicales. str. 91.
- ^ а б Okar, DA; Lange, AJ (1999). „Fructose-2,6-bisphosphate and control of carbohydrate metabolism in eukaryotes”. BioFactors (Oxford, England). 10 (1): 1—14. PMID 10475585. doi:10.1002/biof.5520100101.
- ^ а б Robert M. Stroud; Anthony A. Kossiakoff; John L. Chambers (1977). „Mechanisms of Zymogen Activation”. Annual Review of Biophysics and Bioengineering. 6: 177—193. doi:10.1146/annurev.bb.06.060177.001141.
- ^ а б Hans Neurath; Kenneth A. Walsh (1976). „Biochemistry Role of proteolytic enzymes in biological regulation (A Review) (limited proteolysis/zymogen activation/control mechanisms)” (PDF). Proc. Natl. Acad. Sci. USA. 73 (11): 3825—3832.
- ^ а б Rawlings ND, Barrett AJ (1994). „Families of serine peptidases”. Meth. Enzymol. Methods in Enzymology. 244: 19—61. ISBN 978-0-12-182145-6. PMID 7845208. doi:10.1016/0076-6879(94)44004-2.
- ^ а б Levilliers, J.; Péron; Arrio; Pudles (1970). „On the mechanism of action of proteolyticinhibitors: IV. Effect of 8murea on the stability of trypsin in trypsin-lnhibitor complexes”. Archives of Biochemistry and Biophysics. 140 (2): 474—483. PMID 5528741. doi:10.1016/0003-9861(70)90091-3.
- ^ а б S., Dreon M.; Ituarte S.; Heras H. (2010). „The Role of the Proteinase Inhibitor Ovorubin in Apple Snail Eggs Resembles Plant Embryo Defense against Predation”. PLoS ONE. 5 (12): e15059. PMID 21151935. doi:10.1371/journal.pone.0015059.
- ^ а б Price, Nicholas; Stevens, Lewis (1999). Fundamentals of Enzymology. Oxford University Press. ISBN 978-0-19-850229-6.
- ^ а б Smyth, TP (2004). „Substrate variants versus transition state analogues as noncovalent reversible enzyme inhibitors”. Bioorganic & Medicinal Chemistry. 12 (15): 4081—8. PMID 15246086. doi:10.1016/j.bmc.2004.05.041.
- ^ а б Hartley, RW (1989). „Barnase and barstar: two small proteins to fold and fit together”. Trends in Biochemical Sciences. 14 (11): 450—4. PMID 2696173. doi:10.1016/0968-0004(89)90104-7.
- ^ а б Serrano L, Kellis JT, Cann P, Matouschek A, Fersht AR (1992). „The folding of an enzyme. II. Substructure of barnase and the contribution of different interactions to protein stability”. J. Mol. Biol. 224 (3): 783—804. PMID 1569557. doi:10.1016/0022-2836(92)90562-X.
- ^ а б Serrano L, Matouschek A, Fersht AR (1992). „The folding of an enzyme. III. Structure of the transition state for unfolding of barnase analysed by a protein engineering procedure”. J. Mol. Biol. 224 (3): 805—18. PMID 1569558. doi:10.1016/0022-2836(92)90563-Y.
- ^ а б Matouschek A, Serrano L, Fersht AR (1992). „The folding of an enzyme. IV. Structure of an intermediate in the refolding of barnase analysed by a protein engineering procedure”. J. Mol. Biol. 224 (3): 819—35. PMID 1569559. doi:10.1016/0022-2836(92)90564-Z.
- ^ а б Oliver, CJ; Shenolikar, S (1998). „Physiologic importance of protein phosphatase inhibitors”. Frontiers in Bioscience. 3: D961—72. PMID 9727084.
- ^ а б „Types of Pesticides”. US Environmental Protection Agency. Pristupljeno 20. 02. 2013.
- ^ а б Quinn DM (1987). „Acetylcholinesterase: enzyme structure, reaction dynamics, and virtual transition states”. Chemical Reviews. 87 (5): 955—79. doi:10.1021/cr00081a005.
- ^ а б Taylor P, Radić Z (1994). „The cholinesterases: from genes to proteins”. Annual Review of Pharmacology and Toxicology. 34: 281—320. PMID 8042853. doi:10.1146/annurev.pa.34.040194.001433.
- ^ а б Katzung BG (2001). Basic and clinical pharmacology:Introduction to autonomic pharmacology (8 izd.). The McGraw Hill Companies. str. 75—91. ISBN 978-0-07-160405-5.
- ^ а б в г Sussman JL, Harel M, Frolow F, Oefner C, Goldman A, Toker L, Silman I (1991). „Atomic structure of acetylcholinesterase from Torpedo californica: a prototypic acetylcholine-binding protein”. Science. 253 (5022): 872—9. Bibcode:1991Sci...253..872S. PMID 1678899. doi:10.1126/science.1678899.
- ^ а б в г Sussman JL, Harel M, Silman I (1993). „Three-dimensional structure of acetylcholinesterase and of its complexes with anticholinesterase drugs”. Chem. Biol. Interact. 87 (1—3): 187—97. PMID 8343975. doi:10.1016/0009-2797(93)90042-W.
- ^ а б KD Tripati MD. Essentials of Medical Pharmacology (fifth izd.). Jaypee Brothers Medical Publishers(P) Ltd. str. 84. ISBN 978-81-8061-187-2.
- ^ а б Mehndiratta, Man Mohan; Pandey, Sanjay; Kuntzer, Thierry (13. 10. 2014). Acetylcholinesterase inhibitor treatment for myasthenia gravis. John Wiley & Sons, Ltd. doi:10.1002/14651858.CD006986.pub3.
- ^ а б Choices, N. H. S. (2014). „Atropine - Myasthenia-gravis medicines and drugs - NHS Choices”. Pristupljeno 11. 07. 2015.
- ^ а б Kumar, Vikas; Kaminski, Henry J. (07. 10. 2010). „Treatment of Myasthenia Gravis”. Current Neurology and Neuroscience Reports. 11 (1): 89—96. ISSN 1528-4042. PMID 20927659. doi:10.1007/s11910-010-0151-1.
- ^ а б V Priya Nair; Jennifer M Hunter (2004). „Anticholinesterases and anticholinergic drugs”. Contin Educ Anaesth Crit Care Pain. 4 (5): 164—168. doi:10.1093/bjaceaccp/mkh045.
- ^ а б J. Susan Van Dyk; Brett Pletschke (2011). „Review on the use of enzymes for the detection of organochlorine, organophosphate and carbamate pesticides in the environment”. Chemosphere. 82 (3): 291—307. doi:10.1016/j.chemosphere.2010.10.033.
- ^ а б Kambiz Soltaninejad; Mohammad Abdollahi (2009). „Current opinion on the science of organophosphate pesticides and toxic stress: a systematic review”. Med Sci Monit. 15 (3): RA75—90. eISSN 1643-3750.
- ^ а б S, Tan; Evans R; Singh B (2006). „Herbicidal inhibitors of amino acid biosynthesis and herbicide-tolerant crops”. Amino Acids. 30 (2): 195—204. PMID 16547651. doi:10.1007/s00726-005-0254-1.
- ^ а б Steinrücken HC, Amrhein N (1980). „The herbicide glyphosate is a potent inhibitor of 5-enolpyruvyl-shikimic acid-3-phosphate synthase”. Biochemical and Biophysical Research Communications. 94 (4): 1207—12. PMID 7396959. doi:10.1016/0006-291X(80)90547-1.
- ^ а б Lamberth C, Jeanmart S, Luksch T, Plant A (2013). „Current Challenges and Trends in the Discovery of Agrochemicals”. Science. 341 (6147): 742—6. PMID 23950530. doi:10.1126/science.1237227.
- ^ а б Hugh M. Brown (1990). „Mode of action, crop selectivity, and soil relations of the sulfonylurea herbicides”. 29 (3): 263—281. doi:10.1002/ps.2780290304.
- ^ а б Leonard L. Saari; Josephine C. Cotterman; Michael M. Primiani (1990). „Mechanism of Sulfonylurea Herbicide Resistance in the Broadleaf Weed, Kochia scoparia” (PDF). Plant Physiology. 93 (1): 55—61. PMID 16667465.
- ^ а б E. Patrick Fuerst (1987). „Understanding the Mode of Action of the Chloroacetamide and Thiocarbamate Herbicides”. Weed Technology. 1 (4): 270—277.
- ^ а б Frosch, S.; Jabben, M.; Bergfeld, R.; H. Kleinig; H. Mohr (1979). „Inhibition of carotenoid biosynthesis by the herbicide SAN 9789 and its consequences for the action of phytochrome on plastogenesis”. Planta. 145: 497. doi:10.1007/BF00380105.
- ^ а б SO, Duke (1990). „Overview of herbicide mechanisms of action”. Environ. Health Perspect. Brogan. 87: 263—71. JSTOR 3431034. PMC 1567841
 . PMID 1980104. doi:10.2307/3431034.
. PMID 1980104. doi:10.2307/3431034.
- ^ а б „Secondary metabolites - Knowledge Encyclopedia”. www.biologyreference.com. Pristupljeno 10. 05. 2016.
- ^ а б Tan, G; Gyllenhaal, C; Soejarto, DD (2006). „Biodiversity as a source of anticancer drugs”. Current drug targets. 7 (3): 265—77. PMID 16515527. doi:10.2174/138945006776054942.
- ^ а б Laurie C. Dolan; Ray A. Matulka; George A. Burdock (2010). „Naturally Occurring Food Toxins”. Toxins. Basel. 2 (9): 2289—2332. PMID 3153292. doi:10.3390/toxins2092289.
- ^ а б Bal Ram Singh; Anthony T. Tu, ur. (1996). Natural Toxins 2: Structure, Mechanism of Action, and Detection (NATO Asi Series) (v. 2). Springer. ISBN 978-0-06-093436-1.
- ^ а б Peltier, Sandra; Oger, Jean-Michel; Lagarce, Frédéric; Couet, William; Benoît, Jean-Pierre (2006). „Enhanced Oral Paclitaxel Bioavailability After Administration of Paclitaxel-Loaded Lipid Nanocapsules”. Pharmaceutical Research. 23 (6): 1243—50. PMID 16715372. doi:10.1007/s11095-006-0022-2.
- ^ а б Abal, M; Andreu, JM; Barasoain, I (2003). „Taxanes: microtubule and centrosome targets, and cell cycle dependent mechanisms of action”. Current cancer drug targets. 3 (3): 193—203. PMID 12769688. doi:10.2174/1568009033481967.
- ^ а б Bharadwaj, Rajnish; Yu, Hongtao (2004). „The spindle checkpoint, aneuploidy, and cancer”. Oncogene. 23 (11): 2016—27. PMID 15021889. doi:10.1038/sj.onc.1207374.
- ^ а б Brito, D. A.; Yang, Z.; Rieder, C. L. (2008). „Microtubules do not promote mitotic slippage when the spindle assembly checkpoint cannot be satisfied”. The Journal of Cell Biology. 182 (4): 623—9. PMC 2518701
 . PMID 18710927. doi:10.1083/jcb.200805072.
. PMID 18710927. doi:10.1083/jcb.200805072.
- ^ а б Hostettmann, K.; Borloz, A.; Urbain, A.; Marston, A. (2006). „Natural Product Inhibitors of Acetylcholinesterase”. Current Organic Chemistry. 10 (8): 825—847. doi:10.2174/138527206776894410.
- ^ а б Mendel Friedman (2006). „Potato Glycoalkaloids and Metabolites: Roles in the Plant and in the Diet”. J. Agric. Food Chem. 54 (23): 8655—8681. doi:10.1021/jf061471t.
- ^ а б Defrates, LJ; Hoehns, JD; Sakornbut, EL; Glascock, DG; Tew, AR (2005). „Antimuscarinic intoxication resulting from the ingestion of moonflower seeds”. The Annals of pharmacotherapy. 39 (1): 173—6. PMID 15572604. doi:10.1345/aph.1D536.
- ^ а б Hallen, H.; Luo; J.S. Scott-Craig; J.D. Walton (2007). „A gene family encoding the major toxins of lethal Amanita mushrooms.”. Proceedings of the National Academy of Sciences of the United States of America. 104 (48): 19097—19101. PMC 2141914
 . PMID 18025465. doi:10.1073/pnas.0707340104.
. PMID 18025465. doi:10.1073/pnas.0707340104.
- ^ а б Vetter, J (1998). „Toxins of Amanita phalloides”. Toxicon. 36 (1): 13—24. PMID 9604278. doi:10.1016/S0041-0101(97)00074-3.
- ^ а б Holmes, CF; Maynes, JT; Perreault, KR; Dawson, JF; James, MN (2002). „Molecular enzymology underlying regulation of protein phosphatase-1 by natural toxins”. Current medicinal chemistry. 9 (22): 1981—9. PMID 12369866. doi:10.2174/0929867023368827.
- ^ а б Bischoff, K (2001). „The toxicology of microcystin-LR: occurrence, toxicokinetics, toxicodynamics, diagnosis and treatment”. Veterinary and human toxicology. 43 (5): 294—7. PMID 11577938.
- ^ а б Waghmare; Chougule P.; Kanase A. (2004). „Extract of Ricinus communis leaves mediated alterations in liver and kidney functions against single dose of CCl
4 induced liver necrosis in albino rats.”. Journal of Ecophysiology and Occupational Health. 4 (3—4): 169—173. ISSN 0972-4397.|first1=zahteva|last1=u Authors list (pomoć) - ^ а б Sabina E.P.; Rasool M.K.; Mathew L.; Parameswari (2009). „Studies on the protective effect of Ricinus communis leaves extract on carbon tetrachloride hepatotoxicity in albino rats”. Pharmacologyonline. 2: 905—916. ISSN 1827-8620.
- ^ а б Anuradha; Parameswari C.S. (2003). „Protective effect of Ricinus communis leaf extract against paracetamol-induced hepatotoxicity”. Biomedicine. 23 (1—2): 97—105.
|first1=zahteva|last1=u Authors list (pomoć) - ^ а б Henrissat B, Callebaut I, Mornon JP, Fabrega S, Lehn P, Davies G (1995). „Conserved catalytic machinery and the prediction of a common fold for several families of glycosyl hydrolases”. Proc. Natl. Acad. Sci. U.S.A. 92 (15): 7090—7094. PMC 41477
 . PMID 7624375. doi:10.1073/pnas.92.15.7090.
. PMID 7624375. doi:10.1073/pnas.92.15.7090.
- ^ а б Henrissat B, Davies G (1995). „Structures and mechanisms of glycosyl hydrolases”. Structure. 3 (9): 853—859. PMID 8535779. doi:10.1016/S0969-2126(01)00220-9.
- ^ а б Hartley, MR; Lord, JM (2004). „Cytotoxic ribosome-inactivating lectins from plants”. Biochimica et Biophysica Acta. 1701 (1—2): 1—14. PMID 15450171. doi:10.1016/j.bbapap.2004.06.004.
- ^ а б Angelique Y. Louie; Thomas J. Meade (1999). „Metal Complexes as Enzyme Inhibitors”. Chem. Rev. 99: 2711—2734. doi:10.1021/cr9804285.
- ^ а б Waldron, K. J.; Robinson, N. J. (2009). „How do bacterial cells ensure that metalloproteins get the correct metal?”. Nat. Rev. Microbiol. 7 (1): 25—35. PMID 19079350. doi:10.1038/nrmicro2057.
- ^ а б Thomson, A. J.; Gray, H. B. (1998). „Bioinorganic chemistry”. Current Opinion in Chemical Biology. 2: 155—158. doi:10.1016/S1367-5931(98)80056-2.
- ^ а б Banci, Lucia (2013). Sigel, Astrid; Sigel, Helmut; Sigel, Roland K. O., ur. Metallomics and the Cell. Springer. ISBN 978-94-007-5561-1. ISSN 1868-0402.
- ^ а б Shriver, D. F.; Atkins, P. W. (1999). „Chapter 19, Bioinorganic chemistry”. Inorganic chemistry (III izd.). Oxford University Press. ISBN 978-0-19-850330-9.
- ^ а б Lippard, S. J. (1994). Bertini, I.; Gray, H. B.; Lippard, S. J.; Valentine, J. S., ur. Bioinorganic Chemistry (PDF). Mill Valle, CA,: University Science Books.
- ^ а б Lippard, S. (1996). Sigel, A.; Sigel, H., ur. „Metal ions in Biology”. 32. New York: M. Dekker.
- ^ а б Aull, J. L. (1980). Interactions of anticancer drugs with enzymes. New York: Marcel Dekker. ISSN 0161-5149.
- ^ а б в г Mital, R.; Shah, G. M.; Srivastava, T. S.; Bhattacharya, R. K. (1992). „The effect of some new platinum (II) and palladium (II) coordination complexes on rat hepatic nuclear transcription in vitro”. Life Sci. 50: 781—790. PMID 1371326. doi:10.1016/0024-3205(92)90183-P.
- ^ а б в г Kelley, T. J.; Moghaddas, S.; Bose, R.; Basu, S. (1993). „Inhibition of immunopurified DNA polymerase-alpha from PA-3 prostate tumor cells by platinum (II) antitumor drugs”. Cancer Biochem. Biophys. 13: 135—146. PMID 8111727.
- ^ а б в г д Endo, T.; Takahashi, M.; Minami, M.; Yoshioka, M.; Saito, H.; Parvez, S. H. (1993). „Effects of anticancer drugs on enzyme activities and serotonin release from ileal tissue in ferrets”. Biogen. Amines. 9: 479—489. ISSN 0168-8561.
- ^ а б в г Ganeva, R. L.; Spassovska, N. C.; Genchev, D. D. J. (1991). „The effect of some platinum compounds on the activity of the CTP synthetase of Ehrlich ascites tumor cells: in vitro and in vivo studies”. Inorg. Biochem. 43: 717—722. PMID 1779227. doi:10.1016/0162-0134(91)80042-G.
- ^ а б в г Koch, T.; Gloddek, B. (1991). „Inhibition of adenylate-cyclase-coupled G protein complex by ototoxic diuretics and cis-platinum in the inner ear of the guinea pig”. Eur. Arch. Oto-Rhino-Laryngol. 248: 459—464. PMID 1662964. doi:10.1007/BF00627634.
- ^ а б в г д ђ Ho, B. T.; Huo, Y. Y.; Lee, J. H.; Levin, V. A. (1991). „Inhibition of adenylate cyclase by tetraplatin”. Anti-Cancer Drugs. 2: 267—268. PMID 1802021. doi:10.1097/00001813-1991.
- ^ а б в Rosen, M.; Figliomeni, M.; Simpkins, H. (1992). „The interaction of platinum antitumor drugs with mouse liver mitochondria”. Int. J. Exp. Pathol. 73: 61—74. ISSN 0959-9673. PMC 2002465
 .
.
- ^ а б в г д ђ е ж Wright, J. A.; Chan, A. K.; Choy, B. K.; Hurta, R. A. R.; McClarty, G. A.; Tagger, A. Y. (1990). „Regulation and drug resistance mechanisms of mammalian ribonucleotide reductase, and the significance to DNA synthesis”. Cell. Biol. 68: 1364—1371. PMID 2085432.
- ^ а б в г д ђ Oblender, M.; Carpentieri, U. (1990). „Effects of iron, copper and zinc on the activity of ribonucleotide reductase in normal and leukemic human lymphocytes”. Anticancer Res. 10: 123—128. PMID 2185685.
- ^ а б в г д ђ Myette, M. S.; Elford, H. L.; Chitambar, C. R. (1998). „Interaction of gallium nitrate with other inhibitors of ribonucleotide reductase: effects on the proliferation of human leukemic cells”. Cancer Lett. 129: 199—204. PMID 9719462. doi:10.1016/S0304-3835(98)00104-9.
- ^ а б в г д ђ Chitambar, C. R.; Narasimhan, J. (1991). „Targeting Iron-Dependent DNA Synthesis with Gallium and Transferrin-Gallium”. Pathobiology. 59: 3—10. PMID 1645976.
- ^ а б в г д ђ Chitambar, C. R.; Narasimhan, J.; Guy, J.; Sem, D. S.; O’Brien, W. J. (1991). „Inhibition of ribonucleotide reductase by gallium in murine leukemic L1210 cells”. Cancer Res. 51: 6199—6201. PMID 1933878.
- ^ а б в г Nocentini, G.; Federici, F.; Grifantini, M.; Barzi, A. (1992). „2,2'-Bipyridyl-6-carbothioamide and Its Ferrous Complex: Their in Vitro Antitumoral Activity Related to the Inhibition of Ribonucleotide Reductase R2 Subunit” (PDF). Pharmacol. Res. 25: 312—313. PMID 8416745.
- ^ а б в г д ђ Nocentini, G.; Barzi, A. (1996). „The 2,2′-Bipyridyl-6-carbothioamide copper (II) complex differs from the iron (II) complex in its biochemical effects in tumor cells, suggesting possible differences in the mechanism leading to cytotoxicity”. Biochem. Pharm. 52: 65—71. PMID 8678909. doi:10.1016/0006-2952(96)00139-6.
- ^ а б в г д ђ West, D. X.; Liberta, A. E. (1993). „The cytotoxicity of copper(II) complexes of heterocyclic thiosemicarbazones and 2-substituted pyridine N-oxides”. Coord. Chem. Rev. 123: 49— 71. PMID 8098234.
- ^ а б в г д ђ Monti, E.; Monzini, F.; Morazzoni, F.; Perletti, G.; Piccini, F. (1993). „Interaction of Cu(II) and Cu(II)-anthracycline complexes with protein kinase C. Spectromagnetic assessment of the inhibitory effect”. Inorg. Chim. Acta. 205: 181—184. doi:10.1016/S0020-1693(00)85536-X.
- ^ а б в г д ђ е ж Gopalakrishna, R.; Gundimeda, U.; Chen, Z. H. (1997). „Cancer-Preventive Selenocompounds Induce a Specific Redox Modification of Cysteine-Rich Regions in Ca2+- Dependent Isoenzymes of Protein Kinase C”. Arch. Biochem. Biophys. 348: 25—36. PMID 9390171. doi:10.1006/abbi.1997.0334.
- ^ а б в г Gopalakrishna, R.; Chen, Z. H.; Gundimeda, U. (1997). „Selenocompounds Induce a Redox Modulation of Protein Kinase C in the Cell, Compartmentally Independent from Cytosolic Glutathione: Its Role in Inhibition of Tumor Promotion”. Arch. Biochem. Biophys. 348: 37—48. PMID 9390172. doi:10.1006/abbi.1997.0335.
- ^ а б в г д ђ е ж Kuo, L. Y.; Liu, A. H.; Marks, T. J. (1996). Sigel, A.; Sigel, H., ur. Metal Ions in biological systems. 33. New York: M. Dekker.
- ^ а б в г д Harding, M. M.; Long, G. V. (1997). „Solution conformation of the antitumor drug streptonigrin”. Curr. Med. Chem. 4: 405—420. PMID 8230091. doi:10.1021/jm00073a003.
- ^ а б в г Perry, D. K.; Smyth, M. J.; Stennicke, H. R.; Salvesen, G. S.; Duriez, P.; Poiriez, G. G.; Hannun, Y. A. (1997). „Zinc Is a Potent Inhibitor of the Apoptotic Protease, Caspase-3 - A novel target for zink in the inhibition of apoptosis”. J. Biol. Chem. 30: 18530—18533. PMID 9228015. doi:10.1074/jbc.272.30.18530.
- ^ а б в г Maret, W.; Jacob, C.; Vallee, B. L.; Fischer, E. H. (1999). „Inhibitory sites in enzymes: Zinc removal and reactivation by thionein”. Proc. Natl. Acad. Sci. 96: 1936—1940. PMID 10051573. doi:10.1073/pnas.96.5.1936.
- ^ а б в г Shlyakhovenko, V. A.; Milinevskaya, V. A.; Zagorujko, L. I.; Yanish, Y. V.; Kozak, V. V.; Kokozey, V. N.; Chernova, A. S. (1997). „Antitumor activity of some gallium-containing coordination compounds”. Exp. Oncol. 19: 348—352. ISSN 0204-3564.
- ^ а б в г д ђ Morinville, A.; Maysinger, D.; Shaver, A. (1998). „From Vanadis to Atropos: vanadium compounds as pharmacological tools in cell death signalling”. Trends Pharmacol. Sci. 19: 452—460. PMID 9850609. doi:10.1016/S0165-6147(98)01257-7.
- ^ а б в г Faure, R.; Vincent, M.; Dufour, M.; Shaver, A.; Posner, B. I. J. (1995). „Arrest at the G2/M transition of the cell cycle by protein-tyrosine phosphatase inhibition: Studies on a neuronal and a glial cell line”. Cell Biochem. 58: 389—401. PMID 8567756. doi:10.1002/jcb.240590310.
- ^ а б в г Zhuo, S.; Dixon, J. E. (1997). „Effects of sulfhydryl regents on the activity of lambda Ser/Thr phosphoprotein phosphatase and inhibition of the enzyme by zinc ion”. Protein Eng. 10: 1445—1452. PMID 9543006.
- ^ а б в г д ђ Cha, J.; Pedersen, M. V.; Auld, D. S. (1996). „Metal and pH dependence of heptapeptide catalysis by human matrilysin”. Biochemistry. 35: 15831—13838. PMID 8961947. doi:10.1021/bi962085f.
- ^ а б в г Nocentini, G.; Barzi, A. (1997). „Antitumor activity of 2,2′-bipyridyl-6-carbothioamide: a ribonucleotide reductase inhibitor”. Gen. Pharmac. 29: 701—706. PMID 9347313. doi:10.1016/S0306-3623(97)00011-6.
- ^ а б Byrnes, R. W.; Mohan, M.; Antholine, W. E.; Xe, R. X.; Petering, D. H. (1990). „Oxidative stress induced by a copper-thiosemicarbazone complex”. Biochemistry. 29: 7046—7053. PMID 2171640. doi:10.1021/bi00482a014.
- ^ а б Hubbard, S. R.; Bishop, W. R.; Kirschmeier, P.; George, S. J.; Cramer, S. P.; Hendrickson, W. A. (1991). „Identification and characterization of zinc binding sites in protein kinase C”. Science. 254: 1776—1779. PMID 1763327. doi:10.1126/science.1763327.
- ^ а б в г V. Ashutosh Raocorresponding (10. 03. 2013). „Iron Chelators with Topoisomerase-Inhibitory Activity and Their Anticancer Applications”. Antioxid Redox Signal. 18 (8): 930—955. PMC 3557438
 . doi:10.1089/ars.2012.4877.
. doi:10.1089/ars.2012.4877.
- ^ а б Köpf-Maier, P.; Köpf, H. (1987). „Non-platinum group metal antitumor agents. History, current status, and perspectives”. Chem. Rev. 87: 1137—1152. doi:10.1021/cr00081a012.
- ^ а б в г Harding, M. M.; Prodigalidad, M.; Lynch, M. J. (1996). „Organometallic Anticancer Agents. 2. Aqueous Chemistry and Interaction of Niobocene Dichloride with Nucleic Acid Constituents and Amino Acids”. J. Med. Chem. 39: 5012—5016. PMID 8960562. doi:10.1021/jm9603678.
- ^ а б Harding, M. M.; Mokdsi, G.; Mackay, J. P.; Prodigalidad, M.; Lucas, C. W. (1998). „Interactions of the Antitumor Agent Molybdocene Dichloride with Oligonucleotides”. Inorg. Chem. 37: 2432—2437. doi:10.1021/ic971205k.
- ^ а б в Takahashi, A.; Alnemri, E. S.; Lazebnik, Y. A.; Fernandes-Alnemri, T.; Litwack, G.; Moir, R. D.; Goldman, R. D.; Poirier, G. G.; Kaufmann, S. G.; Earnshaw, W. C. (1996). „Cleavage of lamin A by Mch2 alpha but not CPP32: multiple interleukin 1 beta-converting enzyme-related proteases with distinct substrate recognition properties are active in apoptosis”. PNAS. 93: 8395—8400. PMID 38682.
- ^ а б Krynetskaya, N. F.; Kubareva, E. A.; Timchenko, M. A.; Belkov, V. M.; Shabarova, Z. A. (1998). „Transition-metal complexes as inhibitors of proteins recognizing double-stranded fragments of nucleic acids”. Biochemistry (Moscow). 63: 1068—1073. PMID 9795277.
- ^ а б Shao, H. S.; Meinken, G. E.; Srivastava, S. C.; Slosman, D.; Slacker, D. F.; Som, P.; Brill, A. B. (1986). „In-vitro and in-vivo characterization of ruthenium-bleomycin compared to cobalt- i copper-BLEOMYC” (PDF). J. Nucl. Med. 27: 1044—1045.
- ^ а б Scheich, L. A.; Gosling, P.; Brown, S. J.; Olmstead, M. M.; Mascharak, P. K. (1991). „Synthetic analog approach to metallobleomycins: possibility of coordination of the carboxamide group of the .beta.-aminoalaninamide moiety of bleomycin to copper in copper(II) bleomycin at physiological pH”. Inorg. Chem. 30: 1677—1680. doi:10.1021/ic00007a052.
- ^ а б в г Sacerdoti D, Escalante B, Abraham NG, McGiff JC, Levere RD, Schwartzman ML (1989). „Treatment with Tin Prevents the Development of Hypertension in Spontaneously Hypertensive Rats”. Science. 243: 388—90. PMID 2492116.
- ^ а б в г д Maines, M.; Trakshel, G. (1992). „Tin-protoporphyrin: a potent inhibitor of hemoprotein-dependent steroidogenesis in rat adrenals and testes”. J. Pharmacol. Exp. Ther. 260: 909—916. PMID 1371161.
- ^ а б в г д Trakshel, G.; Sluss, P.; Maines, M. (1992). „Comparative effects of tin- and zinc-protoporphyrin on steroidogenesis: tin-protoporphyrin is a potent inhibitor of cytochrome P-450-dependent activities in the rat adrenals”. Pediatr. Res. 31: 196—201. PMID 1542552. doi:10.1203/00006450-199202000-00022.
- ^ а б в Maines, M.; Trakshel, G. (1992). „Differential regulation of heme oxygenase isozymes by Sn- and Zn-protoporphyrins: possible relevance to suppression of hyperbilirubinemia”. Biochim. Biophys. Acta. 1131: 166—174. PMID 1610897. doi:10.1016/0167-4781(92)90072-8.
- ^ а б в Böni, R. E.; Boni, R. A.; Galbraith, R. A.; Drummond, G. S.; Kappas, A. (1993). „Tin-mesoporphyrin inhibits heme oxygenase activity and heme-iron absorption in the intestine”. Pharmacology. 47: 318—329. PMID 8265722.
- ^ а б в Robert A. Johnson; Manuel Lavesa; Bardia Askari; Nader G. Abraham; Alberto Nasjletti (1995). „A Heme Oxygenase Product, Presumably Carbon Monoxide, Mediates a Vasodepressor Function in Rats”. Hypertension. 25: 166—169. PMID 7843765. doi:10.1161/01.HYP.25.2.166.
- ^ а б в Russo, S.; Pepe, J.; Donohue, S.; Cable, E.; Lambrecht, R.; Bonkovsy, H. (1995). „Tissue distribution of zinc-mesoporphyrin in rats: relationship to inhibition of heme oxygenase”. J. Pharmacol. Exp. Ther. 272: 766—774. PMID 7853192.
- ^ а б в г Keino, H.; Banno, T.; Mimura, S.; Kashiwamata, S. (1993). „Cobalt-Mesoporphyrin Inhibits Heme Oxygenase Activity but It Does Not Induce Lipid Peroxidation in Rat Brain Membranes during Photoirradiation”. Biol. Neonate. 63: 285—289. PMID 8353156. doi:10.1159/000243943.
- ^ а б в г Vallier, H.; Rodgers, P.; Stevenson, D. (1993). „Inhibition of heme oxygenase after oral vs intraperitoneal administration of chromium porphyrins”. Life Sci. 52: PL79—PL84. PMID 8445977. doi:10.1016/0024-3205(93)90521-4.
- ^ а б в Drummond, G.; Rosenberg, D.; Kappas, A. (1992). „Intestinal heme oxygenase inhibition and increased biliary iron excretion by metalloporphyrins”. Gastroenterology. 102: 1170—1175. PMID 1551526. doi:10.1016/0016-5085(92)70011-Y.
- ^ а б в г Galbraith, R.; Drummond, G.; Kappas, A. (1992). „Suppression of Bilirubin Production in the Crigler-Najjar Type I Syndrome: Studies with the Heme Oxygenase Inhibitor Tin-Mesoporphyrin”. Pediatrics. 89: 175—182. PMID 1734381.
- ^ а б в Angelique Y. Louie; Thomas J. Meade (1999). „Metal Complexes as Enzyme Inhibitors”. Chemical Reviews. 99 (9): 2711—2734. doi:10.1021/cr9804285.
- ^ Cannon, J. B. (1993). „Pharmaceutics and drug delivery aspects of heme and porphyrin therapy”. J. Pharm. Sci. 82: 435—446. PMID 8360819. doi:10.1002/jps.2600820502.
- ^ а б Tsangaris, J. M.; Williams, D. R. (1992). „Tin in pharmacy and nutrition”. Appl. Organomet. Chem. 6: 3—18. PMID 11192741. doi:10.1002/aoc.590060103.
- ^ Marks, J. A.; Maines, M. D. (1992). „Tin-Protoporphyrin-Mediated Disruption In Vivo of Heme Oxygenase-2 Protein Integrity and Activity in Rat Brain” (PDF). Pediatr. Res. 32: 324—329. PMID 1408470. doi:10.1203/00006450-199209000-00016.
- ^ Hintz, S. R.; Vreman, H. J.; Stevenson, D. K. (1990). „Mortality of metalloporphyrin-treated neonatal rats after light exposure”. Dev. Pharmacol. 14: 187—192. PMID 2364856.
- ^ Cable, E.; Cable, J.; Bonkovsky, H. (1993). „Repression of hepatic δ-aminolevulinate synthase by heme and metalloporphyrins: Relationship to inhibition of heme oxygenase”. Hepatology. 18: 119—127. PMID 8325603. doi:10.1002/hep.1840180119.
- ^ Lathrop, J. T.; Timko, M. P. (1993). „Regulation by heme of mitochondrial protein transport through a conserved amino acid moti”. Science. 259: 522—525. PMID 8424176. doi:10.1126/science.8424176.
- ^ Bhasker, C. R.; Burgiel, G.; Neupert, B.; Emery-Goodman, A.; Kuhn, L. C.; May, B. K. (1993). „The Putative Iron-Responsive Element in the Human Erythroid 5-Aminolevulinate Synthase mRNA Mediates Translational Control” (PDF). JBC. 268: 12699—12705. PMID 8509404.
- ^ а б Serfass, L.; Burstyn, J. (1998). „Effect of heme oxygenase inhibitors on soluble guanylyl cyclase activity”. Arch. Biochem. Biophys. 359: 8—16. PMID 9799554. doi:10.1006/abbi.1998.0887.
- ^ а б Luo, D.; Vincent, S. (1994). „Metalloporphyrins inhibit nitric oxide-dependent cGMP formation in vivo”. Eur. J. Pharmacol.-Mol. Pharmacol. Sec. 267: 263—267. PMID 7522180. doi:10.1016/0922-4106(94)90149-X.
- ^ а б в г д Mariotto, S.; Cuzzolin, L.; Adami, A.; DelSoldato, P.; Suzuki, H.; Benoni, G. (1995). „Inhibition by sodium nitroprusside of the expression of inducible nitric oxide synthase in rat neutrophils”. Brit. J. Pharmacol. 114: 1105—1106. PMID 7542530. doi:10.1111/j.1476-5381.1995.tb13320.x.
- ^ а б Vickroy, T.; Malphurs, W. (1995). „Inhibition of nitric oxide synthase activity in cerebral cortical synaptosomes by nitric oxide donors: evidence for feedback autoregulation”. Neurochem. Res. 20: 299—304. PMID 7541898. doi:10.1007/BF00969546.
- ^ а б в Perry, J.; Marletta, M. (1998). „Effects of transition metals on nitric oxide synthase catalysis”. PNAS. 95: 11101—11106. PMID 9736696. doi:10.1073/pnas.95.19.11101.
- ^ а б Persechini A, McMillan K, Masters BS (1995). „Inhibition of Nitric Oxide Synthase Activity by Zn2+ Ion”. Biochemistry. 34: 15091—15095. PMID 7578122. doi:10.1021/bi00046a015.
- ^ а б Siegfried, G.; Amiel, C.; Friedlander, G. (1996). „Inhibition of Ecto-5′-nucleotidase by Nitric Oxide Donors”. J. Biol. Chem. 271: 4659—4664. PMID 8617729.
- ^ а б в Thomas, S.; Mohr, D.; Stocker, R. (1994). „Nitric oxide inhibits indoleamine 2,3-dioxygenase activity in interferon-gamma primed mononuclear phagocytes” (PDF). J. Biol. Chem. 269: 14457—14464. PMID 7514170.
- ^ а б в г Nicolaou, A.; Waterfield, C.; Kenyon, S.; Gibbons, W. (1997). „The Inactivation of Methionine Synthase in Isolated Rat Hepatocytes by Sodium Nitroprusside”. Eur. J. Biochem. 244: 8876—882. PMID 9108260. doi:10.1111/j.1432-1033.1997.00876.x.
- ^ а б Sato, T.; Kamata, Y.; Irifune, M.; Nishikawa, T. (1995). „Inhibition of purified (Na+,K+)-ATPase activity from porcine cerebral cortex by NO generating drugs”. Brain Res. 704: 117—120. PMID 8750971. doi:10.1016/0006-8993(95)01165-X.
- ^ Bredt, D. S.; Snyder, S. H. (1992). „Nitric oxide, a novel neuronal messenger”. Neuron. 8: 3—11. PMID 1370373. doi:10.1016/0896-6273(92)90104-L.
- ^ Jaffrey, S. R.; Snyder, S. H. (1996). „PIN: An associated protein inhibitor of neuronal nitric oxide synthase”. Science. 274: 774—777. PMID 8864115. doi:10.1126/science.274.5288.774.
- ^ а б Marletta, M. A. (1994). „Nitric oxide synthase: Aspects concerning structure and catalysis” (PDF). Cell. 78: 927—930. PMID 7522970. doi:10.1016/0092-8674(94)90268-2.
- ^ а б Moore, P. K.; Handy, R. L. C. (1997). „Selective inhibitors of neuronal nitric oxide synthase – is no NOS really good NOS for the nervous system?”. Trends Pharm. Sci. 18: 204— 211. PMID 9226999. doi:10.1016/S0165-6147(97)01064-X.
- ^ Bredt, D. S.; Snyder, S. H. (1990). „Isolation of nitric oxide synthetase, a calmodulin-requiring enzyme”. PNAS. 87: 682—685. PMID 1689048. doi:10.1073/pnas.87.2.682.
- ^ а б Weiss, G.; Lutton, J.; Fuchs, D.; Wernerfelmayer, G.; Bock, G.; Abraham, N.; Kappas, A.; Levere, R.; Wachter, H. (1993). „Comparative Effects of Heme and Metalloporphyrins on Interferon-γ-Mediated Pathways in Monocytic Cells (THP-1)”. Proc. Soc. Exp. Biol. Med. 202: 470—475. PMID 8456113. doi:10.3181/00379727-202-43561.
- ^ а б Meffert, M.; Haley, J.; Schulman, E.; Schulman, H.; Madison, D. (1994). „Inhibition of hippocampal heme oxygenase, nitric oxide synthase, and long-term potentiation by metalloporphyrins”. Neuron. 13: 1225—1233. PMID 7524564. doi:10.1016/0896-6273(94)90060-4.
- ^ а б Bing, O.; Grundemar, L.; Ny, L.; Moller, C.; Heilig, M. (1995). „Modulation of carbon monoxide production and enhanced spatial learning by tin protoporphyrin”. Neuroreport. 6: 1369—1372. PMID 7488726. doi:10.1097/00001756-199507100-00002.
- ^ а б в Pedregosa, J. C.; Casanova, J.; Alzuet, G.; Borras, J.; Garcia-Granda, S.; Diaz, M. R.; Guttierez-Rodriguez, A. (1995). „Metal complexes of 5-tertbutyloxycarbonylamido-1,3,4-thiadiazole-2-sulfonamide (B-H2ats), a carbonic anhydrase inhibitor. Synthesis and characterization of the copper(II) complex. Crystal structures of B-H2ats and the [Cu(B-ats)(NH3)2]2 dimer complex”. Inorg. Chim. Acta. 232: 117—124. doi:10.1016/0020-1693(94)04376-7.
- ^ а б Supuran, C. T.; Mincione, F.; Scozzafava, A.; Briganti, F.; Mincione, G.; Ilies, M. A. (1998). „Carbonic anhydrase inhibitors — Part 52. Metal complexes of heterocyclic sulfonamides: A new class of strong topical intraocular pressure-lowering agents in rabbits”. Eur. J. Med. Chem. 22: 247—254. doi:10.1016/S0223-5234(98)80059-7.
- ^ а б в Supuran CT, Scozzafava A, Saramet I, Banciu MD (1998). „Carbonic anhydrase inhibitors: inhibition of isozymes I, II and IV with heterocyclic mercaptans, sulfenamides, sulfonamides and their metal complexes”. J. Enzyme Inhib. 13: 177—194. PMID 9629536. doi:10.3109/14756369809028339.
- ^ а б Turkmen H, Durgun M, Yilmaztekin S, Emul M, Innocenti A, Vullo D, Scozzafava A, Supuran CT (1997). „Carbonic anhydrase inhibitors. Part 50. Interaction of isoenzymes I and II of carbonic anhydrase with Ge(IV) and Sb(III) derivatives”. Main Group Met. Chem. 20: 641—647. PMID 15603956. doi:10.1016/j.bmcl.2004.10.070.
- ^ а б Supuran, C. T. (1996). „Complexes with biologically active ligands. Part 3. Synthesis of coordination compounds of chlorothiazide with divalent metal ions”. Main Group Met. Chem. 19: 347—353. doi:10.1515/MGMC.1996.19.6.339.
- ^ а б Koppenho¨fer, A.; Hartmann, U.; Vahrenkamp, H. (1995). „Zinc Complexes of Drugs Containing Nitrogen Heterocycles”. Chem. Ber. 128: 779—785. doi:10.1002/cber.19951280807.
- ^ а б Gonzalez, E. B.; Farkas, E.; Soudi, A. A.; Tan, T.; Yanovsky, A. I.; Nolan, K. B. (1997). „Metal complexes of the angiotensin-converting enzyme inhibitor,lisinopril. Solution studies and the crystal and molecular structure ofa dimeric copper(II)-lisinopril complex”. J. Chem. Soc., Dalton Trans.: 2377—2379. doi:10.1039/A701500C.
- ^ а б Abrams MJ, Murrer BA (1993). „Metal compounds in therapy and diagnosis”. Science. 261: 725—730. PMID 8102010. doi:10.1126/science.8102010.
- ^ Sly WS, Hu PY (1995). „Human carbonic anhydrases and carbonic anhydrase deficiencies”. Annu. Rev. Biochem. 64: 375—401. PMID 7574487. doi:10.1146/annurev.bi.64.070195.002111.
- ^ Bergenhem, N. (1996). „Chromatographic and electrophoretic methods related to the carbonic anhydrase isozymes”. J. Chromatogr. B. 684: 289—305. PMID 8906478. doi:10.1016/0378-4347(95)00566-8.
- ^ Albert, D. M.; Jakobiec, F. M., ur. (1994). Principles and practice of ophthalmology. Philadelphia: W. B. Saunders. ISBN 978-0-7216-3416-6.
- ^ Heagerty, A. M. (1991). „Functional and structural effects of ACE inhibitors on the cardiovascular system”. Cardiology. 79: 3—9. PMID 1913721. doi:10.1159/000174899.
- ^ Kureya, P.; Beevers, D. G. (1991). „The mechanisms of hypertension and the role of ACE inhibitors”. J. Human Hypertension. 5: 3—8. PMID 1791616.
- ^ Pandurangi, R. S.; Katti, K. V.; Stillwell, L.; Barnes, C. L. (1998). „Retention of Inhibitory Potency of an ACE Inhibitor Conjugated with Rh(III) and Pd(II) (Iminophosphorano)phosphines. Synthesis and X-ray Structural Investigations”. J. Am. Chem Soc. 120: 11364—11373. doi:10.1021/ja9802403.
- ^ а б Bagger, S. (1993). „The binding of cobalt(III)-ligated amino acids and peptides to chymotrypsin and trypsin”. J. Inorg. Biochem. 52: 165—171. PMID 8254339.
- ^ а б в Bagger, S.; Wagner, K. J. (1998). „Molecular recognition of cobalt(III)-ligated peptides by serine proteases: the role of electrostatic effects”. Peptide Res. 52: 273—282. PMID 9832305. doi:10.1111/j.1399-3011.1998.tb01241.x.
- ^ а б Takeuchi, T.; Bottcher, A.; Quezada, C.; Simon, M.; Meade, T.; Gray, H. (1998). „Selective Inhibition of Human α-Thrombin by Cobalt(III) Schiff Base Complexes”. J. Am. Chem. Soc. 120: 8555—8556. doi:10.1021/ja981191x.
- ^ а б Böttcher, A.; Takeuchi, T.; Hardcastle, K.; Meade, T.; Gray, H.; Cwikel, D.; Kapon, M.; Dori, Z. (1997). „Spectroscopy and Electrochemistry of Cobalt(III) Schiff Base Complexes”. Inorg. Chem. 36: 2498—2504. doi:10.1021/ic961146v.
- ^ а б Takeuchi, T.; Böttcher, A.; Quezada, C. M.; Meade, T. J.; Gray, H. B. (1999). „Inhibition of thermolysin and human alpha-thrombin by cobalt(III) Schiff base complexes”. Bioorg. Med. Chem. 6: 1—5. PMID 10400334.
- ^ а б в Tsilikounas, E.; Kettner, C.; Bachovchin, W. (1992). „Identification of serine and histidine adducts in complexes of trypsin and trypsinogen with peptide and nonpeptide boronic acid inhibitors by proton NMR spectroscopy”. Biochemistry. 31: 12839—12846. PMID 1463754. doi:10.1021/bi00166a019.
- ^ а б в Tsilikounas, E.; Kettner, C.; Bachovchin, W. (1993). „Boron-11 NMR spectroscopy of peptide boronic acid inhibitor complexes of .alpha.-lytic protease. Direct evidence for tetrahedral boron in both boron-histidine and boron-serine adduct complexes”. Biochemistry. 32: 12651—12655. PMID 8251483. doi:10.1021/bi00210a013.
- ^ а б Suenaga, H.; Nakashima, K.; Shinkai, S. (1995). „Sugars intensify the inhibitory effect of phenylboronic acid on the hydrolytic activity of α-chymotrypsin”. J. Chem. Soc., Chem. Commun.: 29—30. doi:10.1039/C39950000029.
- ^ а б Katz, B.; Finermoore, J.; Mortezaei, R.; DH, R.; Stroud, R. (1995). „Episelection: Novel Ki .apprx. Nanomolar Inhibitors of Serine Proteases Selected by Binding or Chemistry on an Enzyme Surface”. Biochemistry. 34: 8264—8280. doi:10.1021/bi00026a008.
- ^ а б Geratz, J.; Tidwell, R.; Schwab, J.; Anderle, S.; Pryzwansky, K. (1990). „Sequential events in the pathogenesis of streptococcal cell wall-induced arthritis and their modulation by bis(5-amidino-2-benzimidazolyl)methane (BABIM)”. Am. J. Pathol. 136: 909—921. PMID 2327474.
- ^ а б в г Katz, B.; Clark, J.; Finer-Moore, J.; Jenkins, T.; Johnson, C.; Ross, M.; Luong, C.; Moore, W.; Stroud, R. (1998). „Design of potent selective zinc-mediated serine protease inhibitors”. Nature. 391: 608—612. PMID 9468142. doi:10.1038/35422.
- ^ а б Rice, K.; Tanaka, R.; Katz, B.; Numerof, R.; Moore, W. (1998). „Inhibitors of tryptase for the treatment of mast cell-mediated diseases”. Curr. Pharm. Des. 4: 381—396. PMID 10197050.
- ^ а б в Thorpe, H. H. (1998). „Bioinorganic chemistry and drug design: here comes zinc again”. Chem. Biol. 5: R125—R127. PMID 9653544. doi:10.1016/S1074-5521(98)90166-1.
- ^ а б в г Duffy, B.; Schwietert, C.; France, A.; Mann, N.; Culbertson, K.; Harmon, B.; McCue, J. P. (1998). „Transition metals as protease inhibitors”. Biol. Trace Element Res. 64: 197—213. PMID 9845474. doi:10.1007/BF02783336.
- ^ а б в г Thayer, J. S. (1984). Organometallic compounds and living organisms. New York: Academic Press. ISBN 978-0-12-686080-1.
- ^ а б в Babine, R. E.; Bender, S. L. (1997). „Molecular Recognition of Protein−Ligand Complexes: Applications to Drug Design”. Chem. Rev. 97: 1359—1472. PMID 11851455. doi:10.1021/cr960370z.
- ^ Bone, R.; Frank, D.; Kettner, C. A.; Agard, D. A. (1989). „Structural analysis of specificity: .alpha.-lytic protease complexes with analogs of reaction intermediates”. Biochemistry. 28: 7600—7609. PMID 2611204. doi:10.1021/bi00445a015.
- ^ Louie, A. Y.; Meade, T. J. (1998). „A cobalt complex that selectively disrupts the structure and function of zinc fingers”. PNAS. 95: 6663—6668. PMID 9618469. doi:10.1073/pnas.95.12.6663.
- ^ а б Mork, A. (1993). „Actions of Lithium on the Cyclic AMP Signalling System in Various Regions of the Brain - Possible Relations to its Psychotropic Actions -: A Study on the Adenylate Cyclase in Rat Cerebral Cortex, Corpus Striatum and Hippocampus”. Pharmacol. Toxicol. 71: 1—47. doi:10.1111/j.1600-0773.1993.tb01704.x.
- ^ а б в г Clauberg, M.; Joshi, J. G. (1993). „Regulation of serine protease activity by aluminum: implications for Alzheimer disease”. Proc. Natl. Acad. Sci. U.S.A. 90: 1009—1012. PMID 7679214.
- ^ а б Rao, K. S. J.; Rao, G. V. (1994). „Effect of aluminium (Al) on brain mitochondrial monoamine oxidase-A (MAO-A) activity--an in vitro kinetic study”. Mol. Cell. Biochem. 137: 57—60. PMID 7845378. doi:10.1007/BF00926039.
- ^ а б в г Nixon, R. A.; Clarke, J. F.; Logvinenko, K. B.; Tan, M. K. H.; Hoult, M.; Grynspan, F. (1990). „Aluminum inhibits calpain-mediated proteolysis and induces human neurofilament proteins to form protease-resistant high molecular weight complexes”. J. Neurochem. 55: 1950—1959. PMID 2121904. doi:10.1111/j.1471-4159.1990.tb05781.x.
- ^ а б в г д Joshi, J. G.; Dhar, M.; Clauberg, M.; Chauthaiwale, V. (1994). „Iron and aluminum homeostasis in neural disorders”. Environ. Health Perspect. 102: 207—213. PMID 7843099. doi:10.2307/3431788.
- ^ а б Lee, B. H.; Park, M. B.; Yu, B. S. (1998). „Inhibition of electric eel acetylcholinesterase by porphin compounds”. Bioinorg. Med. Chem. Lett. 8: 1467—1470. PMID 9873371. doi:10.1016/S0960-894X(98)00236-4.
- ^ а б Falkous, G.; Harris, J. B.; Mantle, D. (1995). „Effect of neurotoxic metal ions in vitro on proteolytic enzyme activities in human cerebral cortex”. Clin. Chim. Acta. 238: 125—135. PMID 7586572. doi:10.1016/0009-8981(95)06081-N.
- ^ а б в г Cuajungco, M. P.; Lees, G. K. (1997). „Zinc metabolism in the brain: relevance to human neurodegenerative disorders”. Neurobiol. Dis. 4: 137—169. PMID 9361293. doi:10.1006/nbdi.1997.0163.
- ^ Hay, R. W. (1984). Bio-inorganic Chemistry. New York: Ellis Horwood Limited. ISBN 978-0-85312-200-5.
- ^ а б в Atwood, C. S.; Moir, R. D.; Huang, X. D.; Scarpa, R. C.; Bacarra, N. M. E.; Romano, D. M.; Hartshorn, M. K.; Tanzi, R. E.; Bush, A. I. (1998). „Dramatic aggregation of Alzheimer abeta by Cu(II) is induced by conditions representing physiological acidosis”. J. Biol. Chem. 273: 12817—12826. PMID 9582309. doi:10.1074/jbc.273.21.12817.
- ^ а б в Fitzgerald, D. J.; Maggio, J. E.; Esler, W. P.; Stinson, E. R.; Jennings, J. M.; Ghilardi, J. R.; Mantyh, P. W.; Bush, A. I.; Moir, R. D.; Rosenkranz, K. M.; Tanzi, R. E. (1995). „Zinc and Alzheimer's disease”. Science. 268: 1920—1923. PMID 7604268.
- ^ Mantyh, P. W.; Ghilardi, J. R.; Rogers, S.; Demaster, E.; Allen, C. J.; Stimson, E. R.; Maggio, J. E. (1993). „Aluminum, iron, and zinc ions promote aggregation of physiological concentrations of beta-amyloid peptide”. J. Neurochem. 61: 1171—1174. PMID 8360682. doi:10.1111/j.1471-4159.1993.tb03639.x.
- ^ а б Huang, X. D.; Atwood, C. S.; Moir, R. D.; Hartshorn, M. A.; Vonsattel, J. P.; Tanzi, R. E.; Bush, A. I. (1997). „Zinc-induced Alzheimer's Abeta1-40 aggregation is mediated by conformational factors”. J. Biol. Chem. 272: 26464—26470. PMID 9334223. doi:10.1074/jbc.272.42.26464.
- ^ а б Bush, A. I.; Pettingell, W. H.; Multhaup, G.; Paradis, M. D.; Vonsattel, J. P.; Gusella, J. F.; Beyreuther, K.; Masters, C. L.; Tanzi, R. E. (1994). „Rapid induction of Alzheimer A beta amyloid formation by zinc”. Science. 265: 1464—1467. PMID 8073293.
- ^ Dyrks, T.; Dyrks, E.; Hartmann, T.; Masters, C.; Beyreuther, K. (1992). „Amyloidogenicity of beta A4 and beta A4-bearing amyloid protein precursor fragments by metal-catalyzed oxidation” (PDF). J. Biol. Chem. 267: 18210—18217. PMID 1517249.
- ^ Bondy, S. C.; Guo-Ross, S. X.; Truong, A. T. (1998). „Promotion of transition metal-induced reactive oxygen species formation by beta-amyloid”. Brain Res. 799: 91—96. PMID 9666089. doi:10.1016/S0006-8993(98)00461-2.
- ^ Cuajungco, M. P.; Lees, G. (1997). „Zinc and Alzheimer's disease: is there a direct link?”. J. Brain Res. Rev. 23: 219—236. PMID 9164672. doi:10.1016/S0165-0173(97)00002-7.
- ^ Sugumoto, H.; Iimura, Y.; Yamanishi, Y.; Yamatsu, K. (1995). „Synthesis and structure-activity relationships of acetylcholinesterase inhibitors: 1-benzyl-4-[(5,6-dimethoxy-1-oxoindan-2-yl)methyl]piperidine hydrochloride and related compounds”. J. Med. Chem. 38: 4821—4829. PMID 7490731. doi:10.1021/jm00024a009.
- ^ а б Danning, C. L.; Boumpas, D. T. (1998). „Commonly used disease-modifying antirheumatic drugs in the treatment of inflammatory arthritis: an update on mechanisms of action”. Clin. Exp. Rheumatol. 16: 595—604. PMID 9779311.
- ^ а б Hashimoto, K.; Whitehurst, C. E.; Matsubara, T.; Hirohata, K.; Lipsky, P. E. (1992). „Immunomodulatory effects of therapeutic gold compounds. Gold sodium thiomalate inhibits the activity of T cell protein kinase C”. J. Clin. Invest. 89: 1839—1848. PMID 1351061. doi:10.1172/JCI115788.
- ^ а б в Rajendran, K. G.; Sood, A.; Spielvogel, B. F.; Hall, I. H.; III, V. M. N.; Morse, K. W. (1995). „Anti-Osteoporotic activity of metal complexes of amine carboxyboranes”. Appl. Organomet. Chem. 9: 111—119. doi:10.1002/aoc.590090204.
- ^ Zhang, Z. Y.; Reardon, I. M.; Hui, J. O.; O’Connell, K. L.; Poorman, R. A.; Heinrikson, R. L. (1991). „Zinc inhibition of renin and the protease from human immunodeficiency virus type 1”. Biochemistry. 30: 8717—8721. PMID 1888732. doi:10.1021/bi00100a001.
- ^ а б в Hall, I. H.; Chen, S. Y.; Rajendran, K. G.; Sood, A.; Spielvogel, B. F.; Shih, J. (1994). „Hypolipidemic, anti-obesity, anti-inflammatory, anti-osteoporotic, and anti-neoplastic properties of amine carboxyboranes”. Environ. Health Perspect. 102: 21—30. PMID 7889876. doi:10.2307/3431958.
- ^ Pugh, M. C.; Pugh, C. B. (1987). „Current concepts in clinical therapeutics: disease-modifying drugs for rheumatoid arthritis”. Clin. Pharm. 6: 475—491. PMID 3319362.
- ^ Baker, D. G.; Rabinowitz, J. L. (1986). „Current concepts in the treatment of rheumatoid arthritis”. J. Clin. Pharmacol. 26: 2—21. PMID 3512617.
- ^ а б Sorenson, J. R. J. (1982). Sigel, H.; Marcel Dekker, ur. Metal ions in biological systems. 14. New York. ISBN 9780824715694.
- ^ Naughton, D. P.; Knappitt, J.; Fairburn, K.; Gaffney, K.; Blake, D. R.; Grootveld, M. (1995). „Detection and investigation of the molecular nature of low-molecular-mass copper ions in isolated rheumatoid knee-joint synovial fluid”. FEBS Lett. 362: 167—172. PMID 7698317. doi:10.1016/0014-5793(95)00165-6.
- ^ Miche, H.; Brumas, V.; Berthon, G. (1997). „Copper(II) interactions with nonsteroidal antiinflammatory agents. II. Anthranilic acid as a potential. OH-inactivating ligand”. J. Inorg. Biochem. 68: 27—38. PMID 9379178. doi:10.1016/S0162-0134(97)00005-6.
- ^ Menard, H. A.; Amine, M. E. (1996). „The calpain-calpastatin system in rheumatoid arthritis”. Immunol. Today. 17: 545—547. PMID 8991283. doi:10.1016/S0167-5699(96)30064-9.
- ^ Zhang, H.; Johnson, P. (1992). „Differential effects of aluminum ion on smooth muscle calpain I and calpain II activities”. Int. J. Biochem. 24: 1773—1778. PMID 1451912. doi:10.1016/0020-711X(92)90127-M.
- ^ Frolich, J. C. (1997). „A classification of NSAIDs according to the relative inhibition of cyclooxygenase isoenzymes”. Trends Pharm. Sci. 18: 30—34. PMID 9114728. doi:10.1016/S0165-6147(96)01017-6.
- ^ а б Moore, P.; Jones, C.; Mahmood, N.; Evans, I.; Goff, M.; Cooper, R.; Hay, A. (1995). „Anti-(human immunodeficiency virus) activity of polyoxotungstates and their inhibition of human immunodeficiency virus reverse transcriptase” (PDF). Biochem. J. 307: 129—134. PMID 7536411.
- ^ а б Casas, J.; Rodriguez-Arguelles, M.; Russo, U.; Sanchez, A.; Sordo, J.; Vazquez-Lopez, A.; Pinelli, S.; Lunghi, P.; Bonati, A.; Albertini, R. (1998). „Diorganotin(IV) complexes of pyridoxal thiosemicarbazone: synthesis, spectroscopic properties and biological activity”. J. Inorg. Biochem. 69: 283—292. PMID 9654752. doi:10.1016/S0162-0134(98)00004-X.
- ^ а б Chamorro, C.; Camarasa, M. J.; Perez-Perez, M. J.; Clercq, E. D.; Balzarini, J.; Felix, A. S. (1998). „An approach towards the synthesis of potential metal-chelating TSAO-T derivatives as bidentate inhibitors of human immunodeficiency virus type 1 reverse transcriptase”. Antiviral Chem. Chemother. 9: 413—423. PMID 9875394.
- ^ а б Nacsa, J.; Nagy, L.; Molnar, J.; Molnar, J. (1998). „Trifluoperazine and its metal complexes inhibit the Moloney leukemia virus reverse transcriptase”. Anticancer Res. 18: 1373—1376. PMID 9673343.
- ^ а б в г Woon, T.; Brinkworth, R.; Fairlie, D. (1992). „Inhibition of HIV-1 proteinase by metal ions”. Int. J. Biochem. 24: 911—914. PMID 1612181. doi:10.1016/0020-711X(92)90096-J.
- ^ а б Davis, D. A.; Branca, A. A.; Pallenberg, A. J.; Marschner, T. M.; Patt, L. M.; Chatlynne, L. G.; Humphrey, R. W.; Yarchoan, R.; Levine, R. L. (1995). „Inhibition of the human immunodeficiency virus-1 protease and human immunodeficiency virus-1 replication by bathocuproine disulfonic acid Cu1+”. Arch. Biochem. Biophys. 322: 127—134. PMID 7574666. doi:10.1006/abbi.1995.1444.
- ^ а б York, D. M.; Darden, T. A.; Pedersen, L. G.; Anderson, M. W. (1993). „Molecular modeling studies suggest that zinc ions inhibit HIV-1 protease by binding at catalytic aspartates”. Environ. Health Perspect. 101: 246—250. PMID 8404763.
- ^ а б Lebon, F.; deRosny, E.; Reboud-Ravauz, M.; Durant, F. (1998). „De novo drug design of a new copper chelate molecule acting as HIV-1 protease inhibitor”. Eur. J. Med. Chem. 33: 733—737. doi:10.1016/S0223-5234(98)80032-9.
- ^ а б Mazumder, A.; Gupta, M.; Perrin, D. M.; Sigman, C. S.; Ranbinovitz, M.; Pommier, Y. (1995). „Update on long-term symptomless HIV type 1 infection in recipients of blood products from a single donor”. AIDS Res. Hum. Retroviruses. 11: 1. PMID 7734182. doi:10.1089/aid.1995.11.1.
- ^ а б Farnet, C. M.; Wang, B.; Hansen, M.; Lipford, J. R.; Zalkow, L.; Robinson, W. E. J.; Siegel, J.; Bushman, F. (1998). „Human immunodeficiency virus type 1 cDNA integration: new aromatic hydroxylated inhibitors and studies of the inhibition mechanism”. Antimicrob. Agents Chemother. 42: 2245—2253. PMID 9736543.
- ^ Perrin, D. D.; Stunzi, H. (1982). Metal ions and chelating agents in antiviral chemotherapy. New York: Marcel Dekker.
- ^ а б LaFemina, R. L.; Schneider, C. L.; Robbins, H. L.; Callahan, P. L.; LeGrow, K.; Roth, E.; Schleif, W. A.; Emini, E. A. (1992). „Requirement of active human immunodeficiency virus type 1 integrase enzyme for productive infection of human T-lymphoid cells”. J. Virol. 66: 7414—7419. PMID 1433523.
- ^ Tarrago-Litvak, L.; Andreola, M.; Nevinsky, G. A.; Sarih-Cottin, L.; Litvak, S. (1994). „The reverse transcriptase of HIV-1: from enzymology to therapeutic intervention”. FASEB J. 18: 497—503. PMID 7514143.
- ^ Huang, H.; Chopra, R.; Verdine, G. L.; Harrison, S. C. (1998). „Structure of a covalently trapped catalytic complex of HIV-1 reverse transcriptase: implications for drug resistance”. Science. 282: 1669—1675. PMID 9831551. doi:10.1126/science.282.5394.1669.
- ^ Ferrari, M. B.; Fava, G. G.; Tarasconi, R.; Albertini, S.; Pinelli, R.; Starcich, J. (1994). „Synthesis, spectroscopic and structural characterization, and biological activity of aquachloro (pyridoxal thiosemicarbazone) copper(II) chloride”. J. Inorg. Biochem. 53: 13. PMID 8133248. doi:10.1016/0162-0134(94)80017-0.
- ^ Das K, Bauman JD, Rim AS, Dharia C, Clark AD Jr, Camarasa MJ, Balzarini J, Arnold E (28. 04. 2011). „Crystal structure of tert-butyldimethylsilyl-spiroaminooxathioledioxide-thymine (TSAO-T) in complex with HIV-1 reverse transcriptase (RT) redefines the elastic limits of the non-nucleoside inhibitor-binding pocket”. J Med Chem. 54 (8): 2727—37. PMID 21446702. doi:10.1021/jm101536x.
- ^ Spence, R. A.; Kati, W. M.; Anderson, K. S.; Johnson, K. A. (1995). „Mechanism of inhibition of HIV-1 reverse transcriptase by nonnucleoside inhibitors”. Science. 267: 988—993. PMID 7532321. doi:10.1038/nsb0495-303.
- ^ West, M. L.; Fairlie, D. P. (1995). „Targeting HIV-1 protease: a test of drug-design methodologies”. Trends Pharmacol. Sci. 16: 67—75. PMID 7762084. doi:10.1016/S0165-6147(00)88980-4.
- ^ а б Wisniewski, M. Z.; Surga, W. J.; Piekos, R. (1995). „Silver(I) compounds of some sulfonamides”. Polish J. Chem. 69: 987—991.
- ^ а б в Serra, M.; Pintar, A.; Casella, L.; Sabbioni, E. (1992). „Vanadium effect on the activity of horseradish peroxidase, catalase, glutathione peroxidase, and superoxide dismutase in vitro”. J. Inorg. Biochem. 46: 161—174. PMID 1325536. doi:10.1016/0162-0134(92)80027-S.
- ^ Karlstrom, A. R.; Levine, R. L. (1991). „Copper inhibits the protease from human immunodeficiency virus 1 by both cysteine-dependent and cysteine-independent mechanisms” (PDF). PNAS. 88: 5552—5556. PMC 51915
 .
.
- ^ Hazuda, D. J.; Felock, P. J.; Hastings, J. C.; Prmanik, B.; Wolfe, A. L. (1997). „Differential divalent cation requirements uncouple the assembly and catalytic reactions of human immunodeficiency virus type 1 integrase” (PDF). J. Virol. 71: 7005—7011. PMID 9261430.
- ^ а б DeZwart, M.; vanderGoot, H.; Timmerman, H. (1991). „Influence of Co(II), Ni(II), Cu(II), Zn(II) and Cd(II) on growth inhibition and enzyme activity of Mycoplasma gallisepticum in the absence or presence of a 2,2′-bipyridyl type ligand”. Eur. J. Med. Chem. 26: 101—108. doi:10.1016/0223-5234(91)90218-C.
- ^ а б Wells, T. N. C.; Scully, P.; Paravicini, G.; Proudfoot, A. E. I.; Payton, M. A. (1995). „Mechanism of irreversible inactivation of phosphomannose isomerases by silver ions and flamazine”. Biochemistry. 34: 7896—7903. PMID 7794901. doi:10.1021/bi00024a014.
- ^ а б Cunningham, M. L.; Zvelebil, M. J. J. M.; Fairlamb, A. H. (1994). „Mechanism of inhibition of trypanothione reductase and glutathione reductase by trivalent organic arsenicals”. Eur. J. Biochem. 221: 285—295. PMID 8168518. doi:10.1111/j.1432-1033.1994.tb18740.x.
- ^ а б Saha, A. K.; Crans, D. C.; Pope, M. T.; Simone, C. M.; Glew, R. H. (1991). „Inhibition of human seminal fluid and Leishmania donovani phosphatases by molybdate heteropolyanions” (PDF). J. Biol. Chem. 266: 3511—3517. PMID 1995614.
- ^ а б Yano, S.; Inoue, S.; Nouchi, R.; Mogami, K.; Shinohara, Y.; Yasuda, Y.; Kato, M.; Tanase, T.; Kakuchi, T.; Mikata, Y.; Suzuki, T.; Yamamoto, Y. (1998). „Antifungal nickel(II) complexes derived from amino sugars against pathogenic yeast, Candida albicans”. J. Inorg. Biochem. 69: 15—23. PMID 9606935.
- ^ а б Su, J. J.; Mansour, J. M.; Mansour, T. E. (1996). „Purification, kinetics and inhibition by antimonials of recombinant phosphofructokinase from Schistosoma mansoni”. Mol. Biochem. Parasitol. 81: 171—178. PMID 8898332. doi:10.1016/0166-6851(96)02702-8.
- ^ а б Saenz, R. E.; Rodriguez, C. C. D.; Johnson, C. M.; Berman, J. D. (1991). „Efficacy and toxicity of pentostam against Panamanian mucosal leishmaniasis”. Am. J. Trop. Med. 44: 394—398. PMID 1645930.
- ^ а б Meyer-Fernandes, J. R.; Dutra, P. M. L.; Rodrigues, C. O.; Saad-Nehme, J.; Lopes, A. H. C. S. (1997). „Mg-dependent ecto-ATPase activity in Leishmania tropica”. Arch. Biochem. Biophys. 341: 40—46. PMID 9143351.
- ^ а б Kendrick, M. J.; May, M. T.; Plishka, M. J.; Robinson, K. D. (1992). „Metals in Biological Systems”. New York: Ellis Horwood. ISBN 978-0-13-577727-5.
- ^ Bult, A. (1983). Sigel, H., ur. Metal ions in biological systems. 16. New York: Marcel Dekker. doi:10.1080/00945718208063132.
- ^ Garg, R. K.; Sharma, L. M. J. Indian Chem. Soc. (1995). „Binuclear transition metal complexes of some novel Schiff bases derived from dapsone (an antileprotic drug). Part II. Zinc(II) complexes”. 72: 231—234. ISSN 0019-4522.
- ^ Hueso-Urena, F.; Moreno-Carretero, M. N.; Romero-Molina, M. A.; Salas-Peregrin, J. M.; Sanchez-Sanchez, M. P.; Cienfuegos-Lopez, G. A. D.; Faure, R. J. (1993). „Transition metal complexes with monodeprotonated isoorotic and 2-thioisoorotic acids: Crystal structure, spectral and magnetic study, and antimicrobial activity”. Inorg. Biochem. 51: 613—632. doi:10.1016/0162-0134(93)85033-5.
- ^ Ibrahim, S. A.; El-Gyar, S. A.; El-Gahani, M. A. (1991). „Metal complexes of nitrogen-oxygen donor ligands as potential drugs”. Collect. Czech. Chem. Commun. 56: 1333—1339. doi:10.1135/cccc19911333.
- ^ Nagar, R.; Mohan, G. J. (1992). „Studies on mixed-ligand complexes of some transition metals of biological interest”. Therm. Anal. 38: 1415—1431.
- ^ Fairlamb, A. H.; Henderson, G. B.; Cerami, A. (1989). „Trypanothione is the primary target for arsenical drugs against African trypanosomes” (PDF). PNAS. 86: 2607—2611. PMID 2704738.
- ^ а б Tsai, H.; Dwarakanath, A.; Hart, C.; Milton, J.; Rhodes, J. (1995). „Increased faecal mucin sulphatase activity in ulcerative colitis: a potential target for treatment” (PDF). Gut. 36: 570—576. PMID 7737566.
- ^ а б Beil, W.; Birkholz, C.; Wagner, S.; Sewing, K. (1995). „Bismuth subcitrate and omeprazole inhibit Helicobacter pyloriF1-ATPase”. Pharmacology. 50: 333—337. PMID 7667394. doi:10.1159/000139299.
- ^ а б в г Schroeder, T.; Caspers, M. (1996). „Kinetics of aluminum-induced inhibition of delta-aminolevulinic acid dehydratase in vitro”. Biochem. Pharmacol. 52: 927—931. PMID 8781512. doi:10.1016/0006-2952(96)00449-2.
- ^ а б в г Exley, C.; Price, N.; Birchall, J. (1994). „Aluminum inhibition of hexokinase activity in vitro: a study in biological availability”. J. Inorg. Biochem. 54: 297—304. PMID 8014638. doi:10.1016/0162-0134(94)80035-9.
- ^ а б Canesi, L.; Ciacci, C.; Piccoli, G.; Stocchi, V.; Viarengo, A.; Gallo, G. (1998). „In vitro and in vivo effects of heavy metals on mussel digestive gland hexokinase activity: the role of glutathione”. Comp. Biochem. Physiol. C. 120 (2): 261—268. PMID 9827040. doi:10.1016/S0742-8413(98)10004-X.
- ^ а б в г Yoshino, M.; Murakami, K.; Kawano, K. (1998). „Interaction of aluminum ion with ATP. Mechanism of the aluminum inhibition of glycerol kinase and its reversal by spermine”. Biometals. 11: 63—67. doi:10.1023/A:1009213508942.
- ^ а б Hyppo¨nen, S.; Kohila, T.; Tahti, H. (1993). „The effects of cadmium, lead and aluminum on neural cell membrane adenosinetriphosphatase activity”. Neurosci. Res. Commun. 12: 77—84.
- ^ а б Yager, J. W.; Wiencke, J. K. (1997). „Inhibition of poly(ADP-ribose) polymerase by arsenite”. Mutat. Res. 386: 345—351. PMID 9219571. doi:10.1016/S1383-5742(97)00011-2.
- ^ а б в Hu, Y.; Su, L.; Snow, E. T. (1998). „Arsenic toxicity is enzyme specific and its affects on ligation are not caused by the direct inhibition of DNA repair enzymes”. Mutat. Res. 408: 203—218. PMID 9806419. doi:10.1016/S0921-8777(98)00035-4.
- ^ а б в Tsao, D.; Maki, A. (1991). „Optically detected magnetic resonance study of the interaction of an arsenic(III) derivative of cacodylic acid with EcoRI methyltransferase”. Biochemistry. 30: 4565—4572. PMID 2021649. doi:10.1021/bi00232a029.
- ^ а б Lam, W.; Tsao, D.; Maki, A.; Maegley, K.; Reich, N. (1992). „Spectroscopic studies of arsenic(III) binding to Escherichia coli RI methyltransferase and to two mutants, C223S and W183F”. Biochemistry. 31: 10438—10442. PMID 1420162. doi:10.1021/bi00158a004.
- ^ а б в Styblo, M.; Thomas, D. (1995). „In vitro inhibition of glutathione reductase by arsenotriglutathione”. Biochem. Pharmacol. 49: 971—977. PMID 7741769. doi:10.1016/0006-2952(95)00008-N.
- ^ а б Chawla, S.; Mutenda, E.; Dixon, H.; Freeman, S.; Smith, A. (1995). „Synthesis of 3-arsonopyruvate and its interaction with phosphoenolpyruvate mutase”. Biochem. J. 308: 931—935. PMID 8948453.
- ^ а б Snow, E.; Xu, L.; Kinney, P. (1993). „Effects of nickel ions on polymerase activity and fidelity during DNA replication in vitro”. Chem.-Biol. Interact. 88: 155—173. PMID 8403077. doi:10.1016/0009-2797(93)90089-H.
- ^ а б Yang, S. W.; Becker, F. F.; Chan, J. Y. H. (1996). „Inhibition of human DNA ligase I activity by zinc and cadmium and the fidelity of ligation”. Environ. Health Perspect. 28: 19—25. PMID 8698042. doi:10.1002/(SICI)1098-2280(1996)28:1<19::AID-EM5>3.0.CO;2-9.
- ^ а б в Hartwig, A. (1994). „Role of DNA repair inhibition in lead- and cadmium-induced genotoxicity: a review”. Environ. Health Perspect. 102: 45—50. PMID 7843136. doi:10.2307/3431762.
- ^ а б в Porter, D. W.; Nelson, V. C.; Fivash, M. J. J.; Kasprzak, K. S. (1996). „Mechanistic studies of the inhibition of MutT dGTPase by the carcinogenic metal Ni(II)”. Chem. Res. Toxicol. 9: 1375—1381. PMID 8951243. doi:10.1021/tx9600816.
- ^ а б в Wetmur, J. G. (1994). „Influence of the common human delta-aminolevulinate dehydratase polymorphism on lead body burden”. Environ. Health Perspect. 102: 215—219. PMID 7843101. doi:10.2307/3431789.
- ^ SI, Beale (1990). „Biosynthesis of the Tetrapyrrole Pigment Precursor, delta-Aminolevulinic Acid, from Glutamate”. Plant Physiol. 93 (4): 1273—9. PMC 1062668
 . PMID 16667613. doi:10.1104/pp.93.4.1273.
. PMID 16667613. doi:10.1104/pp.93.4.1273.
- ^ Willows, R.D. (2004). „Chlorophylls”. Ur.: Goodman, Robert M. Encyclopaedia of Plant and Crop Science. Marcel Dekker. str. 258—262. ISBN 978-0-8247-4268-3.
- ^ Thiele, D. J. (1992). „Metal-regulated transcription in eukaryotes” (PDF). Nuc. Acids Res. 20: 1183—1191. PMID 1561077.
- ^ O’Halloran, T. V. (1993). „Transition metals in control of gene expression”. Science. 261: 715—725. PMID 8342038. doi:10.1126/science.8342038.
Literatura[uredi | uredi izvor]
- Berg JM, Tymoczko JL, Stryer L (2002). Biochemistry (V izd.). New York, NY: W. H. Freeman. ISBN 978-0-7167-3051-4.
- Cornish-Bowden A, ur. (1997). New Beer in an Old Bottle: Eduard Buchner and the Growth of Biochemical Knowledge. Universitat de València. ISBN 978-84-370-3328-0.
- H, Suzuki (2015). How Enzymes Work: From Structure to Function. Boca Raton, FL: CRC Press. ISBN 978-981-4463-92-8.
- Cornish-Bowden A (2012). Fundamentals of Enzyme Kinetics (IV izd.). Weinheim: Wiley-VCH. ISBN 978-3527330744.
- Briggs, G. E.; J. B. S. Haldane (1925). „A note on the kinetics of enzyme action”. Biochem. J. 19: 339—339. PMC 1259181
 .
. - R.R. Dogonadze; V.G. Levich (1959). „Theory of Non-radiative Electronic Transitions between Ions in Solution”. Dokladi Akademii Nauk SSSR. Ser. Fizicheskoy Khimii. Moscow. 124: 123—126.
- R.R. Dogonadze (1960). „Rate of Electron Transfer Reactions in Solutions”. Dokladi Akademii Nauk SSSR. Ser. Fizicheskoy Khimii. Moscow. 133: 1368—1371.
- M, Nishimura; Chance B. (1963). „Studies on the electron-transfer systems in photosynthetic bacteria I. The light-induced absorption-spectrum changes and the effect of phenylmercuric acetate”. Biochim Biophys Acta. 66: 1—16. doi:10.1016/0006-3002(63)91162-4.
- V.G. Levich; R.R. Dogonadze; E.D. German; A.M. Kuznetsov; Yu.I. Kharkats (1970). „Theory of Homogeneous Reactions Involving Proton Transfer”. Electrochim.Acta. 15: 353—367.
- M.V. Volkenshtein; R.R. Dogonadze; A.K. Madumarov; Z.D. Urushadze; Yu. I. Kharkats (1972). „Theory of Enzyme Catalysis”. Molekuliarnaya Biologia: 431—439.
Spoljašnje veze[uredi | uredi izvor]
- (jezik: engleski) Veb-tutorijal za enzimsku inhibiciju, priručnik dr Pitera Berča sa Univerziteta u Pejsliju koji sadrži veoma jasne animacije
- (jezik: engleski) Simbolika i terminologija enzimske kinetike, preporuke Odbora za nomenklaturu Međunarodne unije za biohemiju (NC–IUB) oko terminologije inhibicije enzima
- (jezik: engleski) NCBI-jev PubChem, baza podataka lekova i inhibitora enzima
- (jezik: engleski) BRENDA Архивирано на сајту Wayback Machine (11. децембар 2008), baza podataka enzima sa spiskovima poznatih inhibitora za svaki unos
- (jezik: engleski) Enzimi, kinetika i dijagnostička upotreba Архивирано на сајту Wayback Machine (9. јул 2011), onlajn predavanje dr Majkla V. Kinga iz Medicinske škole Univerziteta u Indijani s fokusom na medicinsku primenu inhibitora enzima
- (jezik: engleski) BindingDB, javna baza podataka izmerenih afiniteta vezivanja proteina i liganda
- (jezik: engleski) Animirana vežba sa inhibicijom enzima, tutorijal + kvizovi
Hiperbilirubinemija je oboljenje koje uzrokuje prekomernu akumulaciju bilirubina u krvi i tkivima.[1] Bilirubin je produkt katabolizma hema, pri čemu se hem degradira posredstvom hem oksigenaze (HO) i formira se biliverdin, koji se zatim redukuje pomoću biliverdin reduktaze do bilirubina.[2] Nakon konjugacije sa glukuronskom kiselinom, pomoću enzima bilirubin glukuronid transferaza, i formiranja rastvorljivijeg konjugata, bilirubin se izlučuje. Prekomerno razlaganje hema i nedovoljna aktivnost transferaze mogu da dovedu do akumulacije bilirubina. Ovo nakupljanje je poznato kao neonatalna žutica kod beba sa nedovoljno razvijenom jetrom i prevremeno rođene dece, koja brzo razgrađuju hem (pri prelazu sa fetalnog na regularni hemoglobin) ali im nedostaju adekvatne transferaze. Hiperbilirubinemija se takođe javlja kod genetičkog Krigler—Najarovog sindroma, gde dolazi do kompletnog odsustva transferaznog dejstva u jetri[3] i drugih bolesti kao što su talasemija i kongenitalne anemije.[2] Inhibicija razlaganja hema u hem oksigenaznom koraku je mogući način sprečavanja hiperbilirubinemije.
Metaloporfirini su ekstenzivno izučavani i dobro poznati inhibitori hem oksigenaze. Ovi inhibitori se vezuju za katalitičko mesto, ali nisu efektivni supstrati. Znatan broj metaloporfirina ima inhibitorno dejstvo, a ima i onih koji indukuju hem oksigenazu. Najznačajniji inhibitori hem oksigenaze su kalajni i cinkovi porfirini. Neki od ovih porfirina su našli kliničku primenu u suzbijanju produkcije bilirubina.[3][4] Nedavna istraživanja su razjasnila prirodu inhibicije, uticaj na druge biohemijske puteve, kao i opseg biodistribucije lekova.
Studije cinkovih i kalajnih protoporfirina indiciraju da je kalajni protoporfirin (Sn-PP) isto tako efektivan inhibitor adrenalne steroidogeneze, dok cinkov protoporfirin (Zn-PP) nema uticaja na taj put.[5][6] Sinteza steroida je posredovana brojnim hemoproteinima, citohromima P-450, te postoji kompleksna međuzavisnost između puta sinteze hema i steroidogeneze. Koncentracija citohroma je vezana za promene u sintezi i degradaciji hema. U testovima, koristeći modele na pacovima, utvrđeno je da Sn-PP znatno redukuje aktivnost steroidnih biosintetičkih enzima mitohondrijske 11β-hidroksilaze i mikrozomalne 21R-hidroksilaze; takođe je uočeno smanjenje sadržaja mikrozomalnog citohroma P-450.[5][6] U pomenutoj studiji je isto tako zapaženo drastično smanjenje sadržaja HO-2, neinducibilnog izozima hem oksigenaze koji je daleko prevalentniji od inducibilnog HO-1, te se pretpostavlja da Sn-PP zapravo uništava HO-2 umesto da ga inhibira. Zn-PP, nasuprot ovoga, inhibira aktivnost HO ali nema uticaja na enzime steroidne biosinteze.[5][6]
Dalja istraživanje poređenjem dejstva Zn-PP i Sn-PP sa HO-1 i HO-2 pokazala su da su oba jednako inhibitorna za HO-1 bez uticaja na integritet proteina (što je utvrđeno vestern blot analizom), kao i da indukuju povišenje nivoa HO-1 transkripije. Međutim, Sn-PP i Zn-PP se razlikuju u pogledu svoje aktivnosti spram HO-2.[7] Mada oba inhibiraju HO-2, razlikuju se u stepenu inhibicije. Stepen inhibicije Zn-PP je isti za obe forme HO, dok Sn-PP ispoljava znatniju inhibiciju HO-2 nego HO-1. Smatra se da Sn-PP poremećuje integritet HO-2 proteina (vestern blot), dok Zn-PP nema taj efekat. Mehanizam koji uzrokuje razlike aktivnosti Sn-PP i Zn-PP na HO formama nije poznat.
Utvrđeno je da razni porfirini inhibiraju intestinalnu hem oksigenazu i umanjuju preuzimanje gvožđa iz creva, dovodeći do povećanog izlučivanja ovog metala. To može da bude korisno u tretmanu slučajeva hemohromatoze.[8][9] Ovaj efekat je uočen kod svih parenteralno administriranih porfirina, ali su samo Sn-MP, Sn-PP i Cr-MP bili oralno efektivni (na intestinalnoj HO; nisu nađeni na renalnim, splinskim ili hepatičim tkivima). Pokazano je da je Zn-MP efektivan u tretmanu akutne porfirije (poremećaja izazvanog deficijencijom hema), a studije distribucije u tkivu su pokazale da brzo biva uklonjen iz plazme i da se prvenstveno zadržava u jetri i slezini, gde inhibira HO tokom perioda od skoro nedelju dana nakon jedne injekcije.[10] Zn-MP ne prolazi kroz krvno-moždanu barijeru, za razliku od Sn-PP za koji je pokazano da štetno utiče na HO-2 integritet i aktivnost u mozgu pacova.[11] Metaloporfirini deluju kao pojačivači fotosenzitivnosti s varirajućim stepenima[12] (oni se takođe koriste u fotodinamičkoj terapiji). Poznato je da Zn-PP u manjoj meri podstiče fotosenzitivnost od Sn-PP, što je još jedno svojstvo koje sugeriše da su cinkove forme inhibitora verovatno podesnije za kliničku primenu.[13]
Co-MP i Cr-MP takođe efektivno inhibiraju HO.[14][15] Utvrđeno je da Co-MP ne posreduje lipidnu peroksidaciju u moždanim membranama pacova nakon fotoiradijacije (što je pokazano koristeći malondialdehidni test); stoga, on ne podstiče fotosenzitivnost.[14] Cr-MP efektivno inhibira hepatičku HO nakon oralne administracije, dok na splinsku HO nema uticaja.[15] Pokazano je da Zn-MP inhibira hepatičku 5-aminolevulinatnu sintazu (ALAS), enzim koji ograničava brzinu puta biosinteze hema. Ovaj efekat se uvećava kad se hem doda sa porfirinom.[16] Poznato je da gvožđe i hem povratno regulišu ALAS putem inhibiranja mRNK transkripcije/transporta.[17] Uočeno je da je ALAS translacija pod kontrolom elemenata resposivnih na gvožđe.[18]
Upotreba metaloporfirina za tretman hiperbilirubinemije je uznapredovala dalje u procesu razvoja lekova u odnosu na antikancerne agense opisane u prethodnom odeljku. Ovi porfirini imaju poznat biološki cilj, hem oksigenazu, te je njihova klinička efektivnost već pokazana. Međutim, njihova glavna biološka meta je deo kompleksnog puta, koji je u velikoj meri povezan sa drugim procesima, kao što je steroidna sinteza. Neophodno je praćenje tih drugih procesa da bi se sprečili neželjeni uticaji na njih.
- Transdukcija azot-monoksidnog signala
| Transdukcija azot-monoksidnog signala | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| PP | Zn | rastvorna guanilatna ciklaza (prečišćena)[19] | |
| PP, BG | Zn, Sn | rastvorna guanilatna ciklaza (pacovi)[20] | |
| natrijum nitroprusid (SNP) | Fe | azot-monoksid sintaza (neutrofili pacova)[21] | |
| SNP | Fe | NOS (cerebralni kortikalni sinaptozomi)[22] | |
| joni | Cu, Zn, Co, Ni, Fe | NOS (prečišćena)[23] | |
| jon | Zn | NOS (prečišćeni nNOS)[24] | |
| SNP | Fe | ekto-5'-nukleotidaza (renalno epitelijalna)[25] | |
| SNP | Fe | indolamin 2,3-dioksigenaza (mononuklearni fagociti)[26] | |
| SNP | Fe | metionin sintaza[27] | |
| SNP | Fe | (Na+/K+)-ATPaza[28] | |
Azot-monoksid (NO) igra ulogu glasnika u mnoštvu sistema. U imunskom sistemu, NO posreduje respons belih krvnih zrnaca na patogene; u kardiovaskularnom sistemu, NO indukuje relaksaciju ćelija glatkih mišića u krvnim sudovima; i u nervnom sistemu, NO učestvuje u neurotransmisiji i neuromodulaciji.[29][27][30] NO se formira iz L-arginina posredstvom azot-monoksidne sintaze (NOS), hem proteina koji se javlja u više izoformi i za čije dejstvo je neophodan NADPH kao donor elektrona. Postoje tri NOS izoforme: konstitutivne izoforme prisutne u mozgu (nNOS, tip I) i endotelnim ćelijama (eNOS, tip III) za čije dejstvo je neophodan kalcijum/kalmodulin, i citokinom indukovane forme (iNOS, tip II) za čije dejstvo nije neophodan kalcijum ali koje imaju kalmodulin kao čvrsto vezanu podjedinicu.[31] Obe klase se javljaju u obliku homodimera pri čemu svaka podjedinica sadrži 1 ekvivalent FAD, FMN, (6R)-5,6,7,8-tetrahidro-L-biopterina (H4B) i protoporfirin IX hema.[23][32] Postoji duga lista NOS inhibitora koja obuhvata selenoorganska jedinjenja (koja se vezuju za tiolne grupe), Zn porfirine, te cink (vezuje se za hem mesta).[32] U kaskadi prenosa signala, poznato je da NO stimuliše guanilatnu ciklazu i da indukuje akumulaciju sekundarnog glasnika, cAMP. Mnogi aspekti NO signalizacije su ispitani studiranjem ramifikacija uvođenja NO donora u sistem ili putem NOS inhibiranja NOS čime se obustavlja NO produkcija.
NO je našao široku primenu kao ligand u gvožđe-hemnim kompleksima u neorganskoj hemiji, i stoga se nameće pitanje da li NO može da bude autoregulisan NOS inhibicijom (hemni je protein).[31] Studije sa NO donorom, natrijum nitroprusidom (SNP), Na2Fe(CN)5NO•2H2O, pokazuju da NO može da inhibira NOS.[21][21] U studijama sa neutrofilima pacova, lipopolisaharid se koristi za indukovanje aktivnosti NOS i ova indukcija se inhibira pomoću SNP.[21] SNP ispitivanja koristeći kortikalne sinaptozome pacova su ukazala na postojanje koncentraciono zavisne NOS inhibicije NOS aktivnosti.[21] U ovim studijama se NOS aktivnost određuje praćenjem formiranja [3H]citrulina iz [3H]arginina.[33] Poznato je da prelazni metali inhibiraju NOS,[23] kao i da prečišćeni Cu2+, Ni2+, Zn2+ i Co2+ deluju kao inhibitori inducibilnog NOS enzima, dok nehemno gvožđe povećava katalitičku aktivnost. Za Cu2+ jon je utvrđeno da inhibira prečišćeni neuronalni NOS (drugi metali nisu testirani na nNOS). Iz ovih nalaza proizilazi da nehemno gvožđe NOS enzima učestvuje u katalizi, te da NOS verovatno sadrži aktivno mesto za nehemno gvožđe/H4B.
Zn2+ reverzibilno inhibira aktivnost nNOS (Ki = 30 μM).[24] Uočena je inhibicija NADPH-zavisne redukcije gvožđa hema i od kalmodulina (CaM)-zavisna redukcija citohroma c. Nije uočena inhibicija CaM-nezavisne reduktaze citohrom c reduktaze (mereno relativnim brojem katalitičkih ciklusa citohroma c). Međutim, čak i u odsustvu Zn2+, CaM-nezavisni put ima više nego deset puta slabiju aktivnost od CaM-zavisnog puta. nNOS spektri razlika tipa II demonstriraju smanjenje količine visokospinskog gvožđa hema u prisustvu Zn2+. Na osnovu ovih rezultata, zaključeno je da do inaktivacije enzima dolazi usled vezivanja Zn2+ za sulfhidrile u blizini hem liganda i naknadnog poremećaja okruženja oko gvožđa hema.
SNP i NO produkcija doprinose inhibiciji niza drugih enzima. Indolamin 2,3-dioksigenaza (IDO) enzim je koji sadrži hem i koji je deo interferonom γ (IFNγ) indukovanog responsa mononuklearnih fagocita na patogene.[26] IDO je enzim koji ograničava brzinu u putu degradacije triptofana. Iscrpljivanje triptofana, najmanje dostupne esencijalne aminokiseline, može da doprinese antipatogenoj aktivnosti mononuklearnih fagocita. U studijama na izolovanim IFNγ-tretiranim ljudskim perifernim krvnim mononuklearnim ćelijama i iz monocita izvedenim makrofagama, uočeno je da SNP inhibira IDO aktivnost.[26] Takođe je pokazano da se IDO može inhibirati dejstvom Zn-MP.[34] Drugi enzimi koje inhibira SNP obuhvataju metioninsku sintazu u hepatocitima pacova,[27] (Na+/K+)-ATPaze[28] i ekto-5'-nukleotidaze u renalnim epitelijalnim ćelijama.[25] Metioninska sintaza se sastoji od metilkobalamina kao kofaktora, derivata vitamina B-12 koji je u znatnoj meri sličan hemoglobinu, a do inhibicije može doći putem formiranja NO-kobalaminskog kompleksa. Smatra se da do inhibicije ekto enzima dolazi putem S-nitrozilacije. Mehanizam inhibicije (N+/K+)-ATPaze nije poznat.
Postoje indikacije da je ugljen-monoksid (CO) fiziološki regulator, koji deluje na sličan način kao i NO, uključujući sposobnost stimulacije guanilil ciklaze. CO se formira posredstvom HO, pri konverziji hema do biliverdina i CO. Mnoge studije uloge CO su izvršene koristeći HO inhibitore, kao što su Zn-PP i Sn-PP, da bi se pokazalo da supresija HO (i stoga CO produkcije) inhibira guanilil ciklazu. Međutim, nedavne studije su pokazale da sami metaloporfirini inhibiraju guanilil ciklazu, te stoga studije koje koriste te komplekse za ispitivanje uticaja CO verovatno treba preispitati.[19][20] U drugim studijama su korišćeni porfirini za ispitivanje uloge CO u prostornom učenju i dugoročnoj potencijaciji u hipokampusu.[35][36] Porfirini su korišćeni pod pretpostavkom da oni isključivo deluju kao supresori CO produkcije posredstvom HO; međutim, imajući u vidu da je dejstvo porfirina višestrano, teško je pretpostaviti ulogu CO isključivo na bazi tih eksperimenata. Ove studije demonstriraju neke od problema sa kojima se istraživači suočavaju kad specifičnost inhibitora nije apsolutna i ilustruju neke od komplikujućih faktora u analizi podataka kad se koriste „indirektni” efektori (npr. inhibiranje enzima koji formira CO, umesto direktnog uklanjanja CO).
Hipertenzivne primene[uredi | uredi izvor]
| Hipertenzivne primene | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| sulfonamid | Cu | karbonatna anhidraza[37] | |
| heterociklični sulfonamidi | Zn, Cu | karbonatna anhidraza[38] | |
| heterociklični merkaptani, sulfenamidi, sulfonamidi | Zn, Cu | karbonatna anhidraza[39] | |
| razni sulfonamidi | Ge, Sb | karbonatna anhidraza[40] | |
| hlorotiazid | Hg, Pb | karbonatna anhidraza[41] | |
| kaptopril | Zn | angiotenzin konvertujući enzim[42] | |
| lisinopril | Cu | angiotenzin konvertujući enzim[43] | |
Sistemi vezani za hem koji su razmatrani u prethodnom odeljku blisko su povezani sa hipertenzivnim primenama. Natrijum nitroprusid je u širokoj upotrebi kao hipotenzivni agens,[27][44] a hem oksigenaza je implicirana u održavanje krvnog pritiska.[45] Utvrđeno je da SnCl2 indukuje HO-1 transkripciju i stoga inhibira dejstvo citohrom P450-arahidonska kiselina ω/ω-1 hidroksilaze, što dovodi do smanjenog formiranja ö/ö-1 hidroksilaznih metabolita i nižeg krvnog pritiska.[45] Hidroksilaza je hemni protein čiji su nivoi kontrolisani dostupnošću hema. Kad se indukuje hem oksigenaza iscrpi se dostupni hem; tome sledi opadanje nivoa enzima, a time i količine enzimskih metabolita. Metaboliti, odnosno 19[S]-hidroksieikozatetraenoinska kiselina (HETE) i 20-HETE, deluju kao prohipertenzivi jer stimulišu Na+/K+-ATPazu i konstrikciju krvnih sudova.
Još jedan od primarnih enzimskih ciljeva za hipertenziju je karbonatna anhidraza (CAs). Ona katalizuje hidraciju CO2 do bikarbonata i učestvuje u širokom opsegu bioloških procesa, uključujući pH homeostazu, produkciju okularnih i cerebrovaskularnih fluida, te sekreciju elektrolita. U očima, na primer, karbonatna anhidraza igra kritičnu ulogu u održavanju intraokularnog pritiska. Poznato je sedam izoenzima karbonatne anhidraze i nekoliko srodnih proteina. Ovi izoenzimi su prisutni u citosolu (CA I, II, III i VII), vezani za ćelijske membrane (CA IV), u mitohondrijama (CA V) i u sekretornoj formi u pljuvački (CA VI).[46][47] Oni imaju različite uloge i veoma različitu tkivnu distribuciju, kinetička svojstva i osetljivost na inhibitore. CA enzimi su metaloenzimi, a mnogi inhibitori tih enzima su metal kompleksirajući anjoni koji se direktno koordiniraju sa cinkom u aktivnom mestu enzima.
Karbonatne anhidraze, izuzev CA III, takođe inhibiraju sulfonamidi koji se vezuju za cink putem supstitucije katalitički važnog molekula vode.[39] Sulfonamidi su korišćeni za tretman glaukoma dugi niz godina jer snižavaju intraokularni pritisak (IOP). Precizni mehanizam snižavanja pritiska nije poznat, ali se smatra da do toga dolazi usled redukcije koncentracije bikarbonata u posteriornoj komori oka, te da prateće premeštanje bikarbonatnih jona dovodi do kretanja fluida i smanjenja koncentracije natrijuma.[48] Metalni kompleksi sulfonamida takođe potentno inhibiraju karbonatne anhidraze. Zn(II), Cu(II), Ni(II), Co(II), Fe(III) i Al-(III) kompleksi adamantil sulfonamidnih derivata imaju inhibitorno dejstvo na tri CA izozima (hCA I, hCA II i bCA IV) sa nM Ki vrednostima.[38] Zn(II) i Cu(II) kompleksi, najjači inhibitori u seriji, topikalno su bili primenjivani na zečji model oka i utvrđeno je da snižavaju IOP. Topikalno primenjeni sulfonamid ne snižava IOP, iz čega sledi da prisustvo metalnih jona kritično menja svojstva inhibitora. Pretpostavlja se da metal menja rastvorljivost kompleksa, čime se povećava dostupnost leka. Hg(II) kompleksi hlorotiazida, diuretika koji se koristi kao antihipertenziv, isto tako pokazuju jaku inhibiciju CA[41] kao i Ge(IV) i Sb(III) kompleksi arilsulfonilamida[40] i Cu(II) kompleksi acetazolamidnih derivata.[37] Za metalne komplekse se smatra da deluju na CA na dva načina: 1. inhibicijom sa slobodnim sulfonamidom i 2. interakcijom metalnih jona sa histidinom u aktivnom mestu.[37]
Veliki deo literature o hipertenzivnim agensima je posvećen inhibitorima angiotenzin-konvertujućeg enzima (ACE), komponenti renin-angiotenzin sistema. Renin-angiotenzin sistem učestvuje u održavanju krvnog pritiska. ACE katalizuje konverziju angiotenzina I do angiotenzina II, vazokonstriktora koji učestvuje u hipertenziji. Angiotenzin I se formira konverzijom jetrenog produkta posredstvom renina, enzima koji izlučuju bubrezi.[49][50] Postoje receptorska mesta na mnogim organima za angiotenzin II. Taj sistem može da bude blokiran na više nivoa, poznati β-blokatori blokiraju otpuštanje renina, analozi renin-supstrata i reninski inhibitori blokiraju renin, angiotenzin II receptore blokira salarzin, a ACE inhibitori blokiraju ACE. Većina pomenutih jedinjenja ne sadrži metale, mada neki ACE inhibitori formiraju metalne kompleksie in vivo. Na primer, kaptopril je dizajniran da se nadmeće sa angiotenzinom za jone cinka u enzimu i da vezuje cink putem tiolne grupe.[42] Lisinopril, još jedan ACE inhibitor, vezuje cink putem aminokarboksilatne gurpe.[43] Lisinopril se konjuguje sa Rh(III) i Pd(II) (iminofosforano)fosfinima, a konjugati imaju nešto veću inhibitornu aktivnost od roditeljskog jedinjenja (dolazi do 18-strukog smanjenja vrednosti IC50, nanomolarni opseg).[51] Ova derivatizacija u vidu sinteze 105Rh i 109Pd radio-obeleženih jedinjenja omogućava in vivo praćenje distribucije leka.
Tretmani za hipertenziju su obično dugoročni i stoga je stabilnost interakcija koju pruža kovalentno vezivanje metalnih kompleksa privlačna opcija. Najveći deo literature u ovoj oblasti se bavi organskim jedinjenjima; međutim, znatan broj tih jedinjenja je zavisan od interakcije sa metalima za ispoljavanje svog dejstva.
Serinskoproteazne primene[uredi | uredi izvor]
| Serinskoproteazne primene | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| aminokiselinske i peptidne ligacije | Co | α-himotripsin[52][53] | |
| Šifova baza | Co | trombin, termolizin[54][55][56] | |
| razne boronske kiseline | B | tripsin[57] | |
| peptid | B | α-litička proteaza[58] | |
| fenilboronska kiselina | B | α-himotripsin[59] | |
| tripeptid | B | tripsin, α-litička proteaza, tripsinu slične proteaze[60] | |
| BABIM | Zn | serinske proteaze[61][62][63][64] | |
| titanil sulfati | Ti | tripsin[65] | |
Serinske proteaze obuhvataju glavnu familiju proteolitičkih enzima sa raznovrsnim opsegom funkcija. Serinske proteaze igraju ključne uloge u kaskadi koagulacije krvi, u aktivaciji komplementa, bakterijskoj patogenezi, te fibrinolizi.[57] Serinske proteaze su postale prominentni ciljevi za dizajn lekova u antivirusnim i antibakterijskim istraživanjima.[65] Velika klasa inhibitora serinskih proteaza su boronske kiseline i peptid-boronske kiseline.[66][39][67][68] Smatra se da boronil grupe oponašanju prelazno stanje reakcije, dok peptidna porcija usmerava specifičnost na specifične proteaze.
Serije 15N i 1H studija kompleksa proteaznih inhibitora dale su uvid u interakcije između tripsina ili α-litičkih proteaza i raznih boronskokiselinskih inhibitora. U α-litičkim proteazama i tripsinu, supstratni analozi teže da formiraju serinske adukte, dok nesupstratni analozi obično formiraju histidinske adukte,[57] mada i supstratni analozi mogu ponekad da formiraju histidinske adukte.[58][69] Dalje, 11B NMR studije na histidinskim aduktima α-litičkih proteaza i serinskih adukata himotripsina i α-litičkih proteaza pokazale su da je atom bora tetraedralan u histidinskim i serinskim aduktima.[58] Iz rada sa fenilboronskom kiselinom proizilazi da adicija šećera (D-monosaharida) povećava inhibitorno dejstvo na α-himotripsin.[59] Taj zaključak je izveden na osnovu acidifikacije atoma bora putem samokompleksacije sa D-monosaharidima. Ovaj sinergistički efekat je pH zavisan i nije uočen iznad pH 9,5 (enzimska inhibicija dejstvom same borne kiseline takođe nije uočena). Do jake inhibicije enzima dolazi između pH 4 i pH 9 u prisustvu fenilborne kiseline i fruktoze sa najvećim šećerno indukovanim pojačanjem inhibicije na približno neutralnom pH. Razni tripeptidi boronatnih estara takođe deluju kao inhibitori serinske proteaze.[60] Utvrđeno je da dodatni peptidno-metalni kompleksi deluju kao serin proteazni inhibitori. Poznato je da Co(III)-vezane aminokiseline i dipeptidi mogu da inhibiraju himotripsin i tripsin.[52][53] Ove studije su provođene da bi se ispitali efekti pentamin kobalta(III), koji se koristi kao hidrofilna karboksilna zaštitna grupa u enzimatskoj peptidnoj sintezi. Ranije je primećeno da prisustvo ove grupe na aminokiselinama neposredno pored veze koja je podložna enzimskom dejstvu blokira katalitičku konverziju. Inhibicija prečišćenog himotripsina i tripsina ligiranim peptidima je kompetitivna i reverzibilna. Naknadne studije ove hemijske grupe sugerišu da se ligirani peptidi vezuju za enzim putem Kulonovih interakcija.[53] Kobalt(III)-ligirani peptidi raznih dužina su testirani na tripsinu, himotripsinu i proteinazi K. Na osnovu rezultata modelovanja himotripsina, rastojanje između dva negativno naelektrisana Asp ostatka (Asp-35 i Asp-64) u S' vezujućem i Ser-195 u aktivnom mestu odgovara dužini inhibitora peptida optimalne dužine. Redosled inhibicionih efikasnosti je metalopeptid > amid > slobodni peptid, što se podudara sa očekivanjima imajući u vidu postojanje dva negativno naelektrisana bočna lanca u mestu vezivanja. U prisustvu povišenih koncentracija NaCl, inhibicija metalopeptidima je manje efikasna, dok se inhibicija slobodnih peptida poboljšava. Do promene inhibicije amida ne dolazi. Ovi rezultati su konzistentni sa elektrostatičkim interakcijama između inhibitora i aktivnog mesta. Nasuprot ovome, tripsin ima dva pozitivno naelektrisana ostatka (Lys-60 i Arg-62) u S' vezujućem regionu i shodno tome inhibicija slobodnim peptidima je efektivnija od pozitivno naelektrisanih metalopeptida. Opservacije na proteinazi K nisu konzistentne sa obrascem efikasnosti uočenim za druga dva enzima, što sugeriše da jedno pozitivno naelektrisanje (Arg-218) u S' regionu ne određuje vezivanje. Te studije demonstriraju da adicija metalnog jedinjenja može da promeni afinitet vezivanja supstrata putem elektrostatičkih efekata.
U studijama kompleksa Co(III) Šifove baze i peptidnih konjugata tih kompleksa pokazano je da efektivno inhibiraju trombin i termolizin.[54][55][56] Peptidni konjugat selektivno inhibira trombin u smeši sa dve druge serinske proteaze (Ki = μM). Selektivnost proističe iz interakcije peptidne komponente, dok je sama inhibicija posledica kobalt(III) koordinacije sa histidinima aktivnog mesta. Alternativno, kobalt se može koordinirati sa histidinima u blizini ali ne i u samom aktivnom mestu, čime se peptid zaključava u mestu vezivanja supstrata. Takođe, pokazano je da ovi kompleksi imaju sposobnost vezivanja histidina u model sistemu peptida iz cinkovog prsta HIV nukleokapsidnog proteina.[70] U ovim studijama je pomoću 1H NMR spektroskopije demonstrirana direktna interakcija između kobaltnih kompleksa i histidina u cinkovom prstu, što dovodi do remećenja strukture cinkovog prsta. Iz pomenutih studija proističe da ovi kompleksi mogu da inhibiraju cinkove metaloproteaze.
Nakon što je klasa inhibitora cink-posredovanih serinskih proteaza okarakterisana,[61][62][63][64] u kristalografskim studijama na tripsinu je uočeno da se ti inhibitori tetraedralno koordiniraju sa egzogenim jonom cinka između dva helirajuća atoma azota inhibitora i dva ostatka aktivnog mesta (His57 i Ser195).[62] Prisustvo cinka pojačava inhibiciju za skoro tri reda veličine, i u slučaju pojedinih inhibitora proizvodi selektivnost. Ova klasa inhibitora predstavlja jedinstven pristup u kojem sam inhibitor nije metalni kompleks ali je prisustvo prelaznog metala od ključnog značaja za inhibiciju.
Serinske proteaze su implicirane u procese brojnih bolesti, a inhibicija ovih enzima aktivno je polje izučavanja.[62][64] Prisustvo histidina u aktivnom mestu i afinitet jakih kiselina za azot čini inhibiciju serinskih proteaza pomoću metalnih kompleksa logičnim izborom. Nov pristup dizajnu inhibitora, kao što je opisano iznad, vezuje organska jedinjenja za aktivna mesta putem cinkovog jona kao „mosta” (granične Luisove kiseline), što sugeriše da cink možda deluje kao regulatorni element. Ovi mali molekuli predstavljaju potencijalni okvir za konstruisanje brojnih drugih inhibitora, gde inhibitorna porcija molekula ostaje nepromenjena, dok se ostatak molekula može prilagođavati da bi se promenila specifičnost.
Neurološke primene[uredi | uredi izvor]
| Neurološke primene | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| jon | Li | adenilatna ciklaza, triptofanska hidroksilaza, Ca2+-ATPaza[71] | |
| jon | Al | serinske proteaze, α-himotripsin[72] | |
| jon | Al | monoaminooksidaza A[73] | |
| jon | Al | kalpain[74] | |
| jon | Al | kalpain, heksokinaza, glukoza-6-fosfat dehidrogenaza[75] | |
| porfirini | Fe, Zn | acetilholinesteraza[76] | |
| porfirini | Cr, Zn | hem oksigenaza, azot-monoksid sintaza[35] | |
| protoporfirin | Sn | hem oksigenaza[36] | |
| cisplatin, copper sulfate | Pt, Cu | monoaminooksidaza[77] | |
| jon | Cu, Cd, Pb, Mg, Zn | lizozomna, citoplasmična proteinaza, kalpain I i II[78] | |
| jon | Zn | matrične metaloproteinaze, sekretaze, citohrom c oksidaza, azot-monoksidna sintaza, endonukleaza[79] | |
Jedna od najbolje poznatih oblasti primene metalnih inhibitora u neurologiji je upotreba litijuma kao tretmana za bipolarni poremećaj (manično-depresivnu bolest). Litijumska terapija je uvedena 1949. godine, ali precizni mehanizam njenog terapeutskog dejstva nije bio poznat. Poslednjih godina su objavljeni izveštaji koji indiciraju da litijum utiče na puteve inozitol fosfolipidne hidrolize (mada nije jasno da li je to usled inhibicije inozitol-1-fosfataze) i da inhibira adenilatnu ciklazu.[71]
Uloga aluminijuma u Alchajmerovoj bolesti i detaljni mehanizam njegovog učešća u razvoju bolesti nisu potpuno razjašnjeni. Povezanost aluminijuma sa bolešću je implicirana sticajem okolnosti usled povišenih nivoa aluminijuma u mozgu pacijenata sa Alchajmerovom bolešću i amiotrofičnom lateralnom sklerozom.[72][75][74] Aluminijumski sadržaj je visok u plakovima, neurofibrilarnim svežnjevima i neuritskim naslagama karakterističnim za pomenuta oboljenja. Aluminijum inhibira moždane heksokinaze[80] i nekompetitivno inhibira moždanu mitohondrijsku monoaminsku oksidazu-A (MAO-A)[73] (kao što je to slučaj sa crevnom MAO, u kontekstu kancera). Postoje indikacije da aluminijum aktivira serinske proteaze, i da su tako aktivirane proteaze naknadno otporne na dejstvo drugih inhibitora.[72][75] Serinske proteaze presecaju β-amiloidne prekursorske proteine (APP) i formiraju β-amiloidne peptide. Predložen je model po kojem aluminijum supresuje inhibitorski domen proteaza, čime pospešuje proteolitičko formiranje peptida koji se zatim akumuliraju i iniciraju formiranje plakova.[72]
Niz drugih metala je bio impliciran u formiranje amiloidnih plakova. Primećeno je da Zn2+, Fe2+ i Cu2+ (μM), kao i Al2+ (mM), uzrokuju agregaciju pri fiziološkim koncentracijama β-amiloidnih proteina.[81][82][79][83][84][85] Histidinski modifikovan ljudski A beta(1-40) ne podleže agregaciji posredstvom Zn2+, Fe2+ ili Cu2+, iz čega proizilazi da histidini učestvuju u metalom indukovanoj agregaciji.[81] Postoje indikacije da metali deluju putem različitih mehanizama. Fe2+-indukovana agregacija je inhibirana prisustvom antioksidanasa, dok oni nemaju uticaja na Zn2+-indukovanu agregaciju. Ovaj nesklad sugeriše da Fe2+ uzrokuje agregaciju putem oksidativnog mehanizma.[82] Poznato je da oksidacija može da indukuje agregaciju,[86] te da β-amiloidi imaju prooksidantna svojstva — posebice u prisustvu aluminijuma.[87] Azot-monoksidni donori kao što je SNP (koji NO formiraju usled oksidativnog stresa) mogu da posreduju akumulaciju cinka u hipokampalnim ćelijama, te postoji mogućnost da su oksidativni efekti povezani sa cinkovim efektima.[79] Za razliku od toga, mehanizam Zn2+-indukovane agregacije nije zavisan od oksidacije, nego se zasniva na direktnim interakcijama sa peptidima.[81][82][84][85] Pored svog agregacionog dejstva, Zn2+ inhibira brojne proteolitičke enzime koji učestvuju u transformacijama amiloida, uključujući matriks metaloproteinaze (MMP) odgovorne za degradaciju amiloidnih peptida, a verovatno i α-sekretaze odgovorne za presecanje amiloidnog prekursorskog proteina.[79] Inhibicija proteolize se ostvaruje putem dva različita vida dejstva metala na supstrate: 1. APP ima mesto vezivanja za Zn2+ i nakon vezivanja dolazi do inhibicije presecanja na α-sekretaznom mestu, i 2. MMP enzimi ne presecaju agregirane amiloide. Za bakar i kobalt (50 μM) utvrđeno je da inhibiraju APP presecanje.[88] Direktna interakcija sa sekretazama nije potvrđena u APP studijama.
Osim amiloidnih plakova, Alchajmerovo moždano tkivo karakterišu neurofibrilarni spletovi. Istražuje se mnoštvo različitih faktora da bi se utvrdio uzrok ovog fenomena, uključujući abnormalni transport neurofilamenata i abnormalnu degradaciju. Pokazano je da aluminijum inhibira kalcijumom aktiviranu neutralnu proteinazu (kalpain II) koja posreduje razlaganje neurofilamentnih podjedinica i citoskeletalnih proteina.[74] AlCl3 i aluminijum laktat inhibiraju prečišćeni kalpain II, iz ljudskog cerebralnog korteksa, sa IC50 vrednošću od 200 μM i 400 μM, redom. Inhibicija dejstva kalpaina je posledica direktne interakcije sa enzimom, pošto preinkubacija supstrata [14C]metilazokazeina sa aluminijumom nema efekta na inhibitornu efikasnost. Aluminijumska inhibicija isto tako obuhvata interakciju sa citoskeletalnim proteinima, i u nekim slučajevima (npr. kod neurofilamentnih podjedinica NF-H i NF-M) aluminijum indukuje formiranje nerastvornih kompleksa uree. Stoga je inhibicija proteolize aluminijumom višestruki proces koji obuhvata direktno vezivanje za enzim, vezivanje za supstrat čime se ometa proteoliza, te formiranje supstratnih kompleksa koji su otporni na proteolizu. Aluminijum ima visok afinitet za fosfate i smatra se da se vezuje za fosforilisane grupe na neurofilamentnim proteinima.[74] Uprkos ovim interakcijama, mehanizam inhibicije kalpainina nije rasvetljen.
Takođe je pokazano da aluminijum inhibira metaboličke enzime u mozgu, čime se proizvode metaboličke greške. Moguće je da akumulacija takvih metaboličkih grešaka doprinosi neurološkim poremećajima kao što je Alchajmerova bolest. Heksokinaza, Mg(II)-zavisni enzim, katalizuje prvi korak u ciklusu glikolize, kojim se glukoza razlaže uz oslobađanje energije. Inhibicija heksokinaze je posredovana vezivanjem aluminijuma za supstrat; ATP ima 107 puta veći afinitet za Al(III) nego Mg(II).[75] Dok najveći deo glukoze podleže glikolizi, 15—20% se podvrgava heksozomonofosfatnom šantu. Jedan od ključnih enzima u ovom putu, glukoza-6-fosfat dehidrogenaza (G6PD), inhibira se posredstvom Al(III) (μM raspon).[75] Do toga dolazi usled direktne interakcije sa enzimom; Al(III)-vezani enzim podleže konformacionoj promeni do nasumičnije uređene strukture (sudeći po nalazima cirkularne dihroizne spektroskopije).

Trenutno se organski acetilholinesterazni inhibitori koriste u tretmanu Alchajmerove bolesti; međutim, porfirini cinka i gvožđa isto tako inhibiraju acetilholinesterazu.[76] Broj i pozicije fluorinskih grupa na porfirinskom prstenu imaju ogroman efekat na inhibitornu aktivnost.[89]
S obzirom da postoji evidencija da dolazi do akumulacije metalnih jona u nekoliko bolesti centralnog nervnog sistema (CNS), od znatnog interesa je da se utvrdi da li ova akumulacija ima ulogu u patogenezi bolesti, a ako je to slučaj i da se odredi biohemijska priroda njihovog učešća. U jednoj nedavnoj studiji, veliki broj lizozomalnih i citoplazmičnih proteinaza koje su prisutne u cerebralnom korteksu testiran je za inhibiciju metalnim jonima.[78] Utvrđeno je da milimolarne koncentracije Cu2+, Cd2+, Pb2+, Hg2+ i Zn2+ inhibiraju sve testirane lizozomalne proteinaze. Ovi joni isto tako inhibiraju citoplazmične proteinaze u različitim merama a u zavisnosti od metalnog jona. Prolinska endonukleaza i leucilna aminopeptidaza se inhibiraju 50% ili više sa Zn2+ i Cu2+, redom. Alanil-, leucil- i tripeptidilaminopeptidaze su inhibitirane sa 0,05 mM Fe2+. Piroglutamilna peptidaza se inhibira sa 0,05 mM Cu2+, Cd2+, Mn2+, Hg2+ ili Zn2+. Alanil- i ripeptidilaminopeptidaze, prolinska endopeptidaza, te piroglutamil aminopeptidaza, inhibirane su u različim merama sa Co2+ i Mn2+. Cd2+, Hg2+, Mn2+, Zn2+ i Al3+ inhibiraju kalpain I i II u različitim merama pri koncentraciji 5 mM. Implikacije ovih nalaza o metalnim jonama su predment istraživanja.
Iz ovih radova sledi da je uloga metalnih jona u neurološkim bolestima kompleksna i raznolika. Metalni joni demonstriraju raznovrstan asortiman efekata, od kinetičkih do strukturnih. Kinetički efekti mogu da budu inhibitorni ili aktivirajući. Strukturni efekti mogu da podstaknu agregaciju ili otežaju vezivanje. Ovi efekti nagoveštavaju da metalni joni mogu da budu intimatno uključeni u proces enzimske regulacije. Da bi se sprovela in vivo ispitivanja bilo bi neophodno da se ostvare milimolarne koncentracije metala u tkivima, što je normalno slučaj pod fiziološkim uslovima. Drugim rečima, potrebno je praviti razliku između potencijalno regulatornih procesa i toksičnih efekata.
Artritisne primene[uredi | uredi izvor]
| Artritisne primene | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| Auranofin, natrijum tiomalat | Au | proteinska kinaza C[90][91] | |
| trimetilaminski karboksiborani | B, Cu, Fe | elastaza, kolagenaza, lipoksigenaza, katepsin, ciklooksigenaza[92] | |
| jon | Al | kalpain I[93] | |
| aminski karboksiboranei i njihovi estri | B | inozin monofosfat, de novo regulatorni enzimi u sintezi lipida[94] | |
Jedinjenja zlata, kao što je auranofin, ekstenzivno su korišćena za tretman reumatoidnog artritisa, mada mehanizam njihovog dejstva još uvek nije utvrđen. Mnoge studije su demonstrirale inhibiciju lizozomalnih enzima[95][96] i proteinske kinaze C, što može da objasni imunosupresivno dejstvo soli zlata.[90][91]
Kompleksi bakra[97][98] i bakarni kompleksi antiinflamatornih lekova[99] pokazali su se efektivnim kao antiinflamatorni agensi. Postoje indikacije da ovi kompleksi utiču na više enzimskih sistema, a moguće je i da sam bakar ima ulogu u patogenezi bolesti. Oboleli od artritisa imaju povišene prosečne serumske ili plazmene koncentracije bakra, što je u direktnoj korelaciji sa jačinom i aktivnošću bolesti.[97] Utvrđeno je da bakar inhibira glutation-S-transferazu, a umanjena GST aktivnost je simptomatična za hronični artritis. Poznato je da su brojni od bakra zavisni enzimi neophodni za oporavak od upale tkiva.
Enzimi proteolitičkog puta su frekventno implicirani u destrukciju hrskavice obolelih od artritisa. Oni su metaloproteinaze, serinske proteaze i cisteinske proteaze, generalno prisutni u vezanom obliku sa prirodnim inhibitorima. Sistem kalpain-kalpastatina je značajan jer je kalpastatin (inhibitor kalpaina) autoantigen kod skoro 50% reumatoidnih artritisnih pacijenata i postoji evidencija da je kalpain prekomerno izražen kod artritisnih bolesnika.[100] Kalpain je Ca(II)-zavisna cisteinska proteaza koja se javlja u vidu dve izoforme: 1. kalpain I, za čiju aktivaciju se neophodne niske koncentracije kalcijuma, i 2. kalpain II, kome su potrebne visoke koncentracije. Joni aluminijuma različito utiču na ove dve izoforme u kalcijum-zavisnom maniru.[101] U prisustvu milimolarne koncentracije kalcijuma, Al inhibira kalpain II u koncentraciono zavisnom maniru, dok je kalpain I maksimalno inhibiran unutar uskog koncentracionog opsega (0,1—0,5 mM Al). U odsustvu kalcijuma, aluminijum aktivira kalpain II (koji je inače neaktivan).
Imajući u vidu efektivnost borana kao serinskoproteaznih inhibitora, ali i ulogu proteaza u artritisu, nije iznenađujuće da je utvrđeno da su brojni aminski karboksiborani antiinflamatorni agensi. Kompleksi bakra i gvožđa trimetilaminskih karboksiborana inhibiraju aktivnost lizozomalnih i proteolitičkih enzima u makrofagama,[92] kao i neki od samih aminskih karboksiborana.[94] Među inhibiranim enzimima su neutralni katepsin, tripsin, elastaza, kolagenaze I i II, prostaglandinska sintaza, ciklooksigenaza (indukovana kod inflamatornog artritisa)[102] i 5'-lipoksigenaza. Svi su inhibirani pri mikromolarnim koncentracijama.[92] Takođe je utvrđeno da aminski karboksiborani imaju mnoštvo drugih efekata, uključujući inhibiciju regulatornih enzima koji učestvuju u de novo sintezi lipida, DNK i RNK. Putem in vivo eksperimenata je isto tako utvrđeno da aminski karboksiborani vrše različite uticaje, uključujući snižavanje serumskog holesterola, blokiranje kalcijumske resorpcije (što je problematično kod osteoporoze) i redukovanje inflamacija.[94] Dalja istraživanja su neophodna da bi se utvrdila specifičnost ovih agenasa i strukturna svojstva koja utiču na razna terapeutska svojstva. Artritis je dobar primer bolesti u kojoj su metalni kompleksi ekstenzivno korišćeni kao terapija iako mehanizam dejstva nije poznat.
Primena na infekcije[uredi | uredi izvor]
Viralne primene[uredi | uredi izvor]
| Viralne primene | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| polioksovolframati | W | HIV reverzna transkriptaza, RNK polimeraza, DNK polimeraza[103] | |
| tiosemikarbazoni | Sn | reverzna transkriptaza virusa leukemije[104] | |
| TSAO | Si | HIV reverzna transkriptaza[105] | |
| trifluoperazin | V, Cu, Ni, Pd, Sn | reverzna transkriptaza virusa leukemije[106] | |
| streptonigrin | Zn | topoizomeraza, HIV reverzna transkriptaza[107] | |
| joni | Fe, U, V, Ti, Pb, Cu, Pd | proteinaza[108] | |
| batokuproinska disulfonska kiselina | Cu | proteaza, integraza[109] | |
| joni | Zn | proteaza[110] | |
| joni | Zn | renin, proteaza[108] | |
| inhibitorni helat | Cu | proteaza[111] | |
| fenantrolin, neokuproin, batokuproinski kompleksi | Cu | integraza[112] | |
| aromatični polihidroksilati | Mn | integraza, drugi enzimi kojima je potreban metal[113] | |
| porfirini | Fe, Co | hem oksigenaza[34] | |


Virusi koriste relativno mali broj, jedinstvenih enzima za održavanje svog životnog ciklusa, što čini te enzime atraktivnim metama za antivirusne lekove.[114] Na primer, genom virusa ljudske imunodeficijencije (HIV) kodira tri kritična enzima: 1. reverznu transkriptazu koja konvertuje infekcionu viralnu ssRNK u dsDNK, 2. integrazu koja umeće dsDNK u domaćinov genom, i 3. proteazu koja preseca virusne genske produkte do njihovih krajnjih formi.[115] Virusni enzimi su generalno u većoj meri konzervirani, a to je posebno slučaj sa njihovim aktivnim mestima u odnosu na pokrovne proteine, još jednu klasu metalekova; stoga su manje skloni razvoju mutacione otpornosti na lekove. Tokom poslednjih nekoliko dekada ogromni napori su uloženi u istraživanje načina sprečavanja propagacije HIV virusa, a jedan od glavnih terapijskih ciljeva je bila reverzna transkriptaza.
Reverzna transkriptaza (RT) prominentna je meta za inhibitore jer je distinktna u odnosu na normalne polimeraze ćelija domaćina i fizički odvojena od replikacione mašinerije domaćina (viralna transkriptaza je citoplazmatična, a ne jedrena). Reverzna transkriptaza je multifunkcionalni enzim. Ona deluje kao polimeraza koja formira plus i minus lance DNK i kao ribonukleaza H koja razlaže RNK porciju RNK-DNK hibrida.[116] Inhibicija može da bude usmerena na bilo koju od tih funkcija ili mesta vezivanja enzima, mada svi trenutno odobreni inhibitori utiču na polimeraznu funkciju.[117] Mnogi nukleozidni analozi i nenukleozidni inhibitori su razvijeni tokom poslednjih godina, ali relativno mali broj tih inhibitora su metalni kompleksi.
Polioksovolframati, a posebno serije silikovolframata iz keginske grupe, klasa su neorganskih jedinjenja za koje je pokazano da imaju antiviralno dejstvo.[103] Ova jedinjenja inhibiraju viralnu replikaciju u HIV-om infektiranim ćelijama i ispoljavaju kompetitivnu i nekompetitivnu inhibiciju prečišćene ili poli(etilen glikolom) precipitirane reverzne transkriptaze. Inhibicija RNK-zavisne DNK polimerazne funkcije se ostvaruje na 3—6 puta nižoj koncentraciji nego za DNK-zavisnu DNK polimeraznu aktivnost. Testovi na drugim prečišćenim DNK polimerazama indiciraju da su silikovolframova jedinjenja najsenzitivnija protiv virusa leukemije miševa (IC50 = 0,0035 μM), manje efektivna protiv HIV-1 RT (IC50 = 3 μM) i relativno neefektivna protiv ljudske DNK polimeraze 1 (IC50 = 43 μM). Mada je DNK polimeraza α donekle senzitivnija na inhibiciju od HIV-1 RT, testovi u kulturi su pokazali antiviralnu aktivnost bez citotoksičnosti; koncentracije neophodne za proizvodnju citotoksičnosti su nekoliko redova veličine više od koncentracije neophodne za eliminaciju virusa. Mada specifičnost tih jedinjenja protiv RT nije ustanovljena i tačno mesto inhibicije na RT nije poznato, njihovo antiviralno dejstvo u kulturama podstiče dalja istraživanja.
Tiosemikarbazoni su već duže vreme poznati kao antiviralni agensi. Diorganokalaj(IV) kompleksi piridil tiosemikarbazona su nedavno okarakterisani i utvrđeno je da inhibiraju RT.[104] Kompleksi bakra i kobalta istog liganda (L) takođe su ispitani.[118] Sn(Bu)2(L) i Sn(Ph)2(L) kompleksi su najefektivniji protiv RT, ali nisu testirani na drugim polimerazama da bi se utvrdila specifičnost inhibicije. Stoga se na bazi ovih studija antiviralno dejstvo jedinjenja ne može isključivo pripisati njihovoj inhibiciji RT. Takođe je poznato da tiosemikarbazoni inhibiraju ribonukleotidne reduktaze, RNK-zavisnu DNK polimerazu, te dihidrofolatnu reduktazu.[119]
Trifluoperazini (TFP), derivati psihoterapeutskog leka fenotiazina, takođe imaju potvrđeno antiviralno dejstvo. Metalni kompleksi TFP su testirani na RT virusa leukemije miševa, i ustanovljeno je da metali pospešuju inhibiciju u redosledu VO(IV) > Ni(II) > Pd(II) > Cu(II) > Sn(IV) > slobodni ligand.[106] Ovi kompleksi su efektivni protiv reverznih transkriptaza više retrovirusa. Streptonigrin je antibiotik koji je potencijalno mogao da deluje kao antitumorski agens za razne ljudske kancere; međutim, toksične nuspojave tretmana streptonigrinom su dovele do prekida kliničkih ispitivanja. Streptonigrin takođe selektivno inhibira TT ptičjeg mijeloblastoznog virusa (AMV) i HIV bez inhibiranja ćelijskih polimeraza.[107] Mehanizam dejstva streptonigrina je ispitan nakon prekida kliničkih ispitivanja. Pregled rezultata tih studija, uključujući detaljnu strukturnu karakterizaciju nekoliko metalnih kompleksa leka, pokazao je da je metalna jompleksacija ključna za biološku aktivnost leka.[107] Međutim, precizni mehanizam njegovog terapeutskog efekta je još uvek nepoznat.
Primena metal-helirajućih derivata TSAO-T, a [2',5'-bis-O-(tert-butildimetilsilil)-β-dribofuranozil]-3'-spiro-5-(4-amino-1,2-oksatiol-2,2-dioksid) nukleozidnog derivata timina predstavlja jedan drugačiji pristup poboljšanju inhibicije reverzne transkriptaze.[120] Roditeljsko jedinjenje, TSAO, vezuje se za alosterno mesto locirano pored RT katalitičkog mesta.[105] Ovo mesto vezivanja inhibitora formira interakcije sa obližnjim Mg2+ mestom vezivanja.[121] Nova klasa jedinjenja je dizajnirana sa vezanim inhibitorom, TSAO-T, za metalnu helirajuću grupu, jer se smatralo da će formirati bidentatni inhibitor sa većim afinitetom za enzim. Nekoliko derivata je bilo sintetisano, a za one sa kratkim alkilnim lancima je utvrđeno da su znatno efektivniji antiviralni agensi. Nekoliko derivata koji su jednako aktivni kao roditeljsko jedinjenje ima znatno manju toksičnost (10 puta manje koncentracije rezultuju sa 50% povećanja ćelijske održivosti). Ova klasa jedinjenja je primer inhibitora koji ne sadrže metal i inhibiraju putem formiranja metalnog kompleksa.
HIV-1 proteaza je aspartilna proteaza koja formira zrele proteine iz produkata gag gena (grupno specifičnih gena) i pol gena (DNK polimeraze). Otpornost na proteazne inhibitore se teže ostvaruje kod virusa nego otpornost na RT inhibitore,[122] te su razvijeni mnogi peptidni inhibitori.[68] Utvrđeno je da brojni metalni joni deluju kao inhibitori HIV-1 proteaze, a da su najefektivniji teški joni (Fe3+, UO22+, VO3−/VO43−, TiCp2Cl2, Pb2+), kao i da su oni uglavnom tetraedralno koordinirani.[108] Metali nekompetitivno inhibiraju enzim, tako što simultano sa supstratom zauzimaju aktivno mesto. Smatra se da se metali koordiniraju sa karboksilatnim bočnim lancima aktivnih ostataka Asp25 i Asp125, mada to nije definitivno potvrđeno. Moguće je da će ove obzervacije podstaći dizajn inhibitora HIV-1 proteaza koji će sadržati metale koji se vezuju za enzim jonskim ili kovalentnim vezama, te da će stoga biti znatno jače vezani od peptidnih inhibitora.
Goreopisana studija metalnih jona je naizgled u konfliktu sa rezultatima jedne ranije studije koja je pokazala da joni cinka i srebra nekompetitivno — a joni bakra kompetitivno inhibiraju proteaze i renin iz HIV-1.[108] Ranija studija je sprovedena na rekombinantnoj proteazi izolovanoj iz E. coli, dok je kasnija studija koristila sintetičku SF2 sekvencu proteaze, u kojoj je aminobutirna kiselina zamenjena cisteinskim ostatkom.[22][68][123][124] Nije sasvim jasno u kojoj meri sintetički enzim oponaša prirodni enzim. Isto tako, studije su izvedene na različitim pH vrednostima, ranije studije na neutralnom pH a kasnije na pH 5. Ranije studije su zapravo pokazale da je inhibicija cinkom u velikoj meri zavisna od pH. Procenjuje se dolazi do nadmetanja cinka sa protonom za grupu sa pKa = 7,0. Molekularne dinamičke simulacije izvedene na proteazi u prisustvu cinka indiciraju da se joni cinka vezuju za katalitički aktivno mesto na ostacima Asp25 i Asp25' bez poremećaja strukture enzima.[110]
Utvrđeno je da je CuCl2 efektivan inhibitor proteaze, ali ne i mutirane proteaze u kojoj su alanini supstituisani cisteinima.[125] Mutirana proteaza može inhibirati CuCl2 u prisustvu bakarnih helatora. Utvrđeno je da je batokuproin sulfonska kiselina Cu(I), BCSD-Cu(I), kompetitivni inhibitor proteaze.[109] Sama BCSD ne inhibira enzim, niti inhibicija kompleksa može da bude blokirana pomoću EDTA. Iz ovoga sledi da je metalni kompleks aktivni inhibitor, a ne slobodni ligand niti slobodni metal. Kompleks isto tako inhibira mutiranu proteazu kojoj nedostaju cisteni. Drugi bakarni helati inhibraju HIV-1 proteazu. Utvrđeno je da je diakva[bis(2-piridilkarbonil)amido]bakar(II) nitrat dihidrat kompetitivni inhibitor proteaze.[111] Ova studija takođe sugeriše da su molekuli vode u aktivnom mestu koji su prisutni između Asp25 i Asp125 važni za strukturu enzima. Ova činjenica može da utiče na dizajn inhibitora koji ne sadrže hidroksilne supstituente.
Utvrđeno je da bakarni kompleksi inhibiraju HIV integrazu.[112] Dolazi do nekompetitivne inhibicije mehanizmom koji se razlikuje od jednostavnog blokiranja vezivanja supstrata ili vezivanja DNK. Inhibicija mutanata C- i N-terminalnog brisanja ovim kompleksima ukazuje na činjenicu da se ovi kompleksi vezuju za sržni region integraze. Selektivnost kompleksa za integraze do sada nije demonstrirana. Integraze sadrže motive cinkovog prsta u blizini N-terminusa i konzervirani motiv aspartatnih i glutamatnih ostataka koji verovatno učestvuju u DNK vezivanju ili presecanju.[115] Oni takođe mogu da predstavljaju mesta potencijalnih interakcija sa metalnim kompleksima. Za veliki broj antrahinona i srodnih polihidroksilisanih fenolnih molekula je pokazano da inhibiraju integraze pri nanomolarnim koncentracijama.[113] Ova jedinjenja reaguju i sa drugim enzimima za čije dejstvo su neophodni metali (reverzne transkriptaze mišjeg leukemijskog virusa, MoMLV, i restrikcioni enzimi Pvu II i EcoRI), ali ne i sa enzimima kojima nisu potrebni metali. Iz ove činjenice proizilazi da metali učestvuju u inhibitornom mehanizmu. Za neka od testiranih jedinjenja je poznato da su metalni helatori. MoMLV inhibicija je efikasnija u prisustvu Mn2+ nego Mg2+ (do 26 puta manje vrednosti IC50 u zavisnosti od jedinjenja). Ovaj efekat je uočen i kod integraze.[126] Poznato je da katalitički domen integraze vezuje metale, a inhibicija može da obuhvati formiranje tercijarnog kompleksa inhibitora, metala i enzima; međutim, to ovo još uvek nije dokazano.
Opisani inhibitori viralnih enzima uglavnom nemaju ekskluzivnu specifičnost. Izuzev derivata TSOA-T, inhibitori ove klase nisu dizajnirani za interakciju sa specifičnim mestima. Mnogi inhibitori su identifikovani skriningom prvo za inhibiciju viralne replikacije a zatim za aktivnost na prečišćenim enzimima.
Neviralne primene[uredi | uredi izvor]
- Bakterije, glijvice i paraziti
| Antimikrobne primene | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| 1-amino-3-(2-piridil)izohinolin, joni | Cu | NADH oksidaza, laktatna dehidrogenaza[127] | |
| sulfadiazin | Ag | fosfomanozna izomeraza[128] | |
| trovalentna jedinjenja arsena | As | tripanotionska reduktaza, glutationska reduktaza[129] | |
| [XxMxOoHh]n- | Mo, V | kiselinska fosfataza[130] | |
| šećerni kompleksi | Ni | hitinaza[131] | |
| trovalentna jedinjenja amonijaka | Sb | fosfofruktokinaza[132] | |
| pentostam | Sb | klinički demo[133] | |
| tiosemikarbazoni | Cu | dihidrofolatna reduktaza[119] | |
| jon | V | ektokiselinska fosfataza[134] | |
| titanil sulfati | Ti | serinske proteaze[65] | |
Neke od najranijih primena neorganskih jedinjenja u medicini su bile u vidu antiseptika i antimikrobnih agenasa.[44][67][135] Zapravo, organoarsenična jedinjenja su bila prva jedinjenja koja su uspešno primenjena za tretman sifilisa (ona su kasnije zamenjena penicilinom), a korišćena su kao aditivi stočne hrane za sprečavanje bakterijskih i parazitskih infekcija.[67] Sulfanilamidi su velika klasa jedinjenja koja ispoljava antibakterijsku efektivnost, a poznato je i nekoliko metalnih jona koji imaju antimikrobno dejstvo.[136] Organometalna jedinjenja se rutinski testiraju za antimikrobne efekte radi identifikacije mogućih lekova. Osim agenasa koji inhibiraju enzime, postoji mnoštvo agenasa čiji mehanizam nije poznat.[137][138][139][140][123]
Jedna nedavna studija se bavila ispitivanjem inhibicije serinskih proteaza kod bakterija i gljivica radi razvoja antimikrobinih agenasa. Skrining velikog broja metalnih jona na tripsinu iz raznih izvora (prečišćenih i u bakterijskim lizatima) i goveđem pankreasnom himotripsininu pokazao je da samo Ti(IV) u obliku titanilnog sulfata inhibira tripsin, dok drugi metali ili uvećavaju aktivnost (Ca2+, Mn2+) ili nemaju efekta.[65] Ova inhibicija je kompetitivna, što znači da se inhibitor vezuje za aktivno mesto. Inhibicija himotripsina nije uočena, te je predloženo da se Ti(IV) vezuje za Asp-198 u supstratnom mestu vezivanja za ostatak koji nije prisutan kod himotripsina. Utvrđeno je da su titanilni alkoholni kompleksi manje inhibitorni (25% inhibitorne aktivnosti) nego sulfati. Petokoordinatna geometrija Ti(IV) bila je razmatrana kao moguće objašnjenje uočene aktivnosti Ti(IV) protiv bakterija u odnosu na druge metalne jone i geometrije.
Trivalentni arsenični lekovi, kao što je melarzoprol, još uvek se rutinski koriste u tretmanu tripanozomom posredovanih bolesti, kao što je afrička bolest spavanja. Mehanizam njihovog dejstva nije ispitan, mada se smatra da je posledica interakcije sa proteinskim ditiolima. Poznato je da trivalentna jedinjenja arsena formiraju stabilne adukte sa ditiol tripanotionom, te da se ti adukti efektivnije nadmeću za aktivno mesto tripanotion reduktaze.[141] Tripanotion, koji je analogan glutationu kod sisara, jedinstven je za tripanozome. Jedna nedavna studija je ispitala uticaj nekoliko jedinjenja arsenika na tripanotionsku i glutationsku reduktazu, dva enzima koja sadrže katalitičke sulfidrilne grupe.[129] Inhibicija oba enzima je znatno senzitivnija u prisustvu NADPH, što je indikacija da cisteinski sulfidrili moraju da budu redukovani da bi formirali interakcije sa lekovima. Tripanotionska reduktaza je senzitivnija na inhibiciju od glutationske reduktaze. Inhibiciju obustavlja dihidrotripanotion. Iako jedinjenja arsena inhibiraju enzim, pošto je dihidrotripanotion in vivo dostupan u znatno višim koncentracijama od tripanotionske reduktaze, malo je verovatno da bi inhibicija ovog enzima mogla da ima terapeutski učinak na tripanozomijazu.
Antimonijali su dugo korišćeni kao antiparazitici,[67][135] i još uvek se koriste u tretmanu sluzokožne lišmanijaze.[133] Niz drugih metala se ispituje za njihovu aktivnost protiv lišmanijaze. Postoje indikacije da kiselinske fosfataze (ACP) doprinose patogenosti tripanosoma Leishmania. Te fosfataze mogu da inhibiraju brojni prelazni metali i njihovi kompleksi, kao što su arsenat i vanadat.[134] Studije u kojima je korišćena tartratno senzitivna kiselinska fosfataza iz ljudskog semenog fluida i tartratno rezistentna fosfataza iz protozoe Leishmania donovani demonstrirale su da heteropolianjonski kompleksi molibdena (sa Ge, Fe, As, Ce, Th) selektivno inhibiraju ove enzime.[130] Testirane su četiri klase kompleksa, koje sadrže 4, 6—8, 12 ili 18 atoma Mo. Selektivnost je procenjena na osnovu inhibicije pomenutih enzima i odsustva ACP inhibicije iz ljudske slezine. β-glukuronidaze i α-manozidaze iz slezine su takođe ispoljile malo ili nimalo inhibicije usled dejstva molibdenat-heteropolianjona. Studije unakrsnog nadmetanja između ovih inhibitora indiciraju da se neki od kompleksa vezuju za aktivno mesto, dok se drugi vezuju za drugo mesto koje utiče na aktivno mesto. Na primer, vezivanje vanadata i jednog od kompleksa Mo nije bilo uzajamno isključivo, a vanadat je pojačavao inhibiciju Mo kompleksa.
Antimon se takođe primenjuje kao antišistozomijalni agens. Nedavnim istraživanjima je utvrđeno da razni antimonijali inhibiraju fosfofruktokinazu (PFK) iz metilja Schistosoma mansoni.[132] Opstanak šistozoma je zavisan od velike brzine glikolize, a PFK je ključni enzim u glikolitičkom putu — sadrži 20 cisteina. Upoređivanjem šistozomalne i sisarske PFK je utvrđeno da antimoniltartarat kalijum preferentno inhibira parazitov enzim. Mehanizam ove selektivnosti nije razjašnjen.
Metalni joni i metalni kompleksi su efektivni antifungalni agensi protiv patogenog kvasca Candida albicans. Kompleksi srebra inhibiraju fosfomanoznu izomerazu (PMI), ključni enzim u biosintezi kvaščanih ćelijskih zidova, sa nM Ki.[128] PMI mutant kod koga je Cys150 zamenjen sa alaninom ponaša se na sličan način kao i prirodni enzim, ali ne biva inhibiran jedinjenjima srebra i 1000 puta je manje senzitivan na živu. Iz ovoga proizilazi da je Cys150 mesto interakcije inhibitora. Joni srebra inhibiraju PMI sa 210 puta višom bimolekularnom konstantom brzine za ljudski enzim. Ova jedinjenja redukuju specifičnost za ljudski enzim do 1,3 : 1. I dok ih ovo ne kvalifikuje kao inhibitore koji su selektivni za parazite, može se pretpostaviti da je moguće razviti lek putem modifikacija organskih grupa. Kompleksi nikla inhibiraju hitinazu, koja takođe učestvuje u biohemiji ćelijskog zida kvasca-gljive C. albicans.[131] Pomenuti kompleksi sadrže N-glikozide izvedene iz aminošećera, koji inhibiraju u kompetitivnom maniru.
Mikoplazmi nedostaje čvrst ćelijski zid. Jonski bakar je efektivan inhibitor mikoplazične aktivnosti i pokazano je da inhibira enzime u glikolitičkom putu, NADH oksidazu i laktatnu dehidrogenazu.[127] 2,2'-bipiridinski tip liganda olakšava transport bakra kroz mikoplazmičnu membranu, pa je antimikoplazmično dejstvo bakra znatno povećano u prisustvu ovih liganda — mada prisustvo liganda umanjuje inhibitorni efekat na prečišćenim, izolovanim enzimima. Ova opažanja potvrđuju da je jon bakra toksičan materijal, a da ligand samo služi kao prenosnik.
- Tretman čireva
| Tretman čireva | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| joni | Bi | fekalna sluzokožna sulfataza[142] | |
| joni | Bi | H. pylori ATPaza[143] | |
Bizmutove soli su korišćene u terapiji čireva. Poznato je da one inhibiraju adenozintrifosfatazu iz želučane bakterije H. pylori (koja učestvuje u razviću peptičnog čira),[143] kao i fekalnu sluzokožnu sulfatazu (čije je izražavanje povišeno kod ulceroznog kolitisa).[142]
Toksičnost primene[uredi | uredi izvor]
| Toksičnost primene | |||
|---|---|---|---|
| Kompleks | Metal | Inhibirani enzim | |
| ions | Al | γ-aminolevulinska kiselina[144] | |
| joni | Al | heksokinaza[145] | |
| joni | Cd, Cu, Hg, Zn, Pb | heksokinaza[146] | |
| joni | Al | glicerolna kinaza[147] | |
| joni | Al, Cd, Pb | ATPaza[148] | |
| joni | As | poli-(ADP-riboza) polimeraza[149] | |
| joni | As | piruvatna dehidrogenaza, DNK ligaza[150] | |
| joni | As | metiltransferaza[151] | |
| joni | As | metiltransferaza[152] | |
| arsenoglutation | As | glutationska reduktaza[153] | |
| 3-arsonopiruvat | As | Fosfoenolpiruvatna mutaza[154] | |
| jon | Ni | DNK polimeraza[155] | |
| jon | Zn, Cd | DNK ligaza[156] | |
| jon | Cd | O6-metilguanin-DNA metiltransferaya, DNK polimeraza β[157] | |
| cis-DDP | Pt | respiratorni enzimi[158] | |
| joni | V | peroksidaza rena, superoksid dismutaza[124] | |
| jon | Ni | MutT-dGTPaza[159] | |
| jon | Pb | γ-aminolevulinatna dehidrataza[160] | |

Velika količina rada je uložena da bi se odredio molekularni mehanizam metalne toksičnosti. Uzrok smrtnosti je kombinacija više faktora. Razumevanje puteva na koje metali utiču je prerekvizit za sprečavanje toksičnosti, te pruža uvid u potencijalne primene u kojima se toksičnost iskorišćava za proizvodnju korisnih efekata. Aluminijumska toksičnost indukuje anemiju, a smatra se da do ovoga dolazi usled perturbacije biosintetičkog puta hema.[144] Uočeno je da aluminijum inhibira brojne enzime in vitro, uključujući dehidratazu δ-aminolevulinske kiseline (aka porfobilinogenu sintazu),[144] heksokinaze,[145] glicerolne kinaze[147] i ATPazu.[148] Mehanizam inhibicije se razlikuje od enzima do enzima. Dehidrataza δ aminolevulinske kiseline koja katalizuje drugi korak biosinteze hema je metaloprotein koji vezuje osam jona cinka. Aluminijum nekompetitivno inhibira ove enzime, iz čega sledi da se ne vezuje za aktivno mesto, te da se verovatno nadmeće sa nekim ili svim jonima cinka.[144] Jonski prečnik Al3+ je sličan prečniku Mg2+ ili Fe3+, a moguće je da aluminijum inhibira Mg2+-zavisne enzime putem supstitucije za Mg2+ (na primer u heksokinazi),[147] mada ovo nije bilo uočeno u svim studijama.[145] Za glicerolne kinaze i heksokinaze je takođe postulirano da se aluminijum nadmeće sa MgATP supstratom u obliku aluminijum-ATP helatnog kompleksa.[145][147] Kinetika inhibicije može da pomogne u određivanju prirode inhibicionog mesta, ali su strukturne studije neophodne za određivanje preciznog toka interakcije.
Druge studije su demonstrirale da Cd2+, Cu2+, Hg2+, Zn2+ i Pb2+ inhibiraju heksokinazu (u niskom μM opsegu).[146] Cd2+ i Cu2+ su mnogo efektivniji od drugih metala. Inhibicija pomoću Cu2+ dovodi do pratećeg sniženja nivoa redukovanog glutationa (GSH). Preinkubacija uzorka sa GSH zaštićuje enzim od Cu2+ inhibicije. Poznato je da GSH formira GSH-Cu(I) komplekse, a zaštitni efekti GSH kompleksa su verovatno posledica jednostavnog uklanjanja Cu2+ iz rastvora. Predloženi su brojni modeli za relaciju između heksokinaze, GSH i toksičnosti teških metala in vivo.
Postoje indikacije da je arsenična toksičnost redoks zavisna, tako da je pentavalentni As(V) znatno manje toksičan od trivalentne forme elementa, As(III).[153][151] Arsenik je karcinogen, mada direktno ne oštećuje DNK. Najprominentnija hipoteza za njegov mehanizam delovanja je inhibicija enzima putem vezivanja za sulfhidrile, te je znatan broj studija bio usredsređen na ispitivanje dejstva arsenika na enzime popravke i ligacije DNK. Utvrđeno je da As(III) inhibira enzim poli-(ADP-riboza) polimerazu, koji sadrži dva vicinalna ditiola koji posreduju vezivanje enzima za prekide DNK lanaca.[149] Mehanizam inhibicije još uvek nije utvrđen. Piruvatnu dehidrogenazu inhibira As(III) pri mikromolarnim koncentracijama, ali ne i As(V). Nekoliko drugih enzima za DNK popravku je testirano i utvrđeno je da na njih As(III) nema uticaja, mada neki sadrže SH grupe od presudnog značaja za svoju funkciju.[150] Arsenit može da inhibira ligaznu aktivnost u kultivisanim ćelijama ali ne i u nuklearnim ekstraktima iz tih ćelija, iz čega sledi da inhibicija ligaza nije direktna već se javlja na nekom drugom nivou popravke.[150] Spektroskopske studije As(III) inhibicije metiltransferaze (enzima koji učestvuje u modifikaciji i popravci nepodudarnih DNK segmenata) indiciraju da se As(III) vezuje za Cys223, čime indukuje efekat teškog atoma (HAE) na obližnjem Trp ostatku. Ovo je potvrđeno opservacijom da se HAE ne javlja kod mutanta sa Cys223 zamenjenim Ser223 ostatkom.[151][152] Pojava HAE je zasnovana na nalazima crvenog pomaka fosforescentnog spektra i znatnog skraćenja životnog veka tripletnog stanja As(III)-perturbiranog triptofana. Ova interakcija ne utiče na enzimsku aktivnost, tako da je inhibicija koja je uočena u prisustvu viška arsenita verovatno posledica vezivanja za druge cistenske ostatke enzima.
Inhibicija glutationske reduktaze sa As(III) konzistentna je sa oksidacijom tiolnih grupa u aktivnom mestu enzima.[153] Arsen formira arsenoglutationske komplekse sa glutationom, i oni deluju kao inhibitori mešovitog tipa na glutationskoj reduktazi. Enzimi koji deluju na forsfornim jedinjenjima često prepoznaju arsenske analoge, npr. adenilatna ciklaza i RNK polimeraza. Pokazano je da 3-arsonopiruvat kompetitivno inhibira fosfoenolpiruvatnu (PEP) mutazu sa Ki = 27 μM.[154] PEP mutaza je glavni enzim u biosintetičkom putu formiranja C-P veza. Nikl je poput arsena genotoksičan karcinogen, mada precizni mehanizam toksičnosti Ni nije poznat. Ni(II) služi kao slaba zamena za Mg(II) u nekim polimerazama, dok druge polimeraze bivaju jako inhibirane.[155] Efekat jona nikla na inkorporaciju nukleotida, procesivnost i misinkorporaciju proučavan je kod sedam različitih polimeraza; izveden je zaključak da je njegov primarni efekat inhibicija (mikromolarni opseg). Međutim, ovo zavisi od brojnih faktora čiji značaj varira od enzima do enzima. Dejstvo nikla je kompleksno, a precizni mehanizam ometanja polimerazne funkcije nije ustanovljen. Inhibicija replikacije i popravke DNK povezana je sa mutagenošću i karcinogenošću metalnih jona.[157] Uočeno je da Ni(II) inhibira MutT-dGTPazu, koja učestvuje u popravci 8-okso-dGTP oštećenja na DNK (milimolarni Ki).[159] Ćelije izložene oksidativnom stresu formiraju 8-okso-dGTP; prisustvo nukleotida povišava mutacionu frekvenciju A u C transverzijama usled 8-okso-dG-dA nesparivanja. Inhibicija Mg(II)-zavisnog MutT enzima popravke može da dovede do povišene mutageneze. Studije molekulskim modelovanjem ukazuju da se Ni(II) ne vezuje za mesto vezivanja Mg(II), nego da indukuje konformacione promene za koje je predviđeni uzrok vezivanje za histidinske ostatke.[159]
Uočeno je da cink i kadmijum takođe inhibiraju enzime DNK popravke.[157] Prečišćena DNK ligaza se inhibira sa 0,8 mM ZnCl2 i 0,04 mM CdCl2.[156] Oba metala inhibiraju formiranje intermedijera, transferazno dejstvo i ligaciono dejstvo, a nemaju efekta na brzinu misligacije. Drugim rečima, inhibicija jedino utiče na enzimsku aktivnost dok se tačnost rada lizage ne menja. Ligazama je neophodan magnezijum kao kofaktor; Mg je neophodan za sve tri koraka ligacione reakcije koja inhibira kadmijum i cink. Joni Cd i Zn mogu da deluju putem supstituisanja jona Mg u mestu vezivanja metala.
Jedan od metala s lošom reputacijom u očima javnosti je olovo. Trovanje olovom zauzima istaknuto mesto u javnoj svesti zbog mnoštva incidenata uzrokovanih primenom olova na radnim mestima, kao i zbog trovanja dece olovnim bojama.[160] Jedan od mehanizama toksičnosti je inhibicija cink metaloenzima, odnosno γ-aminolevulinatne dehidrataze (ALAD) koja je takođe nekompetitivno inhibirana aluminijumom. U slučaju olova, inhibicija se odvija putem supstitucije cinka olovom. Dva alela ALAD enzima su identifikovana kod ljudi (ALAD1 i ALAD2) i oni kodiraju tri distinktna izozima. Testiranje velikog broja dece (izložene niskim nivoima olova u životnoj sredini) i radnika iz olovoprerađivačkih fabrika pokazala su da ALAD2 pozitivni imaju povišene nivoe olova u krvi nakon sličnih izlaganja i da su znatno senzitivniji na trovanje olovom. Pretpostavlja se da ALAD2 jače vezuje olovo.[160]
Metalna toksičnost može da bude rezultat oksidativnih reakcija. Vanadat učestvuje u mnoštvu takvih reakcija, a nedavno je objavljena studija u kojoj je izučavano njegovo dejstvo na antioksidantne enzime.[124] Četiri različita enzima su razmatrana i utvrđeno je da vanadat inhibira peroksidazu rena. Ovi nalazi doduše ne daju jasnu indikaciju o relaciji između antioksidantske enzimske inhibicije i toksičnosti.
Znatan deo literature se bavi jednim drugim mehanizmom inhibicije enzimske aktivnosti metalnim jonima: redukcijom količine enzima usled inhibiranja transkripcije gena koji kodiraju enzim.[163][164] Najvećim delom, rezultati ispitivanja naglašavaju da je toksičnost uzrokovana metalnim jonima posledica inhibicije koja se javlja na mnogim nivoima u mnogim sistemima, te da je malo verovatno da bilo koja pojedinačna promena može da bude samostalno odgovorna za toksične efekte.
Vidi još[uredi | uredi izvor]
- Analog prelaznog stanja
- Antimetabolit
- Farmakofor
- Inhibicija enzimskih reakcija
- Proteomika bazirana na aktivnosti — grana proteomike koja koristi kovalentne inhibitore enzima kao indikatore pri izučavanju enzimske aktivnosti
Reference[uredi | uredi izvor]
- ^ Cannon, J. B. (1993). „Pharmaceutics and drug delivery aspects of heme and porphyrin therapy”. J. Pharm. Sci. 82: 435—446. PMID 8360819. doi:10.1002/jps.2600820502.
- ^ а б Tsangaris, J. M.; Williams, D. R. (1992). „Tin in pharmacy and nutrition”. Appl. Organomet. Chem. 6: 3—18. PMID 11192741. doi:10.1002/aoc.590060103.
- ^ а б Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenompmid=1734381. - ^ Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenom10.1021/cr9804285. - ^ а б в Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenompmid=1371161. - ^ а б в Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenompmid1542552. - ^ Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenompmid1610897. - ^ Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenompmid1551526. - ^ Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenompmid8265722. - ^ Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenompmid7853192. - ^ Marks, J. A.; Maines, M. D. (1992). „Tin-Protoporphyrin-Mediated Disruption In Vivo of Heme Oxygenase-2 Protein Integrity and Activity in Rat Brain” (PDF). Pediatr. Res. 32: 324—329. PMID 1408470. doi:10.1203/00006450-199209000-00016.
- ^ Hintz, S. R.; Vreman, H. J.; Stevenson, D. K. (1990). „Mortality of metalloporphyrin-treated neonatal rats after light exposure”. Dev. Pharmacol. 14: 187—192. PMID 2364856.
- ^ Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenompmid7843765. - ^ а б Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenompmid8353156. - ^ а б Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenompmid8445977. - ^ Cable, E.; Cable, J.; Bonkovsky, H. (1993). „Repression of hepatic δ-aminolevulinate synthase by heme and metalloporphyrins: Relationship to inhibition of heme oxygenase”. Hepatology. 18: 119—127. PMID 8325603. doi:10.1002/hep.1840180119.
- ^ Lathrop, J. T.; Timko, M. P. (1993). „Regulation by heme of mitochondrial protein transport through a conserved amino acid moti”. Science. 259: 522—525. PMID 8424176. doi:10.1126/science.8424176.
- ^ Bhasker, C. R.; Burgiel, G.; Neupert, B.; Emery-Goodman, A.; Kuhn, L. C.; May, B. K. (1993). „The Putative Iron-Responsive Element in the Human Erythroid 5-Aminolevulinate Synthase mRNA Mediates Translational Control” (PDF). JBC. 268: 12699—12705. PMID 8509404.
- ^ а б Serfass, L.; Burstyn, J. (1998). „Effect of heme oxygenase inhibitors on soluble guanylyl cyclase activity”. Arch. Biochem. Biophys. 359: 8—16. PMID 9799554. doi:10.1006/abbi.1998.0887.
- ^ а б Luo, D.; Vincent, S. (1994). „Metalloporphyrins inhibit nitric oxide-dependent cGMP formation in vivo”. Eur. J. Pharmacol.-Mol. Pharmacol. Sec. 267: 263—267. PMID 7522180. doi:10.1016/0922-4106(94)90149-X.
- ^ а б в г д Mariotto, S.; Cuzzolin, L.; Adami, A.; DelSoldato, P.; Suzuki, H.; Benoni, G. (1995). „Inhibition by sodium nitroprusside of the expression of inducible nitric oxide synthase in rat neutrophils”. Brit. J. Pharmacol. 114: 1105—1106. PMID 7542530. doi:10.1111/j.1476-5381.1995.tb13320.x.
- ^ а б Vickroy, T.; Malphurs, W. (1995). „Inhibition of nitric oxide synthase activity in cerebral cortical synaptosomes by nitric oxide donors: evidence for feedback autoregulation”. Neurochem. Res. 20: 299—304. PMID 7541898. doi:10.1007/BF00969546.
- ^ а б в Perry, J.; Marletta, M. (1998). „Effects of transition metals on nitric oxide synthase catalysis”. PNAS. 95: 11101—11106. PMID 9736696. doi:10.1073/pnas.95.19.11101.
- ^ а б Persechini A, McMillan K, Masters BS (1995). „Inhibition of Nitric Oxide Synthase Activity by Zn2+ Ion”. Biochemistry. 34: 15091—15095. PMID 7578122. doi:10.1021/bi00046a015.
- ^ а б Siegfried, G.; Amiel, C.; Friedlander, G. (1996). „Inhibition of Ecto-5′-nucleotidase by Nitric Oxide Donors”. J. Biol. Chem. 271: 4659—4664. PMID 8617729.
- ^ а б в Thomas, S.; Mohr, D.; Stocker, R. (1994). „Nitric oxide inhibits indoleamine 2,3-dioxygenase activity in interferon-gamma primed mononuclear phagocytes” (PDF). J. Biol. Chem. 269: 14457—14464. PMID 7514170.
- ^ а б в г Nicolaou, A.; Waterfield, C.; Kenyon, S.; Gibbons, W. (1997). „The Inactivation of Methionine Synthase in Isolated Rat Hepatocytes by Sodium Nitroprusside”. Eur. J. Biochem. 244: 8876—882. PMID 9108260. doi:10.1111/j.1432-1033.1997.00876.x.
- ^ а б Sato, T.; Kamata, Y.; Irifune, M.; Nishikawa, T. (1995). „Inhibition of purified (Na+,K+)-ATPase activity from porcine cerebral cortex by NO generating drugs”. Brain Res. 704: 117—120. PMID 8750971. doi:10.1016/0006-8993(95)01165-X.
- ^ Bredt, D. S.; Snyder, S. H. (1992). „Nitric oxide, a novel neuronal messenger”. Neuron. 8: 3—11. PMID 1370373. doi:10.1016/0896-6273(92)90104-L.
- ^ Jaffrey, S. R.; Snyder, S. H. (1996). „PIN: An associated protein inhibitor of neuronal nitric oxide synthase”. Science. 274: 774—777. PMID 8864115. doi:10.1126/science.274.5288.774.
- ^ а б Marletta, M. A. (1994). „Nitric oxide synthase: Aspects concerning structure and catalysis” (PDF). Cell. 78: 927—930. PMID 7522970. doi:10.1016/0092-8674(94)90268-2.
- ^ а б Moore, P. K.; Handy, R. L. C. (1997). „Selective inhibitors of neuronal nitric oxide synthase – is no NOS really good NOS for the nervous system?”. Trends Pharm. Sci. 18: 204— 211. PMID 9226999. doi:10.1016/S0165-6147(97)01064-X.
- ^ Bredt, D. S.; Snyder, S. H. (1990). „Isolation of nitric oxide synthetase, a calmodulin-requiring enzyme”. PNAS. 87: 682—685. PMID 1689048. doi:10.1073/pnas.87.2.682.
- ^ а б Weiss, G.; Lutton, J.; Fuchs, D.; Wernerfelmayer, G.; Bock, G.; Abraham, N.; Kappas, A.; Levere, R.; Wachter, H. (1993). „Comparative Effects of Heme and Metalloporphyrins on Interferon-γ-Mediated Pathways in Monocytic Cells (THP-1)”. Proc. Soc. Exp. Biol. Med. 202: 470—475. PMID 8456113. doi:10.3181/00379727-202-43561.
- ^ а б Meffert, M.; Haley, J.; Schulman, E.; Schulman, H.; Madison, D. (1994). „Inhibition of hippocampal heme oxygenase, nitric oxide synthase, and long-term potentiation by metalloporphyrins”. Neuron. 13: 1225—1233. PMID 7524564. doi:10.1016/0896-6273(94)90060-4.
- ^ а б Bing, O.; Grundemar, L.; Ny, L.; Moller, C.; Heilig, M. (1995). „Modulation of carbon monoxide production and enhanced spatial learning by tin protoporphyrin”. Neuroreport. 6: 1369—1372. PMID 7488726. doi:10.1097/00001756-199507100-00002.
- ^ а б в Pedregosa, J. C.; Casanova, J.; Alzuet, G.; Borras, J.; Garcia-Granda, S.; Diaz, M. R.; Guttierez-Rodriguez, A. (1995). „Metal complexes of 5-tertbutyloxycarbonylamido-1,3,4-thiadiazole-2-sulfonamide (B-H2ats), a carbonic anhydrase inhibitor. Synthesis and characterization of the copper(II) complex. Crystal structures of B-H2ats and the [Cu(B-ats)(NH3)2]2 dimer complex”. Inorg. Chim. Acta. 232: 117—124. doi:10.1016/0020-1693(94)04376-7.
- ^ а б Supuran, C. T.; Mincione, F.; Scozzafava, A.; Briganti, F.; Mincione, G.; Ilies, M. A. (1998). „Carbonic anhydrase inhibitors — Part 52. Metal complexes of heterocyclic sulfonamides: A new class of strong topical intraocular pressure-lowering agents in rabbits”. Eur. J. Med. Chem. 22: 247—254. doi:10.1016/S0223-5234(98)80059-7.
- ^ а б в Supuran CT, Scozzafava A, Saramet I, Banciu MD (1998). „Carbonic anhydrase inhibitors: inhibition of isozymes I, II and IV with heterocyclic mercaptans, sulfenamides, sulfonamides and their metal complexes”. J. Enzyme Inhib. 13: 177—194. PMID 9629536. doi:10.3109/14756369809028339.
- ^ а б Turkmen H, Durgun M, Yilmaztekin S, Emul M, Innocenti A, Vullo D, Scozzafava A, Supuran CT (1997). „Carbonic anhydrase inhibitors. Part 50. Interaction of isoenzymes I and II of carbonic anhydrase with Ge(IV) and Sb(III) derivatives”. Main Group Met. Chem. 20: 641—647. PMID 15603956. doi:10.1016/j.bmcl.2004.10.070.
- ^ а б Supuran, C. T. (1996). „Complexes with biologically active ligands. Part 3. Synthesis of coordination compounds of chlorothiazide with divalent metal ions”. Main Group Met. Chem. 19: 347—353. doi:10.1515/MGMC.1996.19.6.339.
- ^ а б Koppenho¨fer, A.; Hartmann, U.; Vahrenkamp, H. (1995). „Zinc Complexes of Drugs Containing Nitrogen Heterocycles”. Chem. Ber. 128: 779—785. doi:10.1002/cber.19951280807.
- ^ а б Gonzalez, E. B.; Farkas, E.; Soudi, A. A.; Tan, T.; Yanovsky, A. I.; Nolan, K. B. (1997). „Metal complexes of the angiotensin-converting enzyme inhibitor,lisinopril. Solution studies and the crystal and molecular structure ofa dimeric copper(II)-lisinopril complex”. J. Chem. Soc., Dalton Trans.: 2377—2379. doi:10.1039/A701500C.
- ^ а б Abrams MJ, Murrer BA (1993). „Metal compounds in therapy and diagnosis”. Science. 261: 725—730. PMID 8102010. doi:10.1126/science.8102010.
- ^ а б Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenompmid2492116. - ^ Sly WS, Hu PY (1995). „Human carbonic anhydrases and carbonic anhydrase deficiencies”. Annu. Rev. Biochem. 64: 375—401. PMID 7574487. doi:10.1146/annurev.bi.64.070195.002111.
- ^ Bergenhem, N. (1996). „Chromatographic and electrophoretic methods related to the carbonic anhydrase isozymes”. J. Chromatogr. B. 684: 289—305. PMID 8906478. doi:10.1016/0378-4347(95)00566-8.
- ^ Albert, D. M.; Jakobiec, F. M., ur. (1994). Principles and practice of ophthalmology. Philadelphia: W. B. Saunders. ISBN 978-0-7216-3416-6.
- ^ Heagerty, A. M. (1991). „Functional and structural effects of ACE inhibitors on the cardiovascular system”. Cardiology. 79: 3—9. PMID 1913721. doi:10.1159/000174899.
- ^ Kureya, P.; Beevers, D. G. (1991). „The mechanisms of hypertension and the role of ACE inhibitors”. J. Human Hypertension. 5: 3—8. PMID 1791616.
- ^ Pandurangi, R. S.; Katti, K. V.; Stillwell, L.; Barnes, C. L. (1998). „Retention of Inhibitory Potency of an ACE Inhibitor Conjugated with Rh(III) and Pd(II) (Iminophosphorano)phosphines. Synthesis and X-ray Structural Investigations”. J. Am. Chem Soc. 120: 11364—11373. doi:10.1021/ja9802403.
- ^ а б Bagger, S. (1993). „The binding of cobalt(III)-ligated amino acids and peptides to chymotrypsin and trypsin”. J. Inorg. Biochem. 52: 165—171. PMID 8254339.
- ^ а б в Bagger, S.; Wagner, K. J. (1998). „Molecular recognition of cobalt(III)-ligated peptides by serine proteases: the role of electrostatic effects”. Peptide Res. 52: 273—282. PMID 9832305. doi:10.1111/j.1399-3011.1998.tb01241.x.
- ^ а б Takeuchi, T.; Bottcher, A.; Quezada, C.; Simon, M.; Meade, T.; Gray, H. (1998). „Selective Inhibition of Human α-Thrombin by Cobalt(III) Schiff Base Complexes”. J. Am. Chem. Soc. 120: 8555—8556. doi:10.1021/ja981191x.
- ^ а б Böttcher, A.; Takeuchi, T.; Hardcastle, K.; Meade, T.; Gray, H.; Cwikel, D.; Kapon, M.; Dori, Z. (1997). „Spectroscopy and Electrochemistry of Cobalt(III) Schiff Base Complexes”. Inorg. Chem. 36: 2498—2504. doi:10.1021/ic961146v.
- ^ а б Takeuchi, T.; Böttcher, A.; Quezada, C. M.; Meade, T. J.; Gray, H. B. (1999). „Inhibition of thermolysin and human alpha-thrombin by cobalt(III) Schiff base complexes”. Bioorg. Med. Chem. 6: 1—5. PMID 10400334.
- ^ а б в Tsilikounas, E.; Kettner, C.; Bachovchin, W. (1992). „Identification of serine and histidine adducts in complexes of trypsin and trypsinogen with peptide and nonpeptide boronic acid inhibitors by proton NMR spectroscopy”. Biochemistry. 31: 12839—12846. PMID 1463754. doi:10.1021/bi00166a019.
- ^ а б в Tsilikounas, E.; Kettner, C.; Bachovchin, W. (1993). „Boron-11 NMR spectroscopy of peptide boronic acid inhibitor complexes of .alpha.-lytic protease. Direct evidence for tetrahedral boron in both boron-histidine and boron-serine adduct complexes”. Biochemistry. 32: 12651—12655. PMID 8251483. doi:10.1021/bi00210a013.
- ^ а б Suenaga, H.; Nakashima, K.; Shinkai, S. (1995). „Sugars intensify the inhibitory effect of phenylboronic acid on the hydrolytic activity of α-chymotrypsin”. J. Chem. Soc., Chem. Commun.: 29—30. doi:10.1039/C39950000029.
- ^ а б Katz, B.; Finermoore, J.; Mortezaei, R.; DH, R.; Stroud, R. (1995). „Episelection: Novel Ki .apprx. Nanomolar Inhibitors of Serine Proteases Selected by Binding or Chemistry on an Enzyme Surface”. Biochemistry. 34: 8264—8280. doi:10.1021/bi00026a008.
- ^ а б Geratz, J.; Tidwell, R.; Schwab, J.; Anderle, S.; Pryzwansky, K. (1990). „Sequential events in the pathogenesis of streptococcal cell wall-induced arthritis and their modulation by bis(5-amidino-2-benzimidazolyl)methane (BABIM)”. Am. J. Pathol. 136: 909—921. PMID 2327474.
- ^ а б в г Katz, B.; Clark, J.; Finer-Moore, J.; Jenkins, T.; Johnson, C.; Ross, M.; Luong, C.; Moore, W.; Stroud, R. (1998). „Design of potent selective zinc-mediated serine protease inhibitors”. Nature. 391: 608—612. PMID 9468142. doi:10.1038/35422.
- ^ а б Rice, K.; Tanaka, R.; Katz, B.; Numerof, R.; Moore, W. (1998). „Inhibitors of tryptase for the treatment of mast cell-mediated diseases”. Curr. Pharm. Des. 4: 381—396. PMID 10197050.
- ^ а б в Thorpe, H. H. (1998). „Bioinorganic chemistry and drug design: here comes zinc again”. Chem. Biol. 5: R125—R127. PMID 9653544. doi:10.1016/S1074-5521(98)90166-1.
- ^ а б в г Duffy, B.; Schwietert, C.; France, A.; Mann, N.; Culbertson, K.; Harmon, B.; McCue, J. P. (1998). „Transition metals as protease inhibitors”. Biol. Trace Element Res. 64: 197—213. PMID 9845474. doi:10.1007/BF02783336.
- ^ Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenompmid38682. - ^ а б в г Thayer, J. S. (1984). Organometallic compounds and living organisms. New York: Academic Press. ISBN 978-0-12-686080-1.
- ^ а б в Babine, R. E.; Bender, S. L. (1997). „Molecular Recognition of Protein−Ligand Complexes: Applications to Drug Design”. Chem. Rev. 97: 1359—1472. PMID 11851455. doi:10.1021/cr960370z.
- ^ Bone, R.; Frank, D.; Kettner, C. A.; Agard, D. A. (1989). „Structural analysis of specificity: .alpha.-lytic protease complexes with analogs of reaction intermediates”. Biochemistry. 28: 7600—7609. PMID 2611204. doi:10.1021/bi00445a015.
- ^ Louie, A. Y.; Meade, T. J. (1998). „A cobalt complex that selectively disrupts the structure and function of zinc fingers”. PNAS. 95: 6663—6668. PMID 9618469. doi:10.1073/pnas.95.12.6663.
- ^ а б Mork, A. (1993). „Actions of Lithium on the Cyclic AMP Signalling System in Various Regions of the Brain - Possible Relations to its Psychotropic Actions -: A Study on the Adenylate Cyclase in Rat Cerebral Cortex, Corpus Striatum and Hippocampus”. Pharmacol. Toxicol. 71: 1—47. doi:10.1111/j.1600-0773.1993.tb01704.x.
- ^ а б в г Clauberg, M.; Joshi, J. G. (1993). „Regulation of serine protease activity by aluminum: implications for Alzheimer disease”. Proc. Natl. Acad. Sci. U.S.A. 90: 1009—1012. PMID 7679214.
- ^ а б Rao, K. S. J.; Rao, G. V. (1994). „Effect of aluminium (Al) on brain mitochondrial monoamine oxidase-A (MAO-A) activity--an in vitro kinetic study”. Mol. Cell. Biochem. 137: 57—60. PMID 7845378. doi:10.1007/BF00926039.
- ^ а б в г Nixon, R. A.; Clarke, J. F.; Logvinenko, K. B.; Tan, M. K. H.; Hoult, M.; Grynspan, F. (1990). „Aluminum inhibits calpain-mediated proteolysis and induces human neurofilament proteins to form protease-resistant high molecular weight complexes”. J. Neurochem. 55: 1950—1959. PMID 2121904. doi:10.1111/j.1471-4159.1990.tb05781.x.
- ^ а б в г д Joshi, J. G.; Dhar, M.; Clauberg, M.; Chauthaiwale, V. (1994). „Iron and aluminum homeostasis in neural disorders”. Environ. Health Perspect. 102: 207—213. PMID 7843099. doi:10.2307/3431788.
- ^ а б Lee, B. H.; Park, M. B.; Yu, B. S. (1998). „Inhibition of electric eel acetylcholinesterase by porphin compounds”. Bioinorg. Med. Chem. Lett. 8: 1467—1470. PMID 9873371. doi:10.1016/S0960-894X(98)00236-4.
- ^ Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenomISSN 0168-8561. - ^ а б Falkous, G.; Harris, J. B.; Mantle, D. (1995). „Effect of neurotoxic metal ions in vitro on proteolytic enzyme activities in human cerebral cortex”. Clin. Chim. Acta. 238: 125—135. PMID 7586572. doi:10.1016/0009-8981(95)06081-N.
- ^ а б в г Cuajungco, M. P.; Lees, G. K. (1997). „Zinc metabolism in the brain: relevance to human neurodegenerative disorders”. Neurobiol. Dis. 4: 137—169. PMID 9361293. doi:10.1006/nbdi.1997.0163.
- ^ Hay, R. W. (1984). Bio-inorganic Chemistry. New York: Ellis Horwood Limited. ISBN 978-0-85312-200-5.
- ^ а б в Atwood, C. S.; Moir, R. D.; Huang, X. D.; Scarpa, R. C.; Bacarra, N. M. E.; Romano, D. M.; Hartshorn, M. K.; Tanzi, R. E.; Bush, A. I. (1998). „Dramatic aggregation of Alzheimer abeta by Cu(II) is induced by conditions representing physiological acidosis”. J. Biol. Chem. 273: 12817—12826. PMID 9582309. doi:10.1074/jbc.273.21.12817.
- ^ а б в Fitzgerald, D. J.; Maggio, J. E.; Esler, W. P.; Stinson, E. R.; Jennings, J. M.; Ghilardi, J. R.; Mantyh, P. W.; Bush, A. I.; Moir, R. D.; Rosenkranz, K. M.; Tanzi, R. E. (1995). „Zinc and Alzheimer's disease”. Science. 268: 1920—1923. PMID 7604268.
- ^ Mantyh, P. W.; Ghilardi, J. R.; Rogers, S.; Demaster, E.; Allen, C. J.; Stimson, E. R.; Maggio, J. E. (1993). „Aluminum, iron, and zinc ions promote aggregation of physiological concentrations of beta-amyloid peptide”. J. Neurochem. 61: 1171—1174. PMID 8360682. doi:10.1111/j.1471-4159.1993.tb03639.x.
- ^ а б Huang, X. D.; Atwood, C. S.; Moir, R. D.; Hartshorn, M. A.; Vonsattel, J. P.; Tanzi, R. E.; Bush, A. I. (1997). „Zinc-induced Alzheimer's Abeta1-40 aggregation is mediated by conformational factors”. J. Biol. Chem. 272: 26464—26470. PMID 9334223. doi:10.1074/jbc.272.42.26464.
- ^ а б Bush, A. I.; Pettingell, W. H.; Multhaup, G.; Paradis, M. D.; Vonsattel, J. P.; Gusella, J. F.; Beyreuther, K.; Masters, C. L.; Tanzi, R. E. (1994). „Rapid induction of Alzheimer A beta amyloid formation by zinc”. Science. 265: 1464—1467. PMID 8073293.
- ^ Dyrks, T.; Dyrks, E.; Hartmann, T.; Masters, C.; Beyreuther, K. (1992). „Amyloidogenicity of beta A4 and beta A4-bearing amyloid protein precursor fragments by metal-catalyzed oxidation” (PDF). J. Biol. Chem. 267: 18210—18217. PMID 1517249.
- ^ Bondy, S. C.; Guo-Ross, S. X.; Truong, A. T. (1998). „Promotion of transition metal-induced reactive oxygen species formation by beta-amyloid”. Brain Res. 799: 91—96. PMID 9666089. doi:10.1016/S0006-8993(98)00461-2.
- ^ Cuajungco, M. P.; Lees, G. (1997). „Zinc and Alzheimer's disease: is there a direct link?”. J. Brain Res. Rev. 23: 219—236. PMID 9164672. doi:10.1016/S0165-0173(97)00002-7.
- ^ Sugumoto, H.; Iimura, Y.; Yamanishi, Y.; Yamatsu, K. (1995). „Synthesis and structure-activity relationships of acetylcholinesterase inhibitors: 1-benzyl-4-[(5,6-dimethoxy-1-oxoindan-2-yl)methyl]piperidine hydrochloride and related compounds”. J. Med. Chem. 38: 4821—4829. PMID 7490731. doi:10.1021/jm00024a009.
- ^ а б Danning, C. L.; Boumpas, D. T. (1998). „Commonly used disease-modifying antirheumatic drugs in the treatment of inflammatory arthritis: an update on mechanisms of action”. Clin. Exp. Rheumatol. 16: 595—604. PMID 9779311.
- ^ а б Hashimoto, K.; Whitehurst, C. E.; Matsubara, T.; Hirohata, K.; Lipsky, P. E. (1992). „Immunomodulatory effects of therapeutic gold compounds. Gold sodium thiomalate inhibits the activity of T cell protein kinase C”. J. Clin. Invest. 89: 1839—1848. PMID 1351061. doi:10.1172/JCI115788.
- ^ а б в Rajendran, K. G.; Sood, A.; Spielvogel, B. F.; Hall, I. H.; III, V. M. N.; Morse, K. W. (1995). „Anti-Osteoporotic activity of metal complexes of amine carboxyboranes”. Appl. Organomet. Chem. 9: 111—119. doi:10.1002/aoc.590090204.
- ^ Zhang, Z. Y.; Reardon, I. M.; Hui, J. O.; O’Connell, K. L.; Poorman, R. A.; Heinrikson, R. L. (1991). „Zinc inhibition of renin and the protease from human immunodeficiency virus type 1”. Biochemistry. 30: 8717—8721. PMID 1888732. doi:10.1021/bi00100a001.
- ^ а б в Hall, I. H.; Chen, S. Y.; Rajendran, K. G.; Sood, A.; Spielvogel, B. F.; Shih, J. (1994). „Hypolipidemic, anti-obesity, anti-inflammatory, anti-osteoporotic, and anti-neoplastic properties of amine carboxyboranes”. Environ. Health Perspect. 102: 21—30. PMID 7889876. doi:10.2307/3431958.
- ^ Pugh, M. C.; Pugh, C. B. (1987). „Current concepts in clinical therapeutics: disease-modifying drugs for rheumatoid arthritis”. Clin. Pharm. 6: 475—491. PMID 3319362.
- ^ Baker, D. G.; Rabinowitz, J. L. (1986). „Current concepts in the treatment of rheumatoid arthritis”. J. Clin. Pharmacol. 26: 2—21. PMID 3512617.
- ^ а б Sorenson, J. R. J. (1982). Sigel, H.; Marcel Dekker, ur. Metal ions in biological systems. 14. New York. ISBN 9780824715694.
- ^ Naughton, D. P.; Knappitt, J.; Fairburn, K.; Gaffney, K.; Blake, D. R.; Grootveld, M. (1995). „Detection and investigation of the molecular nature of low-molecular-mass copper ions in isolated rheumatoid knee-joint synovial fluid”. FEBS Lett. 362: 167—172. PMID 7698317. doi:10.1016/0014-5793(95)00165-6.
- ^ Miche, H.; Brumas, V.; Berthon, G. (1997). „Copper(II) interactions with nonsteroidal antiinflammatory agents. II. Anthranilic acid as a potential. OH-inactivating ligand”. J. Inorg. Biochem. 68: 27—38. PMID 9379178. doi:10.1016/S0162-0134(97)00005-6.
- ^ Menard, H. A.; Amine, M. E. (1996). „The calpain-calpastatin system in rheumatoid arthritis”. Immunol. Today. 17: 545—547. PMID 8991283. doi:10.1016/S0167-5699(96)30064-9.
- ^ Zhang, H.; Johnson, P. (1992). „Differential effects of aluminum ion on smooth muscle calpain I and calpain II activities”. Int. J. Biochem. 24: 1773—1778. PMID 1451912. doi:10.1016/0020-711X(92)90127-M.
- ^ Frolich, J. C. (1997). „A classification of NSAIDs according to the relative inhibition of cyclooxygenase isoenzymes”. Trends Pharm. Sci. 18: 30—34. PMID 9114728. doi:10.1016/S0165-6147(96)01017-6.
- ^ а б Moore, P.; Jones, C.; Mahmood, N.; Evans, I.; Goff, M.; Cooper, R.; Hay, A. (1995). „Anti-(human immunodeficiency virus) activity of polyoxotungstates and their inhibition of human immunodeficiency virus reverse transcriptase” (PDF). Biochem. J. 307: 129—134. PMID 7536411.
- ^ а б Casas, J.; Rodriguez-Arguelles, M.; Russo, U.; Sanchez, A.; Sordo, J.; Vazquez-Lopez, A.; Pinelli, S.; Lunghi, P.; Bonati, A.; Albertini, R. (1998). „Diorganotin(IV) complexes of pyridoxal thiosemicarbazone: synthesis, spectroscopic properties and biological activity”. J. Inorg. Biochem. 69: 283—292. PMID 9654752. doi:10.1016/S0162-0134(98)00004-X.
- ^ а б Chamorro, C.; Camarasa, M. J.; Perez-Perez, M. J.; Clercq, E. D.; Balzarini, J.; Felix, A. S. (1998). „An approach towards the synthesis of potential metal-chelating TSAO-T derivatives as bidentate inhibitors of human immunodeficiency virus type 1 reverse transcriptase”. Antiviral Chem. Chemother. 9: 413—423. PMID 9875394.
- ^ а б Nacsa, J.; Nagy, L.; Molnar, J.; Molnar, J. (1998). „Trifluoperazine and its metal complexes inhibit the Moloney leukemia virus reverse transcriptase”. Anticancer Res. 18: 1373—1376. PMID 9673343.
- ^ а б в Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenompmid8230091. - ^ а б в г Woon, T.; Brinkworth, R.; Fairlie, D. (1992). „Inhibition of HIV-1 proteinase by metal ions”. Int. J. Biochem. 24: 911—914. PMID 1612181. doi:10.1016/0020-711X(92)90096-J.
- ^ а б Davis, D. A.; Branca, A. A.; Pallenberg, A. J.; Marschner, T. M.; Patt, L. M.; Chatlynne, L. G.; Humphrey, R. W.; Yarchoan, R.; Levine, R. L. (1995). „Inhibition of the human immunodeficiency virus-1 protease and human immunodeficiency virus-1 replication by bathocuproine disulfonic acid Cu1+”. Arch. Biochem. Biophys. 322: 127—134. PMID 7574666. doi:10.1006/abbi.1995.1444.
- ^ а б York, D. M.; Darden, T. A.; Pedersen, L. G.; Anderson, M. W. (1993). „Molecular modeling studies suggest that zinc ions inhibit HIV-1 protease by binding at catalytic aspartates”. Environ. Health Perspect. 101: 246—250. PMID 8404763.
- ^ а б Lebon, F.; deRosny, E.; Reboud-Ravauz, M.; Durant, F. (1998). „De novo drug design of a new copper chelate molecule acting as HIV-1 protease inhibitor”. Eur. J. Med. Chem. 33: 733—737. doi:10.1016/S0223-5234(98)80032-9.
- ^ а б Mazumder, A.; Gupta, M.; Perrin, D. M.; Sigman, C. S.; Ranbinovitz, M.; Pommier, Y. (1995). „Update on long-term symptomless HIV type 1 infection in recipients of blood products from a single donor”. AIDS Res. Hum. Retroviruses. 11: 1. PMID 7734182. doi:10.1089/aid.1995.11.1.
- ^ а б Farnet, C. M.; Wang, B.; Hansen, M.; Lipford, J. R.; Zalkow, L.; Robinson, W. E. J.; Siegel, J.; Bushman, F. (1998). „Human immunodeficiency virus type 1 cDNA integration: new aromatic hydroxylated inhibitors and studies of the inhibition mechanism”. Antimicrob. Agents Chemother. 42: 2245—2253. PMID 9736543.
- ^ Perrin, D. D.; Stunzi, H. (1982). Metal ions and chelating agents in antiviral chemotherapy. New York: Marcel Dekker.
- ^ а б LaFemina, R. L.; Schneider, C. L.; Robbins, H. L.; Callahan, P. L.; LeGrow, K.; Roth, E.; Schleif, W. A.; Emini, E. A. (1992). „Requirement of active human immunodeficiency virus type 1 integrase enzyme for productive infection of human T-lymphoid cells”. J. Virol. 66: 7414—7419. PMID 1433523.
- ^ Tarrago-Litvak, L.; Andreola, M.; Nevinsky, G. A.; Sarih-Cottin, L.; Litvak, S. (1994). „The reverse transcriptase of HIV-1: from enzymology to therapeutic intervention”. FASEB J. 18: 497—503. PMID 7514143.
- ^ Huang, H.; Chopra, R.; Verdine, G. L.; Harrison, S. C. (1998). „Structure of a covalently trapped catalytic complex of HIV-1 reverse transcriptase: implications for drug resistance”. Science. 282: 1669—1675. PMID 9831551. doi:10.1126/science.282.5394.1669.
- ^ Ferrari, M. B.; Fava, G. G.; Tarasconi, R.; Albertini, S.; Pinelli, R.; Starcich, J. (1994). „Synthesis, spectroscopic and structural characterization, and biological activity of aquachloro (pyridoxal thiosemicarbazone) copper(II) chloride”. J. Inorg. Biochem. 53: 13. PMID 8133248. doi:10.1016/0162-0134(94)80017-0.
- ^ а б Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenompmid8098234. - ^ Das K, Bauman JD, Rim AS, Dharia C, Clark AD Jr, Camarasa MJ, Balzarini J, Arnold E (28. 04. 2011). „Crystal structure of tert-butyldimethylsilyl-spiroaminooxathioledioxide-thymine (TSAO-T) in complex with HIV-1 reverse transcriptase (RT) redefines the elastic limits of the non-nucleoside inhibitor-binding pocket”. J Med Chem. 54 (8): 2727—37. PMID 21446702. doi:10.1021/jm101536x.
- ^ Spence, R. A.; Kati, W. M.; Anderson, K. S.; Johnson, K. A. (1995). „Mechanism of inhibition of HIV-1 reverse transcriptase by nonnucleoside inhibitors”. Science. 267: 988—993. PMID 7532321. doi:10.1038/nsb0495-303.
- ^ West, M. L.; Fairlie, D. P. (1995). „Targeting HIV-1 protease: a test of drug-design methodologies”. Trends Pharmacol. Sci. 16: 67—75. PMID 7762084. doi:10.1016/S0165-6147(00)88980-4.
- ^ а б Wisniewski, M. Z.; Surga, W. J.; Piekos, R. (1995). „Silver(I) compounds of some sulfonamides”. Polish J. Chem. 69: 987—991.
- ^ а б в Serra, M.; Pintar, A.; Casella, L.; Sabbioni, E. (1992). „Vanadium effect on the activity of horseradish peroxidase, catalase, glutathione peroxidase, and superoxide dismutase in vitro”. J. Inorg. Biochem. 46: 161—174. PMID 1325536. doi:10.1016/0162-0134(92)80027-S.
- ^ Karlstrom, A. R.; Levine, R. L. (1991). „Copper inhibits the protease from human immunodeficiency virus 1 by both cysteine-dependent and cysteine-independent mechanisms” (PDF). PNAS. 88: 5552—5556. PMC 51915
 .
.
- ^ Hazuda, D. J.; Felock, P. J.; Hastings, J. C.; Prmanik, B.; Wolfe, A. L. (1997). „Differential divalent cation requirements uncouple the assembly and catalytic reactions of human immunodeficiency virus type 1 integrase” (PDF). J. Virol. 71: 7005—7011. PMID 9261430.
- ^ а б DeZwart, M.; vanderGoot, H.; Timmerman, H. (1991). „Influence of Co(II), Ni(II), Cu(II), Zn(II) and Cd(II) on growth inhibition and enzyme activity of Mycoplasma gallisepticum in the absence or presence of a 2,2′-bipyridyl type ligand”. Eur. J. Med. Chem. 26: 101—108. doi:10.1016/0223-5234(91)90218-C.
- ^ а б Wells, T. N. C.; Scully, P.; Paravicini, G.; Proudfoot, A. E. I.; Payton, M. A. (1995). „Mechanism of irreversible inactivation of phosphomannose isomerases by silver ions and flamazine”. Biochemistry. 34: 7896—7903. PMID 7794901. doi:10.1021/bi00024a014.
- ^ а б Cunningham, M. L.; Zvelebil, M. J. J. M.; Fairlamb, A. H. (1994). „Mechanism of inhibition of trypanothione reductase and glutathione reductase by trivalent organic arsenicals”. Eur. J. Biochem. 221: 285—295. PMID 8168518. doi:10.1111/j.1432-1033.1994.tb18740.x.
- ^ а б Saha, A. K.; Crans, D. C.; Pope, M. T.; Simone, C. M.; Glew, R. H. (1991). „Inhibition of human seminal fluid and Leishmania donovani phosphatases by molybdate heteropolyanions” (PDF). J. Biol. Chem. 266: 3511—3517. PMID 1995614.
- ^ а б Yano, S.; Inoue, S.; Nouchi, R.; Mogami, K.; Shinohara, Y.; Yasuda, Y.; Kato, M.; Tanase, T.; Kakuchi, T.; Mikata, Y.; Suzuki, T.; Yamamoto, Y. (1998). „Antifungal nickel(II) complexes derived from amino sugars against pathogenic yeast, Candida albicans”. J. Inorg. Biochem. 69: 15—23. PMID 9606935.
- ^ а б Su, J. J.; Mansour, J. M.; Mansour, T. E. (1996). „Purification, kinetics and inhibition by antimonials of recombinant phosphofructokinase from Schistosoma mansoni”. Mol. Biochem. Parasitol. 81: 171—178. PMID 8898332. doi:10.1016/0166-6851(96)02702-8.
- ^ а б Saenz, R. E.; Rodriguez, C. C. D.; Johnson, C. M.; Berman, J. D. (1991). „Efficacy and toxicity of pentostam against Panamanian mucosal leishmaniasis”. Am. J. Trop. Med. 44: 394—398. PMID 1645930.
- ^ а б Meyer-Fernandes, J. R.; Dutra, P. M. L.; Rodrigues, C. O.; Saad-Nehme, J.; Lopes, A. H. C. S. (1997). „Mg-dependent ecto-ATPase activity in Leishmania tropica”. Arch. Biochem. Biophys. 341: 40—46. PMID 9143351.
- ^ а б Kendrick, M. J.; May, M. T.; Plishka, M. J.; Robinson, K. D. (1992). „Metals in Biological Systems”. New York: Ellis Horwood. ISBN 978-0-13-577727-5.
- ^ Bult, A. (1983). Sigel, H., ur. Metal ions in biological systems. 16. New York: Marcel Dekker. doi:10.1080/00945718208063132.
- ^ Garg, R. K.; Sharma, L. M. J. Indian Chem. Soc. (1995). „Binuclear transition metal complexes of some novel Schiff bases derived from dapsone (an antileprotic drug). Part II. Zinc(II) complexes”. 72: 231—234. ISSN 0019-4522.
- ^ Hueso-Urena, F.; Moreno-Carretero, M. N.; Romero-Molina, M. A.; Salas-Peregrin, J. M.; Sanchez-Sanchez, M. P.; Cienfuegos-Lopez, G. A. D.; Faure, R. J. (1993). „Transition metal complexes with monodeprotonated isoorotic and 2-thioisoorotic acids: Crystal structure, spectral and magnetic study, and antimicrobial activity”. Inorg. Biochem. 51: 613—632. doi:10.1016/0162-0134(93)85033-5.
- ^ Ibrahim, S. A.; El-Gyar, S. A.; El-Gahani, M. A. (1991). „Metal complexes of nitrogen-oxygen donor ligands as potential drugs”. Collect. Czech. Chem. Commun. 56: 1333—1339. doi:10.1135/cccc19911333.
- ^ Nagar, R.; Mohan, G. J. (1992). „Studies on mixed-ligand complexes of some transition metals of biological interest”. Therm. Anal. 38: 1415—1431.
- ^ Fairlamb, A. H.; Henderson, G. B.; Cerami, A. (1989). „Trypanothione is the primary target for arsenical drugs against African trypanosomes” (PDF). PNAS. 86: 2607—2611. PMID 2704738.
- ^ а б Tsai, H.; Dwarakanath, A.; Hart, C.; Milton, J.; Rhodes, J. (1995). „Increased faecal mucin sulphatase activity in ulcerative colitis: a potential target for treatment” (PDF). Gut. 36: 570—576. PMID 7737566.
- ^ а б Beil, W.; Birkholz, C.; Wagner, S.; Sewing, K. (1995). „Bismuth subcitrate and omeprazole inhibit Helicobacter pyloriF1-ATPase”. Pharmacology. 50: 333—337. PMID 7667394. doi:10.1159/000139299.
- ^ а б в г Schroeder, T.; Caspers, M. (1996). „Kinetics of aluminum-induced inhibition of delta-aminolevulinic acid dehydratase in vitro”. Biochem. Pharmacol. 52: 927—931. PMID 8781512. doi:10.1016/0006-2952(96)00449-2.
- ^ а б в г Exley, C.; Price, N.; Birchall, J. (1994). „Aluminum inhibition of hexokinase activity in vitro: a study in biological availability”. J. Inorg. Biochem. 54: 297—304. PMID 8014638. doi:10.1016/0162-0134(94)80035-9.
- ^ а б Canesi, L.; Ciacci, C.; Piccoli, G.; Stocchi, V.; Viarengo, A.; Gallo, G. (1998). „In vitro and in vivo effects of heavy metals on mussel digestive gland hexokinase activity: the role of glutathione”. Comp. Biochem. Physiol. C. 120 (2): 261—268. PMID 9827040. doi:10.1016/S0742-8413(98)10004-X.
- ^ а б в г Yoshino, M.; Murakami, K.; Kawano, K. (1998). „Interaction of aluminum ion with ATP. Mechanism of the aluminum inhibition of glycerol kinase and its reversal by spermine”. Biometals. 11: 63—67. doi:10.1023/A:1009213508942.
- ^ а б Hyppo¨nen, S.; Kohila, T.; Tahti, H. (1993). „The effects of cadmium, lead and aluminum on neural cell membrane adenosinetriphosphatase activity”. Neurosci. Res. Commun. 12: 77—84.
- ^ а б Yager, J. W.; Wiencke, J. K. (1997). „Inhibition of poly(ADP-ribose) polymerase by arsenite”. Mutat. Res. 386: 345—351. PMID 9219571. doi:10.1016/S1383-5742(97)00011-2.
- ^ а б в Hu, Y.; Su, L.; Snow, E. T. (1998). „Arsenic toxicity is enzyme specific and its affects on ligation are not caused by the direct inhibition of DNA repair enzymes”. Mutat. Res. 408: 203—218. PMID 9806419. doi:10.1016/S0921-8777(98)00035-4.
- ^ а б в Tsao, D.; Maki, A. (1991). „Optically detected magnetic resonance study of the interaction of an arsenic(III) derivative of cacodylic acid with EcoRI methyltransferase”. Biochemistry. 30: 4565—4572. PMID 2021649. doi:10.1021/bi00232a029.
- ^ а б Lam, W.; Tsao, D.; Maki, A.; Maegley, K.; Reich, N. (1992). „Spectroscopic studies of arsenic(III) binding to Escherichia coli RI methyltransferase and to two mutants, C223S and W183F”. Biochemistry. 31: 10438—10442. PMID 1420162. doi:10.1021/bi00158a004.
- ^ а б в Styblo, M.; Thomas, D. (1995). „In vitro inhibition of glutathione reductase by arsenotriglutathione”. Biochem. Pharmacol. 49: 971—977. PMID 7741769. doi:10.1016/0006-2952(95)00008-N.
- ^ а б Chawla, S.; Mutenda, E.; Dixon, H.; Freeman, S.; Smith, A. (1995). „Synthesis of 3-arsonopyruvate and its interaction with phosphoenolpyruvate mutase”. Biochem. J. 308: 931—935. PMID 8948453.
- ^ а б Snow, E.; Xu, L.; Kinney, P. (1993). „Effects of nickel ions on polymerase activity and fidelity during DNA replication in vitro”. Chem.-Biol. Interact. 88: 155—173. PMID 8403077. doi:10.1016/0009-2797(93)90089-H.
- ^ а б Yang, S. W.; Becker, F. F.; Chan, J. Y. H. (1996). „Inhibition of human DNA ligase I activity by zinc and cadmium and the fidelity of ligation”. Environ. Health Perspect. 28: 19—25. PMID 8698042. doi:10.1002/(SICI)1098-2280(1996)28:1<19::AID-EM5>3.0.CO;2-9.
- ^ а б в Hartwig, A. (1994). „Role of DNA repair inhibition in lead- and cadmium-induced genotoxicity: a review”. Environ. Health Perspect. 102: 45—50. PMID 7843136. doi:10.2307/3431762.
- ^ Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenompmc2002465. - ^ а б в Porter, D. W.; Nelson, V. C.; Fivash, M. J. J.; Kasprzak, K. S. (1996). „Mechanistic studies of the inhibition of MutT dGTPase by the carcinogenic metal Ni(II)”. Chem. Res. Toxicol. 9: 1375—1381. PMID 8951243. doi:10.1021/tx9600816.
- ^ а б в Wetmur, J. G. (1994). „Influence of the common human delta-aminolevulinate dehydratase polymorphism on lead body burden”. Environ. Health Perspect. 102: 215—219. PMID 7843101. doi:10.2307/3431789.
- ^ Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenomNizvan_97-20230321214409. - ^ Greška kod citiranja: Nevažeća oznaka
<ref>; nema teksta za reference pod imenomNizvan_98-20230321214409. - ^ Thiele, D. J. (1992). „Metal-regulated transcription in eukaryotes” (PDF). Nuc. Acids Res. 20: 1183—1191. PMID 1561077.
- ^ O’Halloran, T. V. (1993). „Transition metals in control of gene expression”. Science. 261: 715—725. PMID 8342038. doi:10.1126/science.8342038.
Literatura[uredi | uredi izvor]
- Berg JM, Tymoczko JL, Stryer L (2002). Biochemistry (V izd.). New York, NY: W. H. Freeman. ISBN 978-0-7167-3051-4.
- Cornish-Bowden A, ur. (1997). New Beer in an Old Bottle: Eduard Buchner and the Growth of Biochemical Knowledge. Universitat de València. ISBN 978-84-370-3328-0.
- H, Suzuki (2015). How Enzymes Work: From Structure to Function. Boca Raton, FL: CRC Press. ISBN 978-981-4463-92-8.
- Cornish-Bowden A (2012). Fundamentals of Enzyme Kinetics (IV izd.). Weinheim: Wiley-VCH. ISBN 978-3527330744.
- Briggs, G. E.; J. B. S. Haldane (1925). „A note on the kinetics of enzyme action”. Biochem. J. 19: 339—339. PMC 1259181
 .
. - R.R. Dogonadze; V.G. Levich (1959). „Theory of Non-radiative Electronic Transitions between Ions in Solution”. Dokladi Akademii Nauk SSSR. Ser. Fizicheskoy Khimii. Moscow. 124: 123—126.
- R.R. Dogonadze (1960). „Rate of Electron Transfer Reactions in Solutions”. Dokladi Akademii Nauk SSSR. Ser. Fizicheskoy Khimii. Moscow. 133: 1368—1371.
- M, Nishimura; Chance B. (1963). „Studies on the electron-transfer systems in photosynthetic bacteria I. The light-induced absorption-spectrum changes and the effect of phenylmercuric acetate”. Biochim Biophys Acta. 66: 1—16. doi:10.1016/0006-3002(63)91162-4.
- V.G. Levich; R.R. Dogonadze; E.D. German; A.M. Kuznetsov; Yu.I. Kharkats (1970). „Theory of Homogeneous Reactions Involving Proton Transfer”. Electrochim.Acta. 15: 353—367.
- M.V. Volkenshtein; R.R. Dogonadze; A.K. Madumarov; Z.D. Urushadze; Yu. I. Kharkats (1972). „Theory of Enzyme Catalysis”. Molekuliarnaya Biologia: 431—439.
Spoljašnje veze[uredi | uredi izvor]
- (jezik: engleski) Veb-tutorijal za enzimsku inhibiciju, priručnik dr Pitera Berča sa Univerziteta u Pejsliju koji sadrži veoma jasne animacije
- (jezik: engleski) Simbolika i terminologija enzimske kinetike, preporuke Odbora za nomenklaturu Međunarodne unije za biohemiju (NC–IUB) oko terminologije inhibicije enzima
- (jezik: engleski) NCBI-jev PubChem, baza podataka lekova i inhibitora enzima
- (jezik: engleski) BRENDA Архивирано на сајту Wayback Machine (11. децембар 2008), baza podataka enzima sa spiskovima poznatih inhibitora za svaki unos
- (jezik: engleski) Enzimi, kinetika i dijagnostička upotreba Архивирано на сајту Wayback Machine (9. јул 2011), onlajn predavanje dr Majkla V. Kinga iz Medicinske škole Univerziteta u Indijani s fokusom na medicinsku primenu inhibitora enzima
- (jezik: engleski) BindingDB, javna baza podataka izmerenih afiniteta vezivanja proteina i liganda
- (jezik: engleski) Animirana vežba sa inhibicijom enzima, tutorijal + kvizovi


![{\displaystyle V={\frac {V_{max}[S]}{\alpha K_{m}+\alpha ^{\prime }[S]}}={\frac {(1/\alpha ^{\prime })V_{max}[S]}{(\alpha /\alpha ^{\prime })K_{m}+[S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a8f0a9dda1d308de7f090f99c2833f944f11a09)
![{\displaystyle \alpha =1+{\frac {[I]}{K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/57fcf54938a9784f9313437681b220079ff43ee5)
![{\displaystyle \alpha ^{\prime }=1+{\frac {[I]}{K_{i}^{\prime }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8b7d75a61e059ecea4053a1c7afb91f9cf39a2ab)
![{\displaystyle {\cfrac {V_{\max }}{1+{\cfrac {\ce {[I]}}{K_{i}}}}}={\cfrac {V_{\max }}{\cfrac {[{\ce {I}}]+K_{i}}{K_{i}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/974bf2132f8729fe17e42bcf5e6835fd9bf541fc)
![{\displaystyle {\cfrac {V_{\max }}{\cfrac {[{\ce {I}}]+K_{i}}{[{\ce {I}}]+K_{i}-[{\ce {I}}]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea1e5957a1680cbbd38b9a6157e59859632c37ba)
![{\displaystyle {\cfrac {V_{\max }}{\cfrac {1}{1-{\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}}}=V_{\max }-V_{\max }{\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1dd17bc78dc831a088b059c70ea9b734c99f15a5)
![{\displaystyle {\cfrac {\ce {[S]}}{[{\ce {S}}]+K_{m}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb08dd139085a394e6e7370f47ebfa255f1ad685)
![{\displaystyle {\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9ed50a1f7a5f2c52f406b52263916ab48b268e07)
![{\displaystyle V_{\max }-\Delta V_{\max }{\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7dff424ec79284c3a1cea14f0f82b0eaace53c69)
![{\displaystyle V_{\max 1}-(V_{\max 1}-V_{\max 2}){\cfrac {\ce {[I]}}{[{\ce {I}}]+K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f3874623edd9524ba2741fe448927bf5cf0ab257)
![{\displaystyle V_{\max 1}-(V_{\max 1}-V_{\max 2}){\cfrac {\ce {[X]}}{[{\ce {X}}]+K_{x}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/306d44733a89308883053e3b8372a8cf9ce0239b)
![{\displaystyle K_{m1}-(K_{m1}-K_{m2}){\cfrac {\ce {[X]}}{[{\ce {X}}]+K_{x}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb4e0de216e1e625bb803ee725bf85c9989a15f5)








