Antimon tetroksid
 | |
| Nazivi | |
|---|---|
| IUPAC naziv
antimon(III,V) oksid
| |
| Identifikacija | |
| ECHA InfoCard | 100.014.161 |
| Svojstva | |
| SbO2; Sb2O4 | |
| Molarna masa | 153,7588; 307,5176 g/mol |
| Agregatno stanje | beli prah |
| Gustina | 6,64 g/cm3 (ortorombna forma) [3] |
| Tačka topljenja | > 930 °C (1.710 °F; 1.200 K) (razlaže se) |
| Tačka ključanja | razlaže se |
| nerastvoran | |
| Indeks refrakcije (nD) | 2.0 |
| Struktura | |
| Kristalna rešetka/struktura | rombična |
| Opasnosti | |
| NFPA 704 | |
| SAD zdravstvene granice izlaganja (NIOSH): | |
PEL (dozvoljivo)
|
TWA 0.5 mg/m3 (as Sb) |
REL (preporučeno)
|
TWA 0.5 mg/m3 (as Sb)[4] |
| Srodna jedinjenja | |
Srodna jedinjenja
|
Antimon trioksid Antimon pentoksid |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Antimon tetroksid je neorgansko jedinjenje sa formulom Sb2O4. Ovaj materijal, koji se javlja kao mineral cervantit.[5] On je bele boje, ali reverzibilno postaje žut pri zagrevanju. Njegova empirijska formula je SbO2. Ovo jedinjenje sadrži dve vrste Sb centera.
Formiranje i struktura[уреди | уреди извор]
Ovaj materijal se formira zagrevanjem Sb2O3 na vazduhu:[6]
- Sb2O3 + 0.5 O2 → Sb2O4 ΔH = −187 kJ/mol
Na 800 °C, antimon(V) oksid gubi kiseonik i formira se antimon tetroksid:
- Sb2O5 → Sb2O4 + 0.5 O2 ΔH = −64 kJ/mol
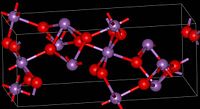
Ovaj material ima mešovitu valencu. On se sastoji od Sb(V) i Sb(III) centera. Dva polimorfa su poznata, jedan je ortoromban (prikazan u infokutiji), a drugi je monokliničan.[3] Obe forme sadrže oktaedralne Sb(V) centre uređene u ploče sa Sb(III) centrima vezanim za četiri kiseonika.
References[уреди | уреди извор]
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б Amador, J.; Puebla, E. Gutierrez; Monge, M. A.; Rasines, I.; Valero, C. Ruiz (1988). „Diantimony Tetraoxides Revisited”. Inorganic Chemistry. 27: 1367—1370. doi:10.1021/ic00281a011.
- ^ NIOSH Džepni vodič hemijskih hazarda 0036
- ^ „Cervantite”. Webminerals. Приступљено 06. 06. 2009.
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 978-0-12-352651-9.

