Jednačina stanja idealnog gasa — разлика између измена
мНема описа измене ознаке: мобилна измена мобилно веб-уређивање напредна мобилна измена |
мНема описа измене ознаке: мобилна измена мобилно веб-уређивање напредна мобилна измена |
||
| Ред 1: | Ред 1: | ||
{{Termodinamika-lat}} |
{{Termodinamika-lat}} |
||
'''Jednačina stanja idealnog gasa''' je jednačina stanja teoretskog [[Idealni gas|idealnog gasa]]. Ona uz nekoliko ograničenja relativno dobro opisuje ponašanja mnogih realnih gasova, pod različitim uslovima. Ovaj zakon je prvi objavio [[Emil Klaperon]] [[1834]]. godine, kombinujući [[Bojl-Mariotov zakon]] i [[Čarlsov zakon]]. Ona se isto tako može izvesti iz [[Kinetička teorija gasova|kinetičke teorije gasova]], koju su razvili [[1856]]. Avgust Kronig i [[1857]]. Rudolf Klauzijus.<ref>Clapeyron E.: "Mémoire sur la puissance motrice de la chaleur", journal = Journal de l'École Polytechnique, 1834, [http://gallica.bnf.fr/ark:/12148/bpt6k4336791/f157.table Facsimile at the Bibliothèque nationale de France]}-</ref><ref>Krönig A.: "Grundzüge einer Theorie der Gase", journal = Annalen der Physik, 1856, [http://gallica.bnf.fr/ark:/12148/bpt6k15184h/f327.table] Facsimile at the Bibliothèque nationale de France</ref><ref>-{Clausius R.: "Ueber die Art der Bewegung, welche wir Wärme nennen", journal = Annalen der Physik und Chemie, 1857, [http://gallica.bnf.fr/ark:/12148/bpt6k15185v/f371.table] Facsimile at the Bibliothèque nationale de France</ref> |
'''Jednačina stanja idealnog gasa''' je jednačina stanja teoretskog [[Idealni gas|idealnog gasa]]. Ona uz nekoliko ograničenja relativno dobro opisuje ponašanja mnogih realnih gasova, pod različitim uslovima. Ovaj zakon je prvi objavio [[Emil Klaperon]] [[1834]]. godine, kombinujući [[Bojl-Mariotov zakon]] i [[Čarlsov zakon]]. Ona se isto tako može izvesti iz [[Kinetička teorija gasova|kinetičke teorije gasova]], koju su razvili [[1856]]. Avgust Kronig i [[1857]]. [[Rudolf Klauzijus]].<ref>Clapeyron E.: "Mémoire sur la puissance motrice de la chaleur", journal = Journal de l'École Polytechnique, 1834, [http://gallica.bnf.fr/ark:/12148/bpt6k4336791/f157.table Facsimile at the Bibliothèque nationale de France]}-</ref><ref>Krönig A.: "Grundzüge einer Theorie der Gase", journal = Annalen der Physik, 1856, [http://gallica.bnf.fr/ark:/12148/bpt6k15184h/f327.table] Facsimile at the Bibliothèque nationale de France</ref><ref>-{Clausius R.: "Ueber die Art der Bewegung, welche wir Wärme nennen", journal = Annalen der Physik und Chemie, 1857, [http://gallica.bnf.fr/ark:/12148/bpt6k15185v/f371.table] Facsimile at the Bibliothèque nationale de France</ref> |
||
[[Датотека:Ideal gas isotherms.png|мини|десно|250px|Krive prikazuju odnos između pritiska (vertikalna osa) i zapremine (horizontalna osa) za idealni gas na različitim temperaturama]] |
[[Датотека:Ideal gas isotherms.png|мини|десно|250px|Krive prikazuju odnos između pritiska (vertikalna osa) i zapremine (horizontalna osa) za idealni gas na različitim temperaturama]] |
||
Верзија на датум 9. август 2020. у 11:05
| Termodinamika |
|---|
 |
Jednačina stanja idealnog gasa je jednačina stanja teoretskog idealnog gasa. Ona uz nekoliko ograničenja relativno dobro opisuje ponašanja mnogih realnih gasova, pod različitim uslovima. Ovaj zakon je prvi objavio Emil Klaperon 1834. godine, kombinujući Bojl-Mariotov zakon i Čarlsov zakon. Ona se isto tako može izvesti iz kinetičke teorije gasova, koju su razvili 1856. Avgust Kronig i 1857. Rudolf Klauzijus.[1][2][3]
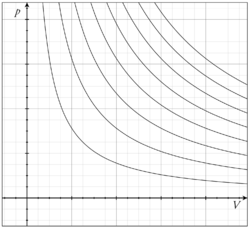
Stanje neke količine gasa se može odrediti sa pritiskom, zapreminom i temperaturom. Noviji oblik tog zakona je:
gde je: p – apsolutni pritisak gasa (Pa), V – zapremina gasa (m3), N – broj čestica u gasu, k – Bolcmanova konstanta (1,38•10−23 J•K−1) i T - apsolutna temperatura (K). Ponekad se može pisati kao:
gde je: n – broj molova gasa, R – univerzalna gasna konstanta (8,314472 J•mol−1• K−1), jednaka umnošku Bolcmanove konstante i Avogadrovog broja.
Odstupanje od realnih gasova
Jednačina stanja važi za idealne gasove, i u znatnoj meri za realne gasove. Budući da ona zanemaruje veličinu molekula i međumolekularna dejstva, jednačina stanja idealnog gasa je najtačnija za jednoatomske gasove, za visoke temperatura i male gustina gasova. Važnost međumolekularnog delovanja se smanjuje sa povećanjem toplotne kinetičke energije gasova, tj. sa povećanjem temperature. Detaljnija jednadžba stanja, kao što je van der Valsova jednačina, uzima u obzir veličinu molekula i međumolekulske sile.
Izmenjeni oblici jednačine
Molarni oblik
Broj molova (n) je jednak masi (m) gasa podeljenoj sa molarnom masom (M):
Ako zamenimo n, i ako uzmemo za gustinu ρ = m/V, dobijamo:
Ako odredimo specifičnu gasnu konstantu Rspecif. kao odnos R/M, dobijamo:
Ovaj oblik je koristan jer povezuje pritisak, gustinu i temperaturu. Osim toga, jednačina se može pisati uzimajući u obzir specifičnu zapreminu v, koja je obrnuto proporcionalna gustini:
Reference
- ^ Clapeyron E.: "Mémoire sur la puissance motrice de la chaleur", journal = Journal de l'École Polytechnique, 1834, Facsimile at the Bibliothèque nationale de France}-
- ^ Krönig A.: "Grundzüge einer Theorie der Gase", journal = Annalen der Physik, 1856, [1] Facsimile at the Bibliothèque nationale de France
- ^ -{Clausius R.: "Ueber die Art der Bewegung, welche wir Wärme nennen", journal = Annalen der Physik und Chemie, 1857, [2] Facsimile at the Bibliothèque nationale de France
Literatura
- Davis and Masten Principles of Environmental Engineering and Science, McGraw-Hill Companies, Inc. . New York. 2002. ISBN 978-0-07-235053-1.
- Website giving credit to Benoît Paul Émile Clapeyron, (1799–1864) in 1834






















