Синдром исцрпљивања митохондријске ДНК
| Синдром исцрпљивања митохондријске ДНК | |
|---|---|
| Синоними | mtDNA depletion syndrome |
 | |
| Синдром исцрпљивања митохондријалне ДНК наслеђује се на аутозомно рецесиван начин | |
| Специјалности | генетика, неурологија |
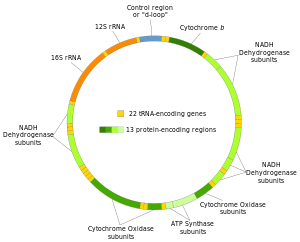
Синдроми исцрпљивања митохондријске ДНК (мтДНК) (акроним МДДС) су група клинички хетерогених аутозомно рецесивних поремећаја које карактерише озбиљно квантитативно смањење укупне мтДНК, генетског материјала присутног искључиво унутар митохондрија. Митохондријски геном (мтДНК) је кружни геном од 16,5 кб, који кодира 13 подјединица респираторног ланца и 24 РНК молекула неопходна за интрамитохондријску транслацију ових 13 протеина. За разлику од нуклеарне ДНК, где свака ћелија садржи две копије сваког гена (по једну копију од сваког родитеља), Митохондријски геном је геном са више копија, а свака ћелија садржи хиљаде копија. Смањење мтДНК је дефинисано као резидуални број копија мтДНК од <30% у поређењу са контролама које одговарају узрасту, али нивои мтДНК су често <10%, а понекад и само 1-2% контрола, посебно у хепатоцеребралном облику болести.
Клиничка слике синдрома исцрпљивања митохондријске ДНК укључују рану хепатоцеребралну болест која се преклапа са Алперсовим синдромом, изоловану миопатију, енцефаломиопатију исиндром митохондријалне неурогастроинтестинална енцефаломиопатије (МНГИЕ).
Синдром исцрпљивања митохондријске ДНК може бити узрокован рецесивним дефектима у протеинима укљученим у репликацију мтДНК (прављење копија мтДНК) или у протеинима који синтетишу деоксирибонуклеозид трифосфате (дНТП) за уградњу у мтДНК. Оба типа дефекта ће вероватно изазвати застој комплекса репликације,3 механизам који је такође важан у генерисању вишеструких делеција мтДНК, још један недостатак у одржавању мтДНК.
Алперсов синдром и сродни хепатоцеребрални поремећаји представљају најчешћу подгрупу синдрома исцрпљивања митохондријске ДНК, узроковану мутацијама у ПОЛГ гену који кодира каталитичку подјединицу митохондријалне ДНК полимеразе γ, ензима одговорног за репликацију мтДНК.
Алперсов синдром се карактерише тешком епилепсијом и дисфункцијом јетре, али било који проблем се може појавити изоловано. Код пацијената са ПОЛГ мутацијама и Алперсовим синдромом, степен деплеције мтДНК ткива има одређену корелацију са клиничком тежином.
Клиничка слика[уреди | уреди извор]
Сви облици синдрома исцрпљивања митохондријске ДНК су веома ретки. Док синдром исцрпљивања митохондријске ДНК изазива широк спектар симптома, који се могу појавити код новорођенчади, одојчади, деце или одраслих, у зависности од класе синдрома исцрпљивања митохондријске ДНК. Такође унутар сваке класе симптоми су такође различити.[1]
Код синдрома исцрпљивања митохондријске ДНК повезаних са мутацијама у ТК2, новорођенчад се генерално развија нормално, али око две године старости почињу да се појављују симптоми опште слабости мишића (назване „хипотонија“), умора, недостатка издржљивости и потешкоћа у храњењу. Нека деца почињу да губе контролу над мишићима на лицу, устима и грлу и могу имати потешкоћа са гутањем. Моторичке вештине које су биле научене могу бити изгубљене, али генерално не утиче на функционисање мозга и способност размишљања.[1]
Код синдрома исцрпљивања митохондријске ДНК повезаних са мутацијама у СУЦЛА2 или СУЦЛГ1 које првенствено утичу на мозак и мишиће, хипотонија се генерално јавља код новорођенчади пре 6 месеци старости, њихови мишићи почињу да се троше и постоји кашњење у психомоторичком учењу (учење основних вештина као што су ходање, причање , и намерно, координисано кретање). Кичма често почиње да се криви (сколиоза или кифоза), а дете често има абнормалне покрете (дистонија, атетоза или кореја), отежано храњење, рефлукс киселине, губитак слуха, заостајање у расту и отежано дисање што може довести до честих инфекција плућа. Понекад се развије епилепсија.[1]
У синдрому исцрпљивања митохондријске ДНК повезаним са мутацијама у РРМ2Б које првенствено утичу на мозак и мишиће, поново постоји хипотонија у првим месецима, симптоми лактацидозе као што су мучнина, повраћање и брзо дубоко дисање, неуспех у развоју, укључујући останак мале главе, кашњење или назадовање код кретања и губитка слуха. Многи системи тела су погођени.[1][2] Случај Чарлија Гарда је био повезан са овим подобликом болести.[3]
У синдрому исцрпљивања митохондријске ДНК повезаним са мутацијама у ДГУОК-у које првенствено утичу на мозак и јетру, постоје два облика. Постоји рани облик у коме симптоми настају због проблема са многим органима у првој недељи живота, посебно симптоми лактацидозе као и низак ниво шећера у крви. У року од неколико недеља од рођења могу развити отказивање јетре и повезану жутицу и отицање абдомена, као и многе неуролошке проблеме, укључујући застој у развоју и регресију, и неконтролисано кретање очију. Ретко у овој класи већ ретких болести, симптоми који се односе на болест јетре појављују се касније у детињству или у детињству.[1]
Код синдрома исцрпљивања митохондријске ДНК повезаних са мутацијама у МПВ17 које првенствено утичу на мозак и јетру, симптоми су слични онима узрокованим ДГУОК-ом и такође се појављују убрзо након рођења, углавном са мање и мање озбиљних неуролошких проблема. Постоји подскуп људи Навахо порекла који развијају Навахо неурохепатопатију, који поред ових симптома такође имају лако ломљене кости које не изазивају бол, деформисане руке или стопала и проблеме са рожњачом.[1]
Код синдрома исцрпљивања митохондријске ДНК повезаних са мутацијама у ПОЛГ-у које првенствено утичу на мозак и јетру,[4] симптоми су веома разноврсни и могу се појавити у било ком тренутку од рођења до старости. Први знаци болести, који укључују тешко излечиве нападе и неиспуњавање значајних развојних прекретница, обично се јављају у детињству, након прве године живота, али понекад и до пете године. Примарни симптоми болести су заостајање у развоју, прогресивна интелектуална ометеност, хипотонија (низак тонус мишића), спастичност (укоченост удова) која може довести до квадриплегије и прогресивне деменције. Напади могу укључивати епилепсију партиалис цонтинуа, врсту напада која се састоји од поновљених миоклоничних (мишићних) трзаја. Може се јавити и оптичка атрофија, која често доводи до слепила. Може доћи и до губитка слуха. Поред тога, иако физички знаци хроничне дисфункције јетре можда нису присутни, многи људи пате од оштећења јетре што доводи до отказивања јетре.[5][6]
У синдрому исцрпљивања митохондријске ДНК повезаним са мутацијама у ПЕО1/Ц10орф2 које првенствено утичу на мозак и јетру, симптоми се јављају убрзо након рођења или у раном детињству, са хипотонијом, симптомима лактацидозе, увећаном јетром, проблемима храњења, недостатком раста и кашњењем психомоторике. вештине. Неуролошки, развој је успорен или заустављен и појављује се епилепсија, као и сензорни проблеми попут губитка контроле ока и глувоће, и неуромишићних проблема као што су недостатак рефлекса, мишићна атрофија и трзаји, и епилепсија.[1]
Код синдрома исцрпљивања митохондријске ДНК повезаних са мутацијама у генима повезаним са мутацијама у ЕЦГФ1/ТИМП-у које првенствено утичу на мозак и гастроинтестинални тракт, симптоми се могу појавити било када у првих педесет година живота; најчешће се јављају пре него што особа напуни 20 година. Губитак тежине је уобичајен као и недостатак способности желуца и црева да се аутоматски шире и скупљају и на тај начин се крећу кроз њих ( гастроинтестинални мотилитет) – то доводи до осећаја ситости само након јела. мале количине хране, мучнина, рефлукс киселине. Све погођене особе развијају губитак тежине и прогресивну гастроинтестиналну дисмотилитет која се манифестује као рана ситост, мучнина, дијареја, повраћање, бол и оток у стомаку. Људи такође развијају неуропатију, са слабошћу и пецкањем. Често постоје проблеми са очима и интелектуални инвалидитет.[1]
Дијагноза[уреди | уреди извор]
Синдрома исцрпљивања митохондријске ДНК се дијагностикује на основу системских симптома који се јављају код новорођенчади, након чега следи клинички преглед и лабораторијски тестови (на пример, високи нивои лактата су уобичајени) медицински имиџинг, и обично се коначно потврђује и формално идентификује генетским тестирањем.[1]
Класификација[уреди | уреди извор]
Синдром исцрпљивања митохондријске ДНК је група генетских поремећаја који деле заједничку патологију — недостатак функционалне ДНК у митохондријама.[1] Генерално постоје четири облика синдрома исцрпљивања митохондријске ДНК:[1]
- облик који првенствено утиче на мишиће повезане са мутацијама у ТК2 гену,
- облик који првенствено утиче на мозак и мишиће повезане са мутацијама у генима СУЦЛА2, СУЦЛГ1 или РРМ2Б,
- облик који првенствено утиче на мозак и јетру повезан са мутацијама у ДГУОК, МПВ17,[7] ПОЛГ или ТВНК протеину (који се такође назива ПЕО1),
- облик који првенствено утиче на мозак и гастроинтестинални тракт повезан са мутацијама у ЕЦГФ1 (који се такође назива ТИМП).
Терапија[уреди | уреди извор]
Не постоји одговарајућа терапија за синдрома исцрпљивања митохондријске ДНК, али се неким симптомима може управљати.
За преживеле који живе са синдрома исцрпљивања митохондријске ДНК, постоје лекови за контролу епилепсије, а физикална терапија може помоћи у контроли мишића.
Трансплантација јетре може користити људима са захваћеном јетром.[1]
Прогноза[уреди | уреди извор]
Миопатски облик[уреди | уреди извор]
Миопатски облик повезан са ТК2 доводи до слабости мишића, брзо напредује, што доводи до респираторне инсуфицијенције и смрти у року од неколико година од почетка. Најчешћи узрок смрти је плућна инфекција. Само неколико људи је преживело касно детињство и адолесценцију.[1]
Енцефаломиопатски облик[уреди | уреди извор]
Облици повезани са СУЦЛА2 и РРМ2Б доводе до деформитета мозга.[8] Студија из 2007. заснована на 12 случајева са Фарских острва (где постоји релативно висока инциденција због ефекта оснивача) сугерише да је исход често лош са раном смртношћу.[5] Новије студије (2015) са 50 људи са СУЦЛА2 мутацијама, са распоном од 16 различитих мутација, показују велику варијабилност у исходима са одређеним бројем људи који су преживели у одраслом добу (средња вредност преживљавања била је 20 година. Постоје значајни докази (п = 0,020) да људи са миссен мутацијама имају дуже стопе преживљавања, што би могло значити да неки од добијених протеина имају неку резидуалну активност ензима.[8]
РРМ2Б мутације су пријављене код 16 новорођенчади са тешким енцефаломиопатским МДС-ом који је повезан са раним почетком (неонаталном или инфантилном), мултиорганском презентацијом и морталитетом током детињства. [1]
Хепатопатски облик[уреди | уреди извор]
Облици повезани са ДГУОК, ПОЛГ и МПВ17 доводе до оштећења јетре.[1] Дисфункција јетре је прогресивна код већине особа са оба облика МДС-а повезаног са ДГУОК-ом и најчешћи је узрок смрти. За децу са мултиорганским обликом, трансплантација јетре не пружа никакву корист за преживљавање.[9]
Болест јетре обично напредује до отказивања јетре код погођене деце са МДС-ом повезаним са МПВ17, а трансплантација јетре остаје једина опција лечења за отказивање јетре. Приближно половина оболеле деце која је пријављена није била подвргнута трансплантацији јетре и умрла је због прогресивне инсуфицијенције јетре – већина током детињства или раног детињства. Само је је неколико деце преживело без трансплантације јетре.[10]
Извори[уреди | уреди извор]
- ^ а б в г д ђ е ж з и ј к л љ м El-Hattab AW, Scaglia F (April 2013). "Mitochondrial DNA depletion syndromes: review and updates of genetic basis, manifestations, and therapeutic options". Neurotherapeutics. 10 (2): 186–98. El-Hattab, Ayman W.; Scaglia, Fernando (2013). „Mitochondrial DNA Depletion Syndromes: Review and Updates of Genetic Basis, Manifestations, and Therapeutic Options”. Neurotherapeutics. 10 (2): 186—198. PMC 3625391
 . PMID 23385875. doi:10.1007/s13311-013-0177-6..
. PMID 23385875. doi:10.1007/s13311-013-0177-6..
- ^ Adam, M. P.; Mirzaa, G. M.; Pagon, R. A.; Wallace, S. E.; Bean LJH; Gripp, K. W.; Amemiya, A.; Lim, A. Z.; McFarland, R.; Taylor, R. W.; Gorman, G. S. (1993). „RRM2B Mitochondrial DNA Maintenance Defects”. PMID 24741716.
- ^ Wheaton, Oliver (2017-07-25). „What is Charlie Gard's condition mitochondrial DNA depletion syndrome (or MDDS)?”. Metro (на језику: енглески). Приступљено 2022-03-09.
- ^ This form of MDDS is also called "Alpers' disease", also called "Alpers' syndrome", "Alpers-Huttenlocher syndrome", "progressive sclerosing poliodystrophy", and "progressive infantile poliodystrophy". It is named after Bernard Jacob Alpers (Alpers' disease at Who Named It?) and Peter Huttenlocher (see
- ^ а б „Alpers' Disease Information Page | National Institute of Neurological Disorders and Stroke”. www.ninds.nih.gov. Приступљено 2022-03-09.
- ^ Adam, M. P.; Mirzaa, G. M.; Pagon, R. A.; Wallace, S. E.; Bean LJH; Gripp, K. W.; Amemiya, A.; Cohen, B. H.; Chinnery, P. F.; Copeland, W. C. (1993). „POLG-Related Disorders”. GeneReviews. PMID 20301791.
- ^ Karasawa, M.; Zwacka, R. M.; Reuter, A.; Fink, T.; Hsieh, C. L.; Lichter, P.; Francke, U.; Welher, H. (1993). „The human homolog of the glomerulosclerosis gene Mpv17: Structure and genomic organization”. Human Molecular Genetics. 2 (11): 1829—1834. PMID 8281143. doi:10.1093/hmg/2.11.1829..
- ^ а б Carrozzo R, Verrigni D, Rasmussen M, de Coo R, Amartino H, Bianchi M, et al. (March 2016). "Succinate-CoA ligase deficiency due to mutations in SUCLA2 and SUCLG1: phenotype and genotype correlations in 71 patients". Journal of Inherited Metabolic Disease. 39 (2): 243–52. Carrozzo, Rosalba; et al. (2016). „Succinate‐CoA ligase deficiency due to mutations in SUCLA2 and SUCLG1: Phenotype and genotype correlations in 71 patients”. Journal of Inherited Metabolic Disease. 39 (2): 243—252. PMID 26475597. S2CID 7881205. doi:10.1007/s10545-015-9894-9.
- ^ Dimmock, David P.; Dunn, J. Kay; Feigenbaum, Annette; Rupar, Anthony; Horvath, Rita; Freisinger, Peter; Mousson De Camaret, Bénédicte; Wong, Lee-Jun; Scaglia, Fernando (2008). „Abnormal neurological features predict poor survival and should preclude liver transplantation in patients with deoxyguanosine kinase deficiency”. Liver Transplantation. 14 (10): 1480—1485. PMID 18825706. S2CID 28819842. doi:10.1002/lt.21556.
- ^ El-Hattab AW, Li FY, Schmitt E, Zhang S, Craigen WJ, Wong LJ (March 2010). "MPV17-associated hepatocerebral mitochondrial DNA depletion syndrome: new patients and novel mutations". Molecular Genetics and Metabolism. 99 (3): 300–8.
Спољашње везе[уреди | уреди извор]
| Класификација | |
|---|---|
| Спољашњи ресурси |
 | Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |
