Алтернативни периодни системи

| Део серије чланака о |
| периодном систему |
|---|
Алтернативни периодни системи су табеларни прикази хемијских елемената који се у значајној мери разликују од њихове организације односно традиционалног распореда у периодном систему.[1][2] Много оваквих система је до сада измишљено, често из дидактичких разлога, зато што све корелације између хемијских елемената не могу да се ефективно представе стандардним периодним системом.
Алтернативни периодни системи се развијају најчешће да би се нагласила или истакла различита хемијска и физичка својства елемената која нису тако очигледна у традиционалним периодним системима. Неки системи имају за циљ истаћи и нуклеонску и електронску структуру атома. Ово се може постићи мењањем просторног односа или распореда који сваки елемент има у односу на други елемент у систему. Други системи стављају нагласак на изоловање хемијских елемената током историје од стране људи.
Главне алтернативне структуре[уреди | уреди извор]
Левостепенасти периодни систем (Жане, 1928)[уреди | уреди извор]
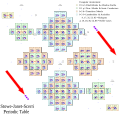
Жанеов „Левостепенасти периодни систем” из 1928. (енгл. Charles Janet's 1928 "Left-step periodic table")[3] сматра се најзначајнијом алтернативом традиционалној верзији периодног система. У њему су елемети распоређени према редоследу попуњавања орбитала односно љуски (уместо према валентности); овај систем доста користе физичари.[4]
| f1 | f2 | f3 | f4 | f5 | f6 | f7 | f8 | f9 | f10 | f11 | f12 | f13 | f14 | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | p1 | p2 | p3 | p4 | p5 | p6 | s1 | s2 | |
| 1s | H | He | ||||||||||||||||||||||||||||||
| 2s | Li | Be | ||||||||||||||||||||||||||||||
| 2p 3s | B | C | N | O | F | Ne | Na | Mg | ||||||||||||||||||||||||
| 3p 4s | Al | Si | P | S | Cl | Ar | K | Ca | ||||||||||||||||||||||||
| 3d 4p 5s | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | Rb | Sr | ||||||||||||||
| 4d 5p 6s | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | Cs | Ba | ||||||||||||||
| 4f 5d 6p 7s | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | Fr | Ra |
| 5f 6d 7p 8s | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | 119 | 120 |
| f-блок | d-блок | p-блок | s-блок | |||||||||||||||||||||||||||||
У стварности, попуњавање електронских љуски карактерише низ неправилности.

Ако се упореди са обичним форматом, Левостепенасти периодни систем има следеће промене:
- хелијум је смештен у 2. групу
- 1. и 2. група (s-блок), укључујући елемент 119 и 120 у продужењу у виду 8. периоде, премештени су на десну страну система
- s-блок је померен према горе за један ред и сви елементи који нису у s-блоку су сада један ред ниже него у стандардном периодном систему; на пример, већина четвртог реда у стандардном систему је пети ред у овом систему
Периодни систем ADOMAH (Цимерман, 2006)[уреди | уреди извор]

Модерну верзију периодног система је 2006. године направио Валери Цимерман, а назвао ју је ADOMAH (енгл. Valery Tsimmerman's 2006 "ADOMAH periodic table").[5] Структура овог периодног система заснована је на четири квантна броја електронске конфигурације, зато што систем има четвородимензионалну базу.[6]
Дводимензионални спирални периодни систем (Бенфи, 1964)[уреди | уреди извор]
Теодор Бенфи је 1964. године осмислио „Дводимензионални спирални периодни систем” (енгл. Theodor Benfey's 1964 "Two-dimensional spiral periodic table"); систем почиње од водоника, а спирала се одвија око двају ’полуострва’ — прелазних метала те лантаноида и актиноида. ’Острво’ суперактиноида већ је ’усечено’.[7] Хемијска галаксија (2004) организована је на сличан начин.
Тродимензионални периодни систем физичара (Стоу, 1989)[уреди | уреди извор]
Тимоти Стоу је 1989. године направио „Тродимензионални периодни систем физичара” (енгл. Timothy Stowe's 1989 "Three-dimensional physicist's periodic table"); има три осе које представљају главни квантни број, орбитални квантни број и орбитални магнетски квантни број. Хелијум је поново елемент 2. групе.
Тродимензионални периодни систем налик цвету (Жигер, 1966)[уреди | уреди извор]
Жигеров „Тродимензионални периодни систем налик цвету” из 1966. (енгл. Paul-Antoine Giguère's 1966 "Three-dimensional flower-like periodic table") састоји се од 4 повезане плоче са именима елемената исписаним спреда и отпозади. Прва плоча садржи елементе 1. групе са предње стране и елементе 2. групе са задње стране, док су водоник и хелијум изостављени. Постављена под углом од 90°, друга плоча садржи групе 13—18, спреда и отпозади. Још две плоче, свака под углом од 90°, садрже остале елементе.[8][9]
Периодни систем са елементима који се понављају (Рич, 2005)[уреди | уреди извор]
Роналд Л. Рич је 2005. године преложио увођење „Периодног система са елементима који се понављају” (енгл. Ronald L. Rich's 2005 "Elements-repeating periodic table") када је то потребно.[10] Он истиче да водоник дели својства са елементима 1. групе на основу валентности, са елементима 17. групе пошто је неметал, али такође и са елементима 14. групе (тзв. угљеникова група) на основу сличности у хемијском везивању са прелазним металима и сличном електронегативношћу. У овој форми периодног система, угљеник и силицијум се такође појављују у истој групи као и титанијум и цирконијум.
Остале верзије[уреди | уреди извор]
Њуландсов „Ревидирани периодни систем хемичара” из 2010. (енгл. John Newlands' 2010 "Revisited chemist's periodic table") има алтернативну позицију за водоник, хелијум и лантаноиде; објавили су га Е. Г. Маркс и Џ. Е. Маркс.[11]
Други примери тродимензионалних периодних система укључују Куртинову „Периодну класификацију” (енгл. Courtines' "Periodic Classification") из 1925. године,[12] Ринглијев „Ламина систем” (енгл. Wringley's "Lamina System") из 1949. године,[13] Жигеров „Периодни хеликс” (енгл. Giguère's "Periodic helix") из 1965. године[14] и Дуфорово „Периодно стабло” (енгл. Dufour's "Periodic Tree") из 1996. године.[15]
Варијанте класичног формата[уреди | уреди извор]
Још од објављивања Мендељејевљевог оригиналног периодног система, елементи су се у основи распоређивали према валентности (групе у колонама) и њеној периодичности (периоде у редовима). Како су године пролазиле и како су се постизала нова открића у пољу атомске структуре, ови шематски распореди су се прилагођавали и проширивали али као принцип се никада нису изменили.

Најстарији периодни систем је Мендељејевљев систем кратког формата (енгл. short-form table) са колонама I—VIII, који показује секундарне хемијске сличности. На пример, алкални метали и ковни метали (бакар, сребро, злато) налазе се у истој колони зато што обе групе теже једновалентности. Овај формат се још увек често користи, а пример је савремени руски систем кратког формата Архивирано на сајту Wayback Machine (17. децембар 2013) (рус. Периодическая таблица элементов Д. И. Менделеева) који укључује све до сада откривене елементе.
Х. Г. Деминг је у свом уџбенику Општа хемија (енгл. General Chemistry) користио такозвани дуги периодни систем (енгл. long periodic table) са 18 колона, који се у САД први пут појавио 1923. године (Вајли); био је ово први систем у ком су — ознаком A — биле означене прве две и последњих пет „главних група” (енгл. main groups), те између њих — ознаком B — остатак у виду „прелазних група” (енгл. transition groups).
Додатно нумерисање је одабрано тако да карактеристични оксиди B група одговарају онима из A група. Гвожђева, кобалтова и никлова група нису биле означене ни са A ни са B. Група племенитих гасова је оригинално била ’прикачена’ (од стране Деминга) на леву страну периодног система. Група је касније прешла на десну страну и обично се означавала са VIIIA.
Проширивање периодног система[уреди | уреди извор]
У проширеном периодном систему који је 1969. године предложио Глен Т. Сиборг, укључени су и до сада неоткривени елементи — све до атомског броја 218. Додате су и теоријске периоде после регуларне, тренутно последње 7. периоде.
У пољу истраживања суператома, кластери атома имају својства појединачних атома другог елемента. Предложено је да се прошири периодни систем додавањем другог слоја у ком ће бити смештена кластерска једињења. Последње проширење овог ’вишеспратног’ система био је кластерски јон алуминијума Al−7, који се понаша као мултивалентни атом германијума.[16]
Галерија[уреди | уреди извор]
-
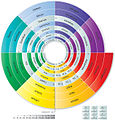
Спирални периодни систем (Харисон)
-
Прстен периодних елемената (TROPE)
-
Систем увијена трака (Џ. Ф. Хајд)
-
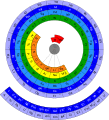
Кружни периодни систем елемената
-
Алтернативни кружни периодни систем
-
Спирални периодни систем (Шолтен)
-
Мендељејевљев цвет (Цветни систем)
-
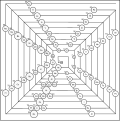
Систем са бинарним електронским љускама
-
Стоуов периодни систем елемената
-
Периодни систем Змачинскија и Бејлија
-
Периодни систем ADOMAH (Цимерман)
-
Њуландсов ревидирани периодни систем
-
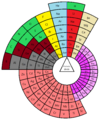
Пирамидални периодни систем елемената
-
3D електрон. орбитале (Стоу—Жане—Скери)
-
4D периодни систем (Стоу—Жане—Скери)
Референце[уреди | уреди извор]
- ^ Scerri, E. R. (2006). The Periodic Table, Its Story and Its Significance. New York: Oxford University Press. ISBN 9780195345674.
- ^ Bent, Henry (2006). New Ideas in Chemistry from Fresh Energy for the Periodic Law. AuthorHouse. ISBN 978-1-4259-4862-7.
- ^ „Left Step Periodic Table”. 1928. Приступљено 25. 5. 2016.
- ^ Stewart, Philip J. (2009). „Charles Janet: Unrecognized genius of the periodic system”. Foundations of Chemistry. 12: 5. doi:10.1007/s10698-008-9062-5.
- ^ Tsimmerman, Valery (2006). „ADOMAH Periodic Table”. Архивирано из оригинала 19. 3. 2016. г. Приступљено 25. 5. 2016.
- ^ Tsimmerman, Valery (2008). „Periodic Law can be understood in terms of the Tetrahedral Sphere Packing”. Архивирано из оригинала 18. 5. 2016. г. Приступљено 25. 5. 2016. „creation of the first man, Adam, from the dust of the earth, in Hebrew, Adomah”
- ^ Бенфијев систем се може видети у чланку Глена Сиборга:
- „Plutonium: The Ornery Element” (јун 1964). Chemistry. 37 (6): 12—17 [14].
- ^ Mazurs, E. G. (1974). Graphical Representations of the Periodic System During One Hundred Years. Alabama: University of Alabama Press. стр. 111. ISBN 978-0-8173-3200-6.
- ^ Анимирана верзија Жигеровог периодног система која је највише заступљена на интернету (укључујући и ону одавде) није тачна, зато што јој недостају водоник и хелијум. Жигер је касније додао водоник изнад литијума и хелијум изнад берилијума. Погледајте:
- Giguère, P. A. (1966). „The 'new look' for the periodic system”. Chemistry in Canada. изд. 18 (12): 36—39 [37].
- ^ Rich, Ronald L. (2005). „Are Some Elements More Equal Than Others”. J. Chem. Educ. 82 (12): 1761. doi:10.1021/ed082p1761.
- ^ Marks, E. G.; Marks, J. A. (2010). „Newlands revisited: A display of the periodicity of the chemical elements for chemists”. Foundations of Chemistry. 12: 85. doi:10.1007/s10698-010-9083-8.
- ^ Leach, Mark R. „1925 Courtines' Periodic Classification”. Архивирано из оригинала 16. 05. 2016. г. Приступљено 19. 4. 2016.
- ^ Leach, Mark R. „1949 Wringley's Lamina System”. Архивирано из оригинала 03. 12. 2011. г. Приступљено 19. 4. 2016.
- ^ Mazurs, E. G. (1974). Graphical Representations of the Periodic System During One Hundred Years. Alabama: University of Alabama Press. стр. 111. ISBN 978-0-8173-3200-6.
- ^ Leach, Mark R. „1996 Dufour's Periodic Tree”. Архивирано из оригинала 18. 04. 2010. г. Приступљено 19. 4. 2016.
- ^ Amato, Ivan (21. 11. 2006). „Beyond The Periodic Table Metal clusters mimic chemical properties of atoms”. Chemical & Engineering News. Архивирано из оригинала 20. 7. 2012. г. Приступљено 26. 5. 2016.
Литература[уреди | уреди извор]
- Mazurs, E. G. (1974). Graphical Representations of the Periodic System During One Hundred Years. Alabama: University of Alabama Press. стр. 111. ISBN 978-0-8173-3200-6.
- Mazurs, E. G. (1974). Graphical Representations of the Periodic System During One Hundred Years. Alabama: University of Alabama Press. стр. 111. ISBN 978-0-8173-3200-6.
- Hjørland, Birger (2011). The periodic table and the philosophy of classification. Knowledge Organization. 38 (1): 9—21.
- Mazurs, E. G (1974). Graphical Representations of the Periodic System During One Hundred Years. Alabama: University of Alabama Press. ISBN 978-0-8173-3200-6..
- (Мазурсова ревизија из 1974. године свих до тада познатих периодних система се сматра дефинитивним радом на ову тему.)
Додатна литература[уреди | уреди извор]
- Fraundorf, P. (2006). „Elements, topology, and T-shirts”. Bibcode:2006physics...3026F. arXiv:physics/0603026
 .
.
Спољашње везе[уреди | уреди извор]
- Представљање периодног система на различите начине [Knowledge Network Alumni MSU]
- Модерни спирални периодни систем Роберта Харисона [Spiral Periodic Table]
- Жанеов Левостепенасти периодни систем [Meta-Synthesis]
- Корекције за Периодни систем физичара које је понудио Џерис Ријани [Jeries.Rihani]
- Чланак о алтернативним периодним системима [Wired]
- Избор из периодних система [Meta-Synthesis]
- Периодни систем са (хексагоналним) спиралним обликом [Periodic Spiral]
- Нови периодни систем [Rota Period] Архивирано на сајту Wayback Machine (27. фебруар 2021)
- Нови периодни систем елемената са четвртасто-троугаоним распоредом [EgregorAlfa]
- Периодни систем ADOMAH заснован на електронским конфигурацијама [Perfect Periodic Table]
- База података периодних система [Meta-Synthesis]
- Периодни фрактал елемената [Superliminal]
- Периодни систем елемената Боба Дојла [WizWorld]
- Периодни систем географа [GLY.UGA] Архивирано на сајту Wayback Machine (6. јун 2016)