Alotropske modifikacije fosfora
Elementarni fosfor može da postoji u obliku nekoliko alotropskih modifikacija. Najrasprostranjenije među njima su beli i crveni fosfor. Ljubičasti i crni alotropi su takođe poznati. Gasoviti fosfor postoji kao difosfor, ili kao atomski fosfor.[1]
Beli fosfor[уреди | уреди извор]

Beli fosfor, žuti fosfor, ili tetrafosfor (P4) je molekul sa četiri atoma vezana sa šest jednostrukih P-P veza. Njegova tetraedralna struktura dovodi do naprezanja prstena i nestabilnosti. Poznate su dve kristalne forme. α forma, koja je stabilna pod standardnim uslovima, ima teseralna kristalnu strukturu. Ona se reverzibilno transformiše u β formu na 195.2 K. Smatra se da β forma ima heksagonalnu kristalnu strukturu.[1]
Beli fosfor je transparentni voštani materijal koji brzo požuti kad je izložen svetlosti. Iz tog razloga on se takođe naziva žutim fosforom. On proizvodi zelenkasti sjaj u mraku (kad je izložen kiseoniku), visoko je zapaljiv i piroforičan (samo-zapaljiv) nakon kontakta sa vazduhom, kao i toksičan (uzrokuje ozbiljno oštećenje jetre ako se proguta, a usled hronični unos tragova belog fosfora kroz usta ili udisanjem izaziva fosfornu nekrozu vilice). Miris dima pri sagorevanju ovog oblika fosfora podseća na beli luk, a uzorci su obično prekriveni belim (di) fosfor pentoksidom, koji se sastoji od P4O10 tetraedra sa kiseonikom umetnutim između atoma fosfora i na njihovim temenima. Beli fosfor je neznatno rastvoran u vodi i, može se čuvati ispod sloja vode. On je rastvoran u benzenu, uljima, ugljen disulfidu i disumpor dihloridu.
Proizvodnja i primena[уреди | уреди извор]
Postoji nekoliko metoda za proizvodnju belog alotropa. U jednom od procesa, kalcijum fosfat, koji se dobija iz fosfatnih stena, se greje u pećima u prisustvu ugljenika i silicijum-dioksida.[2] Elementarni fosfor se oslobađa kao para koja može da se sakupi ispod fosforne kiseline.

Beli fosfor ima znatan napon pare na običnim temperaturama. Iz gustine pare proističe da se para sastoji od P4 molekula do oko 800 °C. Iznad te temperature, dolazi do disocijacije u P2 molekule.
On se spontano pali na vazduhu na oko 50 °C. Do paljenja može doći i na mnogo nižim temperaturama, ako je beli fosfor fino usitnjen. Njegovim sagorevanjem nastaje fosfor(V)-oksid:
Zbog ove osobine, beli fosfor se koristi kao oružje.
Nepostojanje kubnog-P8[уреди | уреди извор]
Mada se beli fosfor konvertuje u termodinamički stabilniji crveni alotrop, do formiranja kubnog P8 ne dolazi u kondenzovanoj fazi. Derivati ovog hipotetičnog molekula su, međutim, bili pripremljeni iz fosfaalkina.[3]
Crveni fosfor[уреди | уреди извор]


Crveni fosfor se može formirati zagrevanjem belog fosfora do 250 °C (482 °F), ili izlaganjem belog fosfora sunčevoj svetlosti. Crveni fosfor postoji kao amorfna mreža. Nakon daljeg zagrevanja, amorfni crveni fosfor se kristališe. Crveni fosfor se ne pali u vazduhu na temperaturama ispod 240 °C, dok se beli fosfor pali na oko 30 °C. Crveni fosfor se može konvertovati u beli zagrevanjam na 260 °C.
Hitorfov ljubičasti fosfor[уреди | уреди извор]


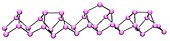
Monoklinični fosfor, ili ljubičasti fosfor, je takođe poznat kao Hitorfov metalični fosfor.[4][5] Hitorf je (1865. godine) zagrevao crveni u zatvorenoj cevi na 530 °C. Gornji deo cevi je održavan na 444 °C. Sjajni neprozirni monoklinični, ili romboedarski, kristali su se sublimirali. Ljubičasti fosfor se takođe može pripremiti rastvaranjem belog fosfora u rastopljenom olovu u zatvorenoj cevi na 500 °C tokom 18 časova. Nakon sporog hlađenja, Hitorfovi alotropi se kristališu. Kristali se mogu odvojiti rastvaranjem olova u razblaženoj azotnoj kiselini, i naknadnim ključanjem u koncentovanoj hlorovodoničnoj kiselini.[6] Hitorf je otkrio da crveno/ljubičasta forma nastaje kad se fosfor rekristališe iz rastopljenog olova. Pored toga, postoji i vlaknasta forma sa sličnim fosfornim strukturama.
Reakcije ljubičastog fosfora[уреди | уреди извор]
On se ne pali na vazduhu dok se ne zagreje do 300 °C. Ovaj alotrop nije nerastvoran ni u jednom rastvaraču. On je otporan na alkalije, i samo u maloj meri reaguje sa halogenima. On se može oksidovati azotnom kiselinom do fosforne kiseline.
Ako se zagreje u atmosferi inertnog gasa, na primer u azotu ili ugljen-dioksidu, on sublimira i para se kondenzuje kao beli fosfor. Ako se, međutim, on zagreva u vakuumu i para se rapidno kondenzuje, nastaje ljubičasti fosfor. Ljubičasti fosfor je polimer visoke relativne molekulske mase, koji se zagrevanjem razlaže do P2 molekula. Hlađenjem, ovi molekuli bi se normalno dimerizovali u P4 molekule (i.e. beli fosfor), ali u vakuumu se oni ponovo vezuju i formiraju polimerni ljubičasti alotrop.
Crni fosfor[уреди | уреди извор]
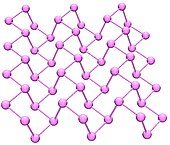

Crni fosfori su termodinamički stabilne forme fosfora na sobnoj temperaturi i pritisku. On se dobija zagrevanjem belog fosfora pod visokim pritiskom (12,000 atmosfera). Njegov izgled, osobine i struktura su veoma slični grafitu, jer je crne boje i pahuljast, provodi struju, i sadrži naborane listove vezanih atoma.
Crni fosfor ima ortorombičnu strukturu. On je najmanje reaktivan alotrop, jer se sastoji od mnogobrojnih međusobno vezanih šestočlanih prstenova. Svaki atom je vezan za tri druga atoma.[7][8] Nedavno je bilo objavljeno da se sinteza crnog fosfora može izvesti koristeći metalne soli kao katalizatore.[9]
Jedan od oblika crvenog/crnog fosfora je kubni čvrsti materijal.[10]
Difosfor[уреди | уреди извор]
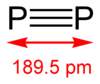
Difosforni alotrop (P2) se može dobiti samo pod ekstremnim uslovima (na primer, iz P4 na 1100 K). Ipak, izvestan napredak je ostvaren u formiranju diatomskih molekula u homogenim rastvorima, pod normalnim uslovima uz upotrebu kompleksa prelaznih metala (baziranih na primer na tungstenu i niobijumu).[11]
Difosfor je gasoviti oblik fosfora, i termodinamički je stabilna forma iznad 1200 °C, i sve do 2000 °C. Disocijacija tetrafosfora (P4) počinje na nižim temperaturama: procenat P2 na 800 °C je ≈ 1%. Na temperaturi od oko 2000 °C, molekuli difosfora počinju da se disociraju u atomski fosfor.
Fosforni nanoštapovi[уреди | уреди извор]
Fosforni nanoštapovi se sintetišu kao P12- polimeri u dve modifikacije.[12] Crveno-smeđa faza se razlikuje od crvenog fosfora i takođe je stabilna u vazduhu nedeljama. Elektronskim mikroskopom je pokazano da se crveno-smeđa forma sastoji od dugačkih, paralelnih nanoštapova da prečnikom između 0.34 nm i 0.47 nm.
| Forma | beli (α) | beli (β) | ljubičasti | crni |
|---|---|---|---|---|
| Simetrija | Teseralna | Triklinična | Monoklinična | Rombična |
| Pearsonov simbol | aP24 | mP84 | oS8 | |
| Prostorna grupa | I43m | P1 No.2 | P2/c No.13 | Cmca No.64 |
| Gustina (g/cm³) | 1.828 | 1.88 | 2.36 | 2.69 |
| Energetski razmak (eV) | 2.1 | 1.5 | 0.34 | |
| Indeks refrakcije | 1.8244 | 2.6 | 2.4 |
Vidi još[уреди | уреди извор]
Reference[уреди | уреди извор]
- ^ а б Marie-Thérèse Averbuch-Pouchot; A. Durif. (1996). Topics in Phosphate Chemistry. World Scientific. стр. 3. ISBN 978-981-02-2634-3.
- ^ Threlfall, R.E., (1951). 100 years of Phosphorus Making: 1851–1951. Oldbury: Albright and Wilson Ltd
- ^ Streubel, Rainer (1995). „Phosphaalkyne Cyclooligomers: From Dimers to Hexamers—First Steps on the Way to Phosphorus–Carbon Cage Compounds”. Angewandte Chemie International Edition in English. 34: 436. doi:10.1002/anie.199504361.
- ^ „Lateral Science – Phosphorus Topics”. Архивирано из оригинала 21. 2. 2009. г. Приступљено 20. 1. 2011.
- ^ Monoclinic phosphorus formed from vapor in the presence of an alkali metal U.S. Patent 4.620.968
- ^ Hittorf, W. (1865). „Zur Kenntniss des Phosphors”. Annalen der Physik. 202 (10): 193—228. doi:10.1002/andp.18652021002.
- ^ Brown, A.; Rundqvist, S. (1965). „Refinement of the crystal structure of black phosphorus”. Acta Crystallographica. 19: 684. doi:10.1107/S0365110X65004140.
- ^ Cartz, L.; Srinivasa, S. R.; Riedner, R. J.; Jorgensen, J. D.; Worlton, T. G. (1979). „Effect of pressure on bonding in black phosphorus”. The Journal of Chemical Physics. 71: 1718. doi:10.1063/1.438523.
- ^ Lange, Stefan; Schmidt, Peer; Nilges, Tom (2007). „Au3SnP7@Black Phosphorus: An Easy Access to Black Phosphorus”. Inorganic Chemistry. 46 (10): 4028—35. PMID 17439206. doi:10.1021/ic062192q.
- ^ Ahuja, Rajeev (2003). „Calculated high pressure crystal structure transformations for phosphorus”. Physica status solidi (b). 235: 282. doi:10.1002/pssb.200301569.
- ^ Piro, Na; Figueroa, Js; Mckellar, Jt; Cummins, Cc (2006). „Triple-bond reactivity of diphosphorus molecules.”. Science. 313 (5791): 1276—9. PMID 16946068. doi:10.1126/science.1129630.
- ^ Pfitzner, A; Bräu, Mf; Zweck, J; Brunklaus, G; Eckert, H (2004). „Phosphorus nanorods – two allotropic modifications of a long-known element.”. Angewandte Chemie (International ed. in English). 43 (32): 4228—31. PMID 15307095. doi:10.1002/anie.200460244.
- ^ Holleman, A.; Wiberg, N. (1985). „XV 2.1.3”. Lehrbuch der Anorganischen Chemie (33 изд.). de Gruyter. ISBN 978-3-11-012641-9.
- ^ Berger, L. I. (1996). Semiconductor materials. CRC Press. стр. 84. ISBN 978-0-8493-8912-2.
Literatura[уреди | уреди извор]
- Berger, L. I. (1996). Semiconductor materials. CRC Press. стр. 84. ISBN 978-0-8493-8912-2.
- Holleman, A.; Wiberg, N. (1985). „XV 2.1.3”. Lehrbuch der Anorganischen Chemie (33 изд.). de Gruyter. ISBN 978-3-11-012641-9.
- Marie-Thérèse Averbuch-Pouchot; A. Durif. (1996). Topics in Phosphate Chemistry. World Scientific. стр. 3. ISBN 978-981-02-2634-3.

