Johan Jakob Balmer
| Johan Jakob Balmer | |
|---|---|
 Johan Jakob Balmer | |
| Puno ime | Johan Jakob Balmer |
| Ime po rođenju | Johann Jakob Balmer |
| Datum rođenja | 1. maj 1825. |
| Mesto rođenja | Lauzen Švajcarska |
| Datum smrti | 12. mart 1898. (72 god.) |
| Mesto smrti | Bazel Švajcarska |
| Prebivalište | Švajcarska |
| Državljanstvo | Švajcarsko |
| Obrazovanje | Matematika |
| Univerzitet | Univerzitet u Bazelu |
Johan Jakob Balmer (Lauzen, Kanton Bazel, 1. maj 1825 — Bazel, 12. mart 1898) bio je švajcarski je fizičar i matematičar. Doktorirao je na Univerzitetu u Bazelu 1849. godine, gde je nakon toga bio zaposlen (od 1865. do 1890). Godine 1885. pronašao je matematički izraz (Balmerovu jednačinu) pomoću koga se mogu izračunati tada poznate talsne dužine λ linija u vidljivom delu vodonikog spektra (Balmerova serija: 656,3 nm, 486,1 nm, 434,1 nm i 410,2 nm):[1][2]
gde je: B - konstanta vrednosti 364,5 nm, a n - ceo broj veći od 2 (u spektru vidljive svetlosti n = 3, 4, 5 ili 6) i predvideti talasne dužine u nevidljivom delu vodikovog spektra. Usavršavanjem spektrografskih aparata Balmerova serija se proširila na ultraljubičaste linije (397,0 nm, 388,9 nm, 383,5 nm, 364,6 nm i drugo) vodonikovog spektra. Godine 1888. J. Ridberg je poopštio Balmerovu jednačinu, i pomoću nje otkrivene su Lajmanova (od 1906. do 1914), Pašenova (1908), Braketova (1922) i Pfundova (1924) serija. U okviru svog modela atoma N. Bor je (1913) teorijski protumačio Balmerovu jednačinu. Ona je značajno pridonela razvoju kvantne fizike. Po njemu je nazvan krater na Mesecu (Balmer (krater)),[3] kao i planeta 12755 Balmer.[4]
Balmerova serija[уреди | уреди извор]
Balmerova serija u atomskoj fizici prestavlja jednu od emisionih spektralnih linija vodonika, koja nastaje skokom elektrona iz viših kvantnih energetskih nivoa u niže kvantne energetske nivoe. Balmerova serija se može izračunati pomoću Balmerove jednačine. To je empirijska jednačina koju je otkrio J. J. Balmer 1885.[5][6] Vidljivi deo spektra vodonika pokazuje četiri talasne dužine: 410 nm, 434 nm, 486 nm i 656 nm, i one prestavljaju emisiju fotona, koja nastaje skokom elektrona sa višeg energetskog nivoa na energetski nivo 2. Jedan deo Balmerove serije je u ultraljubičastom delu spektra, jer je talasna dužina manja od 400 nm.[7]

Balmerovu seriju karakteriše prelazak elektrona sa n ≥ 3 na n = 2, gde se n odnosi na radijalni kvantni broj ili glavni kvantni broj elektrona. Prelazi se nazivaju grčkim slovom: n = 3 do n = 2 se naziva H-α, 4 do 2 je H-β, 5 do 2 je H-γ, a 6 do 2 je H-δ. Kako se prve spektralne linije povezane sa ovom serijom nalaze u vidljivom delu elektromagnetnog spektra, ove linije se istorijski nazivaju „H-alfa”, „H-beta”, „H-gama” i tako dalje, gde je H element vodonika.
Tranzicija n 3→2 4→2 5→2 6→2 7→2 8→2 9→2 ∞→2 Naziv H-α / Ba-α H-β / Ba-β H-γ / Ba-γ H-δ / Ba-δ H-ε / Ba-ε H-ζ / Ba-ζ H-η / Ba-η Balmerov prekid Talasna dužina (nm, vazduh) 656,279[6] 486,135[6] 434,0472[6] 410,1734[6] 397,0075[6] 388;9064[6] 383;5397[6] 364;6 Energetska razlika (eV) 1,89 2,55 2,86 3,03 3,13 3,19 3,23 3,40 Boja Crvena 
Cijan 
Plava 
Lubičasta 
(Ultraljubičasto) 
(Ultraljubičasto) 
(Ultraljubičasto) 
(Ultraljubičasto)
Iskustvene činjenice o spektrima[уреди | уреди извор]







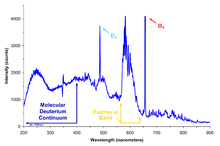


Užarena čvrsta tela emituju svetlost s kontinuirano raspodeljenim talasnim dužinama (toplotno zračenje). Od temperature užarenog tela zavisi koji je deo spektra najjači (najintenzivniji), ali od mesta maksimuma postepeno se gasi svetlost prema manjim i većim talasnim dužinama. Nasuprot tome u kontinuiranom spektru čvrstih tela opaža se kod plinova i para nešto drugo. U njihovu se spektru pojavljuju diskretne linije, koje su svojstvene za pojedine hemijske elemente. Čitav spektar se sastoji od niza oštro određenih linija.
Lako je videti da linijski spektar potiče od atoma. Takvi se spektri dobivaju pri eksperimentima s katodnim i anodnim zracima. Električno pražnjenje u katodnoj cevi niskog pritiska izaziva uvek velik broj atoma na emisiju svetlosti. Linijske spektre emituju takođe i plemeniti gasovi, koji se sastoje od čistih atoma, a ne molekula.
Linijski spektri se mogu studirati na emisionom ili apsorpcionom spektru. Pusti li se bela svetlost kroz neke pare ili plin, opaža se u dobijenom spektru da su neke talasne dužine ugušene. Tamne linije stoje točno na onim mestima spektra gde bi ležale emisijske linije. Plin dakle apsorbuje svetlost onih talasnih dužina koje bi inače emitovao. Apsorpcijski spektar slaže se potpuno s emisijskim. Ova određenost u spektrima hemijskih elemenata jedan je od temeljnih zakona nuklearne fizike.
Iako svakom hemijskom elementu pripadaju posebne, svojstvene spektralne linije, ipak se u njihovim spektrima opažaju neka zajednička svojstva, koja omogućuju da se unese red u golem spektroskopski materijal. Spektralne linije svakog hemijskog elementa mogu se urediti u nekoliko serija. Svaka pojedina serija predstavlja niz linija koje su poređane po određenom pravilu. Često se već na prvi pogled vidi da linije jedne serije pripadaju zajedno. Ako se posmatraju linije od većih talasnih dužina prema manjim, očevidno je da se razmak između njih smanjuje. Linije se gomilaju prema određenoj talasnoj dužini, koja je granica te serije.
Prvi je J. J. Balmer 1885. otkrio da se vodonikov spektar može prikazati jednostavnom matematičkom jednačinom. Njemu su tada bile poznate 4 vidljive vodonikove linije s talasnim dužinama:
- Hα = 656, 199 nm
- Hβ = 486, 152 nm
- Hγ = 434, 067 nm
- Hδ = 410, 194 nm
Običaj je da se vodonikove linije označe početnim slovima grčkog alfabeta, koja dolaze kao indeksi hemijskom simbolu H. Recipročne vrednosti talasnih dužina te četiri linije date su jednačinom (Ridbergova formula):
gde je: m = 3, 4, 5, 6; a R je takozvana Ridbergova konstanta. Ako se u Balmerovoj jednačini za m upotrebe celi brojevi veći od 7 dobijaju se talasne dužine koje leže u ultraljubičastom području spektra. Eksperimentima je pronađeno još oko 30 linija koje se potpuno slažu s Balmerovom jednačinom. Linije se gomilaju prema talasnoj dužini koja je data izrazom:
To je granica serije. Balmerova serija je idealni tip spektralnih linija uopšte. Kako se vidi na slici, razmak između susednih linija pravilno se smanjuje, i linije se gomilaju prema određenoj granici.
Iz razloga koji će se kasnije izneti uvedeno je da se spektralne jednačine postavljaju za frekvencije, a ne za talasne dužine. Eksperimentima se, doduše, mere talasne dužine (iz interferentnih, difrakcijskih ili disperzionih pojava), ali zakoni spektralne analize postaju pregledniji kad se uzimaju u obzir frekvencije. Pri tom treba misliti na sledeće: frekvencija ν se može izračunati iz talasne dužine λ prema poznatom odnosu:
Brzina svetlosti c nije jednako tačno izmerena, kako su tačna merenja talasne dužine. Tačnost spektralne analize je nenadmašiva. Iz tog razloga i dalje se u spektralnoj analizi svi iskustveni podaci izražavaju u talasnim dužinama.
Uvodeći frekvenciju, može se Balmerova jednačina napisati u obliku:
gde je m = 3, 4, 5…. Frekvencije spektralnih linija vodonika mogu se dakle prikazati kao razlike (diferencije) između dva člana, od kojih je prvi konstantan, a drugi opada kao 1/9, 1/16, 1/25, 1/36 …. Tu se odmah nameće pitanje: Mora li se uvek uzeti kao konstantan broj 1/4? Moguće je pomisliti, da prvi konstantni član bude bilo koji razlomak 1/n2. Godine 1908. je Fridrih Pašen odredio u infracrvenom području spektralne linije vodonika čije su se talasne dužine tačno slagale sa izrazima:
Tu dakle postoje dva člana jedne serije, kojoj je konstantni član R/32. Taj član ujedno određuje i granicu serije. Polazeći od te takozvane Pašenove serije nađen je vrlo velik broj linija. Godine 1916, Lajman je pronašao na drugoj strani od Balmerove serije, duboko u ultraljubičastom području, nove spektralne linije, koje se mogu prikazati istom Balmerovovom jednadžbom, samo što je za konstantni član potrebno uzeti u imeniocu celi broj 1. Vodonikov spektar se sastoji od ovih serija:
Lajmanova serija:
gde je: m = 2, 3, 4 ….
gde je: m = 3, 4, 5 ….
Pašenova serija:
gde je: m = 4, 5, 6 ….
Braketova serija:
gde je: m = 5, 6, 7 ….
Pfundova serija:
gde je: m = 6, 7, 8 ….
Od tog velikog mnoštva linija padaju u vidljivo područje spektra svega prve 4 linije Balmerove serije. Odatle se vidi kako je važno ispitivati čitav spektar da se nađu osnovni zakoni serije.
Frekvencije spektralnih linija vodonika mogu se opšteno izraziti jednačino:
gde su: n i m - celi brojevi.
Frekvencije vodonikovih linija dobiju se tako što se od niza c∙R/n2 formiraju sve moguće pozitivne razlike (diferencije). Tako objašnjena, Balmerova jednačina dovodi do opšteg načela kombinacije, što ga je otkrio V. Ric 1908. godine. Po tom načelu može se za svaki hemijski element postaviti niz članova T1, T2, T3, …. tako da su frekvencije njegovog spektra date razlikama (diferencijama):
Ricovo načelo kombinacije potvrđeno je pri ispitivanju svih spektara. Ono je ključ za sređivanje različitih serija. Načelo kombinacije sadrži u sebi osnovni zakon prirode, koji se u punom smislu razotkriva tek u nuklearnoj fizici.[8]
Reference[уреди | уреди извор]
- ^ Balmer, J.J. (1885). „Notiz über die Spectrallinien des Wasserstoffs” [Note on the spectral lines of hydrogen]. Annalen der Physik und Chemie. 3rd series (на језику: German). 25: 80—87.
- ^ Magie, William Francis (1969). A Source Book in Physics. Cambridge, Massachusetts: Harvard University Press. pp. 360
- ^ Balmer, Johann Jakob, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2017.
- ^ „12755 Balmer”. JPL.
- ^ C.R. Nave (2006). "HyperPhysics" Hydrogen Spectrum. Georgia State University, 2008.
- ^ а б в г д ђ е ж Kramida, A., Ralchenko, Yu., Reader, J., and NIST ASD Team (2019). NIST Atomic Spectra Database (ver. 5.7.1), [Online]. Available: https://physics.nist.gov/asd [2020, April 11]. National Institute of Standards and Technology, Gaithersburg, MD. Грешка: Наведен је невалидан DOI!
- ^ „CODATA Recommended Values of the Fundamental Physical Constants: 2006” (PDF). Committee on Data for Science and Technology (CODATA). NIST.
- ^ Ivan Supek: "Nova fizika", Školska knjiga Zagreb, 1966.
Spoljašnje veze[уреди | уреди извор]
- O'Connor, John J.; Robertson, Edmund F. „Johan Jakob Balmer”. MacTutor History of Mathematics archive. University of St Andrews.














