Organofosfor
Organofosforna jedinjenja su razgradiva organska jedinjenja koja sadrže ugljenik–fosfornu veza. Ova grupa jedinjenja ne obuhvata fosfatne i fosfitne estre. Oni se prvenstveno koriste za kontrolu štetočina kao alternativa hlorisanim ugljovodonicima, koji su postojani tokom dugog vremenskog perioda. Organofosforna hemija se bavi svojstvima i reaktivnošću organofosfornih jedinjenja. Fosfor i azot su u istoj grupi periodnog sistema, i stoga fosforna i azotna jedinjenja imaju slična svojstva.[1][2][3]
Ova jedinjenja su veoma efektivni insekticidi. Neka od njih jednako otrovna za ljude u malim dozama (nervni gas). U ovu grupu jedinjenja spadaju neka od najtoksičnijih supstanci ikad kreiranih.[4]
Definicija organofosfornih jedinjenja je varijabilna, što može da dovede do zabune. U industrijskoj i ekološkoj hemiji, organofosforna jedinjenja moraju jedino da sadrže jedan organski supstituent, i ne moraju da imaju direktnu vezu između fosfora i ugljenika. Stoga je veliki deo pesticida (e.g., malation), obuhvaćen ovom klasom jedinjenja.
Fosfor može da poprimi niz oksidativnih stanja, te se organofosforna jedinjenja mogu klasifikovati po valentnom stanju forsfora, i.e. fosfor(V) vs fosfor(III), koji su predominantne klase jedinjenja.
Organofosforna(V) jedinjenja, glavne kategorije[уреди | уреди извор]
Fosfatni estri i amidi[уреди | уреди извор]
Fosfatni estri imaju opštu strukturu P(=O)(OR)3 sa P(V). Takva jedinjenja su tehnološki važna kao protivpožarni agensi, i plastifikatori. Ona ne sadrže P−C vezu, te u tehničkom smislu nisu organofosforna jedinjenja nego estri fosforne kiseline. Mnoštvo derivata je nađeno u prirodi, kao što je fosfatidilholin. Fosfatni estri nastaju alkoholizom fosfornih oksihlorida. Poznati su različiti amido-alkoksi derivati, jedan medicinski značajan primer je lek protiv raka ciklofosfamid. Isto tako neki od derivata koji sadrže tiofosforilnu grupu (P=S) su pesticidi, poput malationa. Organofosfati koji se pripremaju u velikim razmerama su cink ditiofosfati, kao aditivi za mortorna ulja. Nekoliko miliona kilograma tog koordinacionog kompleksa se proizvodi godišnje putem reakcije fosfor pentasulfida sa alkoholima.[5]

Primeri organofosfata i srodnih jedinjenja: fosfatidilholin, trifenilfosfat, ciklofosfamid, paration, i zinc ditiofosfat.
Ova jedinjenja se prirodno razgrađuju putem hidrolize i krajnji produkti su fosfat i organski alkohol ili amin iz kojih su izvedeni.
Fosfonska i fosfinske kiseline i njihovi estri[уреди | уреди извор]
Fosfonati su estri fosfonske kiseline i imaju opštu formulu RP(=O)(OR')2. Fosfonati imaju mnogobrojne tehničke primene. Jedan široko poznati član je glifosat, koji je prodaji pod nazivom Roundup. Sa formulom (HO)2P(O)CH2NHCH2CO2H, ovaj derivat glicina jedan od najšire korišćenih herbicida. Bisfosfonati su klasa lekova za tretman osteoporoze. Nervni gas sarin, koji sadrži C–P i F–P veze, je fosfonat.
Fosfinati imaju dve P–C veze, i opštu formulu R2P(=O)(OR'). Komercijalno značajan pripadnik herbicida je glufosinat. Slično gore pomenutom glifosatu, on ima strukturu CH3P(O)(OH)CH2CH2CH(NH2)CO2H.

Primeri fosfonata i fosfinata: sarin (fosfonat), glifosat (fosfonat), fosfomicin (fosfonat), zoledronska kiselina (fosfonat), i glufosinat (fosfinat). U vodenom rastvoru, fosfonska kiselina se jonizuju i formiraju se korespondirajući organofosfonati.
Majkelis-Abruzova reakcija je glavni metod za sintezu ovih jedinjenja. Na primer, dimetilmetilfosfonat (pogledajte gornje formule) se formira putem preuređivanja trimetilfosfita, u prisustvu katalizatora metil jodida. U Horner–Vadsvort–Emonsovoj reakciji i Sejfert–Gilbertovoj homologaciji, fosfonati se koriste u reakciji sa karbonil jedinjenjima. Kabačnik–Fildsova reakcija je metod za pripremu aminofosfonata. Ta jedinjenja sadrže veoma inertnu vezu između fosfora i ugljenika. Konsekventno, ti materijali se hidrolizuju, čime se formiraju derivati fosfonske i fosfinske kiseline, ali ne i fosfati.
Fosfinski oksidi, imidi, i halkogenidi[уреди | уреди извор]
Fosfinski oksidi (oznaka δ3λ3) imaju opštu strukturu R3P=O sa formalnim oksidacionim stanjem V. Fosfinski oksidi formiraju vodonične veze i neki od njih su stoga rastvorni u vodi. P=O veza je veoma polarna sa dipolnim momentom od 4,51 D za trifenilfosfin oksid.
Jedinjenja srodna sa fosfinskim oksidima su imidi (R3PNR') i srodni halkogenidi (R3PE, gde je E = S, Se, Te). Ova jedinjenja se ubrajaju među termički najstabilnija organofosforna jedinjenja.
Fosfonijum soli i fosforani[уреди | уреди извор]
Jedinjenja sa formulom [PR4+]X− sačinjavaju fosfonijumske soli. Ova hemijska klasa sadrži tetraedralna fosfor(V) jedinjenja. Sa komercijalnog gledišta, najvažniji član je tetrakis(hidroksimetil)fosfonijum hlorid, [P(CH2OH)4]Cl, koji se koristi za umanjenje zapaljivosti tekstila. Godišnje se proizvede oko dva miliona kilograma hlorida i srodnog sulfata.[5] Oni se formiraju reakcijom fosfina sa formaldehidom u prisustvu mineralne kiseline:
- PH3 + HX + 4 CH2O → [P(CH2OH)4+]X−
Razne fosfonijum soli se mogu pripremiti putem alkilacije i arilacije organofosfina:
- PR3 + R'X → [PR3R'+]X−
Metilacija trifenilfosfina je prvi korak u pripremi Vitigovog reagensa.

Primeri fosfor(V) jedinjenja: fosfonijum jon P(CH2OH)4+, dve rezonantne strukture Vitigovog reagensa Ph3PCH2, i pentafenilfosforan, retko pentaorganofosforno jedinjenje.
Roditeljsko jedinjenje fosforana (δ5λ5) je PH5, koje je nepoznato. Srodna jedinjenja koja sadrže halide i organske supstituente na fosforu su dosta česta. Jedinjenja sa pet organskih supstituenata su retka, mada je P(C6H5)5 poznat. On je derivat P(C6H5)4+ koji nastaje reakcijom sa fenillitijumom.
Fosforni ilidi su nezasićeni fosforani, poznati kao Vitigov reagensi, e.g. CH2P(C6H5)3. Ta jedinjenja imaju tetraedralni fosfor(V) i ona se smatraju srodnim sa fosfinskim oksidima. Ona su isto tako izvedena iz fosfonijum soli, ali putem deprotonacije u umesto alkilacije.
Organofosfor(III) jedinjenja, glavne kategorije[уреди | уреди извор]
Fosfiti, fosfoniti, i fosfiniti[уреди | уреди извор]
Fosfiti, poznati kao fosfitni estri, imaju opštu formunu P(OR)3 i oksidaciono stanje +3. Takva jedinjenja nastaju putem alkoholize fosfor trihlorida:
- PCl3 + 3 ROH → P(OR)3 + 3 HCl
Ovo je opšta reakcija, koja predstavlja veoma veliki broj jedinjenja. Fosfiti se koriste u Perkovoj reakciji i Majkelis-Abruzovoj reakciji. Oni se koriste kao ligandi u organometalnoj hemiji.
Intermedijeri između fosfita i fosfina su fosfoniti (P(OR)2R') i fosfiniti (P(OR)R'2). Takva jedinjenja nastaju putem reakcija alkoholize korespondirajućih fosfinskih i fosfonskih hlorida ((PClR'2) i PCl2R', respektivno).
Fosfini[уреди | уреди извор]
Roditeljsko jedinjenje fosfina je PH3. Ono se naziva fosfin u SAD i Britanskom Komonveltu, dok je u drugim zemljama poznato kao fosfan.[6] Zamena jednog ili više vodoničnih centara sa organskim supstituentima (alkil, aril), daje PH3−xRx, organofosfin, generalno zvan fosfin.

Razna redukovana organofosforna jedinjenja: kompleksi organofosfinskih pincernih liganda, hiralnih difosfina koji se koriste u homogenoj katalizi, primarni fosfin PhPH2, i fosfor(I) jedinjenje (PPh)5.
Poređenje fosfina i amina[уреди | уреди извор]
Atom fosfora u fosfinima ima formalno oksidaciono stanje −3 (δ3λ3). Ova jedinjenja su fosforni analozi amina. Poput amina, fosfini imaju trigonalnu pirimidalnu molekularnu geometriju mada često sa manjim C-E-C uglovima (E = N, P), bar u odsustvu sternih efekata. C-P-C ugao veze je 98,6° za trimetilfosfin, raste do 109,7° kad se metil grupe zamene tert-butil grupama. Kad se koriste kao ligandi, sterna zapremina tercijarnih fosfina se procenjuje putem njihovog konusnog ugla. Barijera inverziji je isto tako znatno viša kod amina za proces kao što je azotna inverzija, i stoga fosfini sa tri različita supstituenta mogu da pređu u termički stabilne optičke izomere. Fosfini su obično manje bazni nego korespondirajući amini, na primer sam fosfonijum jon ima pKa od −14, u poređenju sa 9,21 za amonijum jon; trimetilfosfonijum ima pKa od 8,65 u poređenju sa 9,76 za trimetilamonijum. Međutim, trifenilfosfin (pKa 2,73) je bazniji od trifenilamina (pKa −5), uglavnom zato što je slobodni par azota u NPh3 delom delokalizovan u tri fenilna prstena. Dok je slobodni par azota delokalizovan u pirolu, slobodni par na atomu fosfora u fosfornom ekvivalentu pirola (fosfolu) nije. Reaktivnost fosfina odgovara aktivnosti amina u pogledu nukleofilnosti pri formiranju fosfonijumskih soli sa opštom strukturom PR4+X−. Ovo svojstvo se koristi u Apelovoj reakciji za konvertovanje alkohola u alkil halide. Fosfini se lako oksiduju do korespondirajućih fosfinskih oksida, dok se oksidi amina teže formiraju. To jedan od razloga što se fosfini veoma retko sreću u prirodi.
Sintetičke rute[уреди | уреди извор]
Sa komercijalnog gledišta, najvažniji fosfin je trifenilfosfin. Nekoliko miliona kilograma ovog materijala se proizvede godišnje. On se priprema reakcijom hlorobenzena, PCl3, i natrijuma.[5] Fosfini koji su u većoj meri specijalizovani obično se pripremaju koristeći druge rute.[7] Fosforni halidi podležu nukleofilnoj supstituciji dejstvom organometalnih reagenasa kao što su Grinjarovi reagensi. Konsekventno, neke sinteze obuhvataju nukleofilnu zamenu fosfidnih anjona ekvivalentima (R2P−) sa aril- i alkil halidima. Primarni (RPH2) i sekundarni fosfini (RRPH i R2PH) se dodaju u alkene u prisustvu jake baze (e.g., KOH u DMSO). Markovnikovljevo pravilo važi za ove reakcije. Slične reakcije se javljaju sa alkinima.[8] Baza nije neophodna za elektron-deficitarne alkene (e.g., derivate akrilonitrila) i alkine.
Pod uslovima slobodnih radikala P-H veze primarnih i sekundarnih fosfina se dodaju u alkene. Takve reakcije teku putem anti-Markovnikovljeve regiohemije. Azobisizobutironitril ili organski peroksidi su korisni kao inicijatori. Tercijarni fosfinski oksidi i sulfidi se mogu redukovati hlorosilanom i drugim reagensima.
Reakcije[уреди | уреди извор]
Glavni tipovi reakcija fosfina su one u kojima oni deluju kao nukleofili i baze. Njihova nukleofilnost je evidentna u njihovim reakcijama sa alkil halidima pri čemu se formiraju fosfonijum soli. Fosfini su nukleofilni katalizatori pri dimerizaciji enona u raznim reakcijama organske sinteze, e.g. Rauhut-Karijeva reakcija.
Fosfini su redukujući agensi, kao što je ilustrovano u Štaudingerovoj redukciji konvertovanja azida u amine i u Micunobijevoj reakciji konvertovanja alkohola u estre. U tim procesima, fosfin se oksiduje do fosfinskog oksida. Isto tako je poznato da fosfini redukuju aktivirane karbonilne grupe, na primer redukcija α-keto estra do α-hidroksi estra.[9] U predloženom reakcionom mehanizmu, prvi proton na pozajmici sa metil grupe u trimetilfosfinu (trifenilfosfin ne reaguje).
Fosfinski ligandi[уреди | уреди извор]
Fosfini kao što je trimetilfosfin su važni ligandi u neorganskoj hemiji. Prevashodno zahvaljujući asimetričnoj sintezi, mnoštvo različitih hiralnih difosfina je našlo široku primenu, kao što su BINAP i DIPAMP. Veliki broj fosfinskih liganda uključujući difosfine se jednostavno nazivaju „fos ligandima”.
| sPhos | 
|
SPANphos | 
|
| SEGphos | 
|
Triphos | |
| Ksantfos | 
|
XPhos | 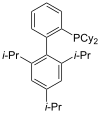
|
| Hirafos | 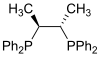
|
duPhos | 
|
| Reprezentativni fos ligandi | |||
Vidi još[уреди | уреди извор]
Reference[уреди | уреди извор]
- ^ -{Dillon, K. B.; Mathey, F.; Nixon, J. F. Phosphorus. The Carbon Copy; John Wiley & Sons,}. ISBN 978-0-471-97360-7.
- ^ -{Quin, L. D. A Guide to Organophosphorus Chemistry; John Wiley & Sons,}. 2000. ISBN 978-0-471-31824-8.
- ^ Racke, K.D. (1992). "Degradation of organophosphorus insecticides in environmental matrices". стр. 47–73 in: Chambers, J.E., Levi, P.E. (eds.), Organophosphates: Chemistry, Fate, and Effects. Academic Press, San Diego. 1997. ISBN 978-0-12-167345-1.
- ^ Lewis, Robert Alan (1998). Lewisʼ Dictionary of Toxicology. CRC Lewis. стр. 763. ISBN 978-1-56670-223-2. Приступљено 18. 7. 2013.
- ^ а б в Svara, Jürgen; Weferling, Norbert & Hofmann, Thomas (2006). „Phosphorus Compounds, Organic”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_545.pub2.
- ^ "phosphanes" in IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford . 1997. ISBN 978-0-9678550-9-7. . doi:10.1351/goldbook.P04548. Недостаје или је празан параметар
|title=(помоћ) - ^ Downing, J.H.; Smith, M.B. „Phosphorus Ligands”. Comprehensive Coordination Chemistry II. 2003: 253—296. doi:10.1016/B0-08-043748-6/01049-5.
- ^ Arbuzova, S. N.; Gusarova, N. K.; Trofimov, B. A. (2006). „Nucleophilic and free-radical additions of phosphines and phosphine chalcogenides to alkenes and alkynes”. Arkivoc. v (5): 12—36. doi:10.3998/ark.5550190.0007.503.
- ^ Zhang, W.; Shi, M. „Reduction of activated carbonyl groups by alkyl phosphines: formation of α-hydroxy esters and ketones”. Chem. Commun. 2006: 1218—1220. doi:10.1039/b516467b.
Literatura[уреди | уреди извор]
- Svara, Jürgen; Weferling, Norbert & Hofmann, Thomas (2006). „Phosphorus Compounds, Organic”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_545.pub2.
- Lewis, Robert Alan (1998). Lewisʼ Dictionary of Toxicology. CRC Lewis. стр. 763. ISBN 978-1-56670-223-2. Приступљено 18. 7. 2013.
Spoljašnje veze[уреди | уреди извор]
- organophosphorus chemistry @ www.chem.wisc.edu
- NMR predictor for organophosphorus compound chemical shifts from Alan Brisdon's Research Group Link






