Примарна структура протеина

Протеини су молекули аминокиселина повезани пептидном везом и то одређеним редоследом који се назива аминокиселинска секвенца.[1] Под примарном структуром протеина подразумева се, осим његове аминокиселинске секвенце, и број полипептидних низова из којих се молекул датог протеина састоји, као и број и положај дисулфидних мостова у њему.[2]
После биосинтезе протеини подлежу процесима пост-транслационих модификација у којим долази до ковалентног везивања појединих компоненти за бочне остатке аминокиселина. У примарној структури протеина садржано је обиље информација на основу којих су формирани модерни концепти у биохемији. Одређивање примарне структуре протеина један је од типичних послова којима се биохемичари баве.[2]
Пептидна веза[уреди | уреди извор]
α-аминокиселине могу да граде амидну везу између α-амино-групе једне и α-карбоксилне групе друге аминокиселине уз елиминацију молекула воде:
Настала амидна CO-NH веза назива се пептидна веза. При биосинтези протеина настанак једне пептидне везе повезан је са хидролизом четири анхидридне везе у молекулу АТП-а и ГТП-а са укупном променом слободне енергије од око 60 kJ/mol. За синтезу пептидне везе је потребно око 20 kJ/mol, остатак се троши у процесу транслације РНК у полипептид.[2]
Енергија активације за реакцију хидролизе је висока, тако да до хидролизе пептидне везе у воденом раствору долази тек у присуству катализатора (киселине, базе, протеолитички ензими) који снижавајући енергију активације, знатно повећавају брзину ове реакције. У одсуству катализатора пептидна веза ће бити врло стабилна и под физиолошким условима и у експерименталном раду са протеинима.[2]
Дисулфидна веза[уреди | уреди извор]
Дисулфидна веза настаје оксидацијом остатака цистеина у цистин.
Да би С-С веза настала два дела пептидног низа треба да се приближе и то под одређеним углом. Дисулфидни мост -С-С- настаје између два полипептидна низа (као код инсулина) или између делова истог полипептидног низа (као код инсулина и рибонуклеазе). Дати остатак цистеина комбинује се само са једним одређеним остатком цистеина у полипептидном низу, тако да су комбинације дисулфидних мостова у једном протеину јединствене. Настајање дисулфида није генетички детерминисано. Дисулфидни мостови настају после процеса биосинтезе протеина.[2]
Дисулфидна веза стабилизује структуру протеина и јавља се код протеина који се налазе у екстрацелуларном простору. Типични примери су змијски отров, пептидни хормони, ензими дигестивног тракта, имуноглобулини, лизозим, протеини млека. Протеини који се налазе у ћелији и никада је не напуштају ретко садрже дисулфидне мостове. Већина протеина садржи или цистеин или цистин, врло ретко обе аминокиселине.[2]
Номенклатура[уреди | уреди извор]
Аминокиселина уграђена у пептидни ланац назива се (због елиминације воде из молекула аминокиселине при грађењу пептидне везе) аминокиселински остатак, а обележава се тако што се на крају назива аминокиселине суфикс -ин замени са -ил.
Према IUPAC-IUB конвенцији протеин је полипептидни низ који садржи више од 50 аминокиселинских остатака, док се полипептидни низ који садржи 50 и мање аминокиселинских остатака назива пептид. Назив пептида формира се додатком префикса за број аминокиселинских остатака у њему (ди-, три-, тетра-, пента- итд пептид). Олигопептиди садрже неколико аминокиселинских остатака. Полипептиди који се састоје из идентичних аминокиселинских остатака су хомополипептиди, а они који се састоје из различитих остатака хетерополипептиди.
Редослед аминокиселина у полипептидном низу се пише од краја на коме се налази слободна α-амино-група (N-терминал). Крај полипептидног низа на коме се налази COOH група назива се C-терминал. Уобичајено је да се аминокиселинска секвенца приказује помоћу скраћеница за називе аминокиселина.[2]
Одређивање примарне структуре протеина[уреди | уреди извор]
Одређивање секвенце аминокиселина састоји се из:
- раздвајања полипептидних ланаца
- кидања дисулфидних мостова
- утврђивања аминокиселинског састава сваког полипептидног ланца
- идентификације N- и C-терминалних крајева
- фрагментирања полипептидног ланца и одређивања аминокиселинског састава сваког фрагмента
- понављања корака 5 коришћењем друге процедуре за сечење полипептидног ланца. Овим поступком се добија преклопљена аминокиселинска секвенца.
- Реконструкције аминокиселинске секвенце целог полипептида
- Одређивање позиције дисулфидних мостова између два цистеина
Раздвајање полипептидних ланаца[уреди | уреди извор]
Дисоцијација протеина на полипептидне ланце се врши екстремном променом pH, додавањем 8М урее, 6М гаунидијум-хидрохлорида или високих концентрација соли. При томе долази до нарушавања водоничне везе у протеину и између протеина и растварача. Тако добијени полипептидни ланци се одвајају према величини или наелектрисању.
Кидање дисулфидних мостова[уреди | уреди извор]
Кидање дисулфидних моства се врши:
- Оксидацијом пермрављом киселином при чему настају два еквивалентна цистеинске киселине.
- Редукцијом дисулфидних мостова 2-меркаптоетанолом. Након редукције се додају јодоацетат или 3-бромопропиламин, да не би дошло до рекомбинације С-С веза. Јодоацетат и 3-бромопропиламин модификују SH групе које више не могу да граде дисулфидне везе.
Анализа аминокиселинског састава[уреди | уреди извор]
Потребно је хидролизовати пептидне везе додатком јаке киселине или базе. Пошто су киселине мање деструктивне за аминокиселине (Ser, Thr, Arg и Cys), више се користе. Узорак протеина се раствара у 6N HCl на 110 ˚C у временском интервалу од 24, 48 и 72 сата. Аминокиселина триптофан се потпуно уништава у киселинама, а треонин и серин (које садрже OH групу у бочном ланцу) се полако уништавају. Хидрофобне аминокиселине, валин и изолеуцин, се опиру киселинској хидролизи.
Концентрација аспаргина и глутамина се не могу израчунати јер аспаргин прелази у аспаргинску киселину, а глутамин у глутаминску киселину.
Смеша хидролизованих аминокиселина се раздваја јоноизмењивачком хроматографијом или HPLC-ом (енгл. high-pressure liquid chromatography). Одређује се концентрација сваке аминокиселине из смеше. Обе методе су потпуно аутоматизоване и део су инструмента који се назива анализатор аминокиселина (енгл. amino acid analyser). Након анализе састава потребно је утврдити и редослед аминокиселина у полипептиду. Зато се одређују N- и C-терминални крајеви.
Идентификација N- и C- терминалних крајева[уреди | уреди извор]
Анализом N- и C-терминалних крајева одређујемо колико је пептидних ланаца присутно (један N- и C-крај значи да је присутан само један пептидни ланац). N-терминални крај се идентификује Едмановом деградацијом. Овом методом се одређује аминокиселинска секвенца, тако што се одваја по једна аминокиселина са N-краја и идентификује. Едманов реагенс (фенилизотицијанат, PITC) у слабо базном раствору, реагује са слободним аминокиселинским остатком на N-крају и настаје фенилтиокарбамил дериват (PTC-протеин). Додатком трифлуроацетатне киселине формира се тиазолинонски дериват који се одваја од пептидног низа (пептидни низ је сада краћи за једну аминокиселину). Када се дода слаба киселина овај дериват постаје PTH (фенилтиохидантоин) који се идентификује хроматографски. За идентификацију HPLC-ом, сними се хроматограм свих стандардних аминокиселина са којима се пореде аминокиселине добијене Едмановом деградацијом. При Едмановој деградацији C-терминални крај се обично веже за нерастворан носач. Инструмент који се користи је Едманов секвенатор (енгл. Edman sequenator).
C-терминални крај се идентификује коришћењем ензима карбоксипептидазе, која сече пептидне везе између две аминокиселине почевши од C-терминуса. Карбоксипептидаза A (из говеђег панкреаса) хидролизује све пептидне везе осим пролина, аргинина и лизина. Карбоксипептидаза B (из свињског панкреаса) хидролизује само аргинин и лизин, када су на C-крају, док су карбоксипептидазе C и Y ефикасне за све аминокиселине.
Фрагментација полипептидног ланца[уреди | уреди извор]
Фрагментацију полипептидног ланца могуће је извршити употребом протеолитичких ензима, који хидролизују специфичне пептидне везе. Најчешће коришћени ензими су трипсин и химотрипсин, који спадају у класу ендопептидаза (протеаза које хидролизују пептидне везе у полипептидном ланцу).
Трипсин хидролизује само пептидне везе које су на C-крају аминокиселина аргинин и лизин. На овај начин настају фрагменти који на C-крају имају Arg или Lys. Број фрагмената је једнак броју ове две аминокиселине плус 1 (C-терминални пептид протеина).
Химотрипсин хидролизује пептидне везе формиране између карбоксилних група ароматичних аминокиселина (фенилаланин, тирозин, триптофан). Пошто трипсин и химотрипсин хидролизују различите пептидне везе, делови насталих фрагмената ће се преклапати, тако да је могуће реконструисати аминокиселинску секвенцу. Могуће је користити и друге ензиме: клострипаин (хидролизује Arg резидуе), ендопептидаза Lys-C (хидролизује Lys резидуе), стафилококна протеаза (хидролизује Asp и Glu резидуе). За неспецифичну протеализу се користе: пепсин, папаин, термолизин, еластаза итд.
Реконструкција аминокиселинске секвенце[уреди | уреди извор]
Секвенце добијене фрагментацијом се пореде тако што се траже делови секвенце који се преклапају. На слици је приказана анализа секвенце протеина катроколастатина-C. У реду са ознаком CAT-C је аминокиселинска секвенца (216 AK), добијена комбинацијом неколико метода. Ред са ознаком N-Терм показује секвенцу добијену Едмановом деградацијом у Едмановом секвенатору. Редови са ознакама M1-M5, показују секвенце добијене протеолитичким фрагментирањем цијаноген бромидом, а затим Едмановом деградцијом фрагмената M1-M5. Редови са ознакама K3-K6, показују секвенце добијене протеолитичким фрагментирањем ендопептидазом Lys-C, а затим Едмановом деградацијом фрагмената. Редови са ознакама E13-E15, су секвенце добијене протеолитичким фрагментирањем стафилококном протеазом, а затим Едмановом деградацијом фрагмената.
Одређивање позиције дисулфидних мостова[уреди | уреди извор]
Да би одредили положај дисулфидних веза потребно је користити протеин у коме су све везе очуване. Методом дијагоналне електрофорезе се фрагменти (повезани дисулфидним везама) могу изоловати.
Кораци при одређивању позиције дисулфидних мостова су:
- Смеша протеинских фрагмената се наноси на ивицу папира.
- Под утицајем електричног поља, фрагменти мигрирају према катоди.
- Исечени део се држи изнад раствора пермравље киселине да би С-С везе оксидисале.
- Папир се поново ставља у електрично поље, али се сада електрофореза ради у правцу нормалном на првобитни правац.
- Пептиди који нису имали дисулфидне везе не мигрирају (формирају дијагоналу), док фрагменти који су имали С-С везе мигрирају у односу на дијагоналу, могу се изоловати и идентификовати.
Рекомбинантна ДНК и секвенцирање протеина[уреди | уреди извор]
Аминокиселинска секвенца протеина може да се одреди и на основу секвенцирања одговарајућег сегмента у молекулу ДНК. Методе за секвенцирање ДНК су брже и једноставније од горе описаних метода за секвенцирање протеина. На овај начин је одређена секвенца за више од 106 остатака у више од 3000 протеина. Међутим, и поред тога је директно одређивање примарне структуре протеина незаменљиво из више разлога. Положај дисулфидних мостова се одређује једино секвенцирањем протеина. Многи протеини се модификују после биосинтезе. Ове модификације могу да се идентификују само директним секвенцирањем протеина. У неким случајевима није могуће издвојити фрагмент ДНК који садржи информације за секвенцу датог протеина.[2]
Дакле, одређивање аминокиселинске секвенце протеина из секвенце база ДНК не може да замени директно одређивање примарне струцтуре протеина већ је комплементарно са њим.[2]
Хемијске модификације протеина[уреди | уреди извор]
Хемијске модификације протеина се примењују у испитивањима структуре, функције и својстава протеина. Примењују се и при испитивању виших нивоа структуре протеина, и за идентификацију остатака аминокиселина који су есенцијални за њихову активност и функцију. Протеин се инактивира, а модификовани остатак се идентификује при одређивању секвенце протеина. Најчешће употребљавани реагенси за модификацију појединих бочних остатака аминокиселина у протеинима (групно специфични реагенси) су: тринитробензенсулфонска киселина и етилтиотрифлуороацетат (лизин), 2,3-бутандион (аргинин), N-метилалеимид, п-хидроксимеркурибензоат, пермравља киселина (цистеин), дитиотреитол (цистин), цијаногенбромид (метионин), диазометан (спарагинска и глутаминска киселина), диетилпирокарбонат (хистидин), тетранитрометан (тирозин), N-бромсукцинимид (триптофан).
Хемијским реакцијама подлежу само аминокиселине које садрже неку реактивну групу. Бочни низови цистеина, лизина, аргинина, тирозина, серина, треонина, хистидина и метионина могу да реагују као нуклеофили; цистеин, серин, треонин, триптофан, тирозин и метионин подлежу оксидацији; триптофан, тирозин и фенилаланин електрофилној супституцији.[2]
Већина реагенаса који се примењују у протеинској хемији реаговаће са више него једним остатком аминокиселине у протеину. Пошто се реактивност протонованог и непротонованог облика бочних остатака знатно разликују, степен модификације појединих бочних остатака зависиће и од њихових вредности pKa и pH реакционе смеше.[2]
Пост-транслационе модификације протеина[уреди | уреди извор]
Слободна α-амино-група полипептида (N-терминал) може бити ковалентно измењена:

- ацетилацијом
N-терминал ацетилација: позитивно наелектрисање N-терминалне групе може бити елиинисано променом у ацетил групу (N-терминал блокада)
- формилацијом
N-терминални метионин (који се најчешће синтетише) блокира N-терминал са формил групом. Ова формил група се уклања ензимом деформилазом.

- формилацијом пироглуматата из N-терминал глутамина
N-терминал глутамин може сам себе напасти, формирајући цикличну пироглутаматну групу.
- миристолацијом
Слично као ацетилација. Уместо једноставне метил групе, миристоил група има реп од 13 хидрофобних угљеника, које се чине идеалним за везивање протеина за ћелијске мембране.
C-терминална карбоксилатна група може такође бити модификована:
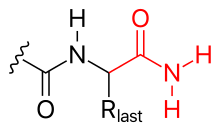
- амидизацијом
C-терминал може бити блокиран амидизацијом.
- ГПИ (гликозил фосфатидилинозитол) придруживањем
Гликозил фосфатидилинозитол је велики, хидрофобан фосфолипид простетичне групе који прикупља протеине у ћелијске мембране. Придружује се пептидној C термалној групи преко амидног ланчаног споја, па се тада повезује са етаноламином, одатле са разним шећерима, и коначно се повезује са делом фосфатидилинозитол липида.
Ковалентне измене бочног пептидног ланца[уреди | уреди извор]
ФОСФОРИЛАЦИЈА
Фосфорилација је можда најважнија хемијска модификација протеина. PO4 фосфатна група везује се на протеине. Фосфатна група се може придружити бочном ланцу хидроксилне групе серинског, треонинског, тирозинског остатка, тако што се додаје негативно наелектрисање на том делу и ствара вештачку амино киселину. Овакве реакцује су катализоване киназом док су реверзибилне реакције катализоване фосфорилазама. Фосфоризовани тирозини се често користе као држачи са којим се протеини придружују, међутим фосфорилација Ser-Thr често изазива конформационе промене, због тога што уводи негативно наелектрисање.
ГЛИКОЗИЛАЦИЈА
Гликозилација обухвата све хетерогене модификације, веома уобичајене. Делови шећера могу бити придружени бочном ланцу са хидроксилном групом Ser-Thr или бочном ланцу амидне групе Asn. Оваква придруживања могу да служе многим функцијама, које се рангирају по порасту способности комлексног препознавања. Цео процес гликозилације може бити блокиран одређеним инхибиторима као што је туникамицин.
ХИДРОКСИЛАЦИЈА
Многи протеински остаци подлежу овом хемијском процесу који уводи једну или више хидроксилних група и на тај начин их оксидује. Реакција хидроксилације је катализована ензимом који захтева аскорбинску киселину (витамин Ц) чији дефицити доводе до многих болести као нпр. скорбут .
ДЕАМИДИЗАЦИЈА
Хемијска реакција у којој амидна функционална група бива избачена из протеина. У аспарагинском бочном ланцу напада пептидну групу и ствара симетрични суццинимидни интермедијер.
МЕТИЛАЦИЈА
Представља замену водоника са метил гупом. Катализована је многим ензимима. Неколико протеинских остатака могу бити метилизовани а најпознатије су групе лизина и аргинина са позитивним наелектрисањем. Метилација ових делова се користи за регулацију протеинских функција
АЦЕТИЛАЦИЈА
Ова хемијска модификација преводи ацетил функционалну групу у органске компоненте. Ацетилација нпр. лизинске амино групе је хемијски аналогна ацетилацији N-терминалног атома. Ацетилисан лизински остатак се користи за регулацију везивања протеина у нуклеинске киселине.
СУЛФАЦИЈА
Тирозини се могу сулфуиратина његовом Оη атому. Ова модификација се налази у Голџијевом апарату. Слично фосфоризованим тирозинима, сулфоновани тирозини се користе за специфична препознавања нпр. У чемокине рецепторима који се налази у ћелијској мембрани. Као и код фосфорилације, сулфацијом неутрална област постаје негативно наелектрисана.
ПРЕНИЛАЦИЈА И ПАЛМИТОИЛАЦИЈА
Пренилација је процес превођења хидрофобног молекула у протеине. Хидрофобни изопрен (нпр. фарнезил, геранил групе) и палмитојилске групе могу бити придружене Sγ атому цистеинског остатка.
КАРБОКСИЛАЦИЈА
Релативно ретка модификација која додаје посебну карбоксилатну групу нпр. глутаматном бочном ланцу, стварајући тада Gla остатак. Користи се за јачање веза са јонима тешких метала као што је калцијум.
АДП- РИБОЗИЛАЦИЈА
Велика АДП-рибозил група може бити уграђена у неколико типова бочних ланаца унутар протеина. Ова модификација је мета за моћне токсине различитих бактерија нпр. Vibrio cholerae, Bordetella pertussis.
УБИКВИНАЦИЈА И СУМО-ЛАЦИЈА
СУМО-лација процес који мења локацију протеина, док је убиквинација хемијски процес придруживања малог протеина убиквина са другим протеинима. На овај начин се врши обележавање протеина.
Информације садржане у примарној структури протеина[уреди | уреди извор]
Примарна структура протеина представља полазну основу у истраживању сложенијих структура, својстава и активности протеина. Протеини се под физиолошким условима спонтано увијају у своју биолошки активну конформацију, из чега произилази да примарна структура одређује тродимензионалну структуру протеина. Полазећи од примарне структуре могуће је предвидети више нивое структуре протеина.
Промене у аминокиселинској секвенци протеина могу да изазову промене у његовој структури и функцији, што за последицу може имати настанак болести, нпр. српасте анемије. Линус Паулинг је открио да до српасте анемије долази при измени само једне аминокиселине у молекулу хемоглобина и ове болести је назвао молекулским болестима.[2]
Модели формирања протеина[уреди | уреди извор]
Први модел за специфично биолошко препознавање је принцип кључ у браву. Према овом моделу, молекули, крећући се потпуно случајно под дејством дифузије (Брауновско кретање), међусобно се сударају формирајући и разграђујући слабе нековалентне везе, све до тренутка док два молекула не формирају довољан број ових веза, које им омогућавају да остану заједно, насупрот термичком кретању, које настоји да их раздвоји. Другим речима, што је јаче везивање молекула у комплекс, спорија је његова дисоцијација. У граничном случају, када је енергија формиране везе блиска енергији термичког кретања, молекули дисосују истом брзином којом се и везују. У другом граничном случају, енергија везивања је толико јака да до дисоцијације готово и не долази. Везивавање молекула у реалним ситуацијама одвија се у условима између ова два крајња екстрема.[4]
Други модел који решава у великој мери проблем брзине и тачности појединих биохемијских реакција је модел двостепене међумолске интеракције. Према овом моделу свака биохемијска реакција може се поделити у две фазе. У првој фази долази до селективног препознавања молекула који учествују у реакцији на великим растојањима (неколико стотина ангстрема), након чега под дејством физичких сила, на којима је засновано ово препознавање, молекули почињу да се крећу један према другом. У другој фази долази до директног контакта између молекула и до одговарајуће хемијске интеракције (формирање ковалентне, поларне, водоничне или неке друге везе).
Механизам селективног препознавања молекула, учесника у биохемијској реакцији на великом растојању, на коме је базирана прва фаза реакције, много је теже дефинисати због комплексности самог процеса. Да би се овај процес могао одиграти потребно је :
- да постоји генерисана информација која ће обезбедити селективно комуницирање протеина који учествују у одређеној биохемијској реакцији;
- да се обезбеди пренос ове информације између два молекула која комуницирају на растојању од неколико стотина или хиљада ангстрема и
- да се покрене и одржи процес међусобног приближавања интерагујућих молекула на бази дате информације.
Први услов, запис информације, реализован је распоредом нуклеотида и аминокиселина у примарној структури информационих макромолекула. Да би се реализовала преостала два услова непходно је да дође до интеракције између молекула који носи информацију и других молекула у биолошком систему, који учествују у њеном коришћењу. Поменута међумолекулска интеракција је комлексан физички феномен који зависи од великог броја физичких карактеристика интерагујућих макромолекула (поларизабилност, диполни моменат, електрофилност, хидрофилност итд).[4]
Основне карактеристике постојећих метода за анализу протеина[уреди | уреди извор]
Методе засноване на симболичкој репрезентацији[уреди | уреди извор]
Ова група метода заснована је на приказивању примарне стуктуре секвенце у виду низа слова. У почетку, анализа овако дефинисане примарне структуре сводила се на визуелно претраживање редоследа нуклеотида или аминокиселина и одређинање степена сличности међу секвенцама. Претпоставка, која лежи у основи овог прилаза, подразумева да већи део сличности у примарној структури између две секвенце значи истовремено и вероватнију сличност у њиховој биолошкој функцији. Од пасебног значаја је одређивање делова секвенци који су заједнички за групу функционално сродних секвенци. На овај начин добијен скуп делова назива се консензус секвенца. Она представља карактеристичне одлике за које се сматра да су у корелацијиса биолошком функцијом секвенце. Ови облици могу да послуже и при препознавању непознате биолошке функције одређене секвенце чија је примарна структура позната. Сматра се да конзервирани делови секвенци са истом биолошком функцијом представљају носиоце те функције.[4]
Иако је ова метода у широкој примени, врло је тешко доказати да је конзервирани део секвенце релевантан параметар за биолошку функцију.[4]
Методе засноване на параметарској репрезентацији[уреди | уреди извор]
Ова група метода је заснована на успостављању везе између физичких, хемијских или неких других параметара нуклеотида и аминокиселина и одговарајуће биолошке функције секвенце.
Једну од метода дефинисали су Хулмес и његови сарадници. Они су анализирали периодичност нумеричког низа добијеног заменом сваке аминокиселине одговарајућом вредношћу хидрофилности.
Друга, веома актуелна метода у области анализе секвенци, је заснована на тзв. доменима протеинске секвенце. Домен је карактеристична расподела аминокиселина дате дужине. Конструкција структурних домена се обично базира на нумеричком представљању аминокиселина погодним параметром (најчешће различити параметри хидрофобности или структурни параметри). Последњих година, у циљу ефикасније идентификације хомологних домена. Понгор и сарадници су приступили формирању специфичне базе секвенципротеинских домена SBASE. Домени укључени у SBASE су сегменти секвенци са познатом структуром и/или функцијом. Неки од типова коришћени у овој бази су:
- структурни домени: делови секвенци са познатом структуром;
- хомологни домени: представљају регионе хомологије са дгугим протеинима и нису тако строго дефинисани као структурни домени; често се користе за дефинисање даљих типова домена;
- лиганд-везујући домени: сегменти секвенци за које познато да везују специфичне лиганде (нпр. ДНК, метале, шећере итд.)
- ћелијски лоцирани домени (нпр. домени трансмембранских протеина: домени у цитоплазми, трансмембрански и екстрацелуларни домени).[4]
Метод информационих спектара (ИСМ)[уреди | уреди извор]
Овај метод је заснован на физици интеракције међу молекулима. Основна специфичност ИСМа је у томе што се нуклеотиди (аминокиселине) у анализи третирају преко реалних вредности потенцијал електрон-јон интеракције (ПЕЈИ) сваке поједине нуклеотидне базе (аминокиселине). На овај начин уобичајена симболичка репрезентација примарне структуре нуклеотидне или протеинске се преводи у нумерички низ. Добијени нумерички низ се даље у анализи третира као коначан, дискретан сигнал. У случају нуклеотидних и протеинских секвенци анализира се спектрална функција, тзв. информациони спектар (ИС). Основна идеја у анализи ИС-а била је да секвенце са истом биолошком функцијом морају имати неке заједничке информационе карактеристике садржане у распореду аминокиселина. Информација садржана у секвенци је описана: (1) структуром спектра и (2) укупном снагом сигнала одговарајућег ИС-а.[4]
X-кристалографија[уреди | уреди извор]
X-кристалографија је дала први директан увид у структуру протеина, и данас је незамењива. Проблем је у томе што кристализован протеин није исто што и протеин у раствору и добијена структура је просечна структура протеина. Принцип рада ове методе је да се монохроматски сноп X-зрака дифрактује на кристалу протеина, дајући слику на фотографском филму или на array детекторима. Из те слике се “екстрахују” подаци о структури протеина. Ова метода не даје податке о мобилности и флексибилности протеина. Те податке добијамо НМР-ом.[5]
НМР спектроскопија[уреди | уреди извор]
Нуклеарно-магнетна-резонантна спекстроскопија је свестрана спектроскопска дисциплина која може да региструје сигнале атома из различитих положаја у молекулу и при томе да сваки сигнал доведе у везу са неком од познатих спинских интеракција, главним изворима података о молекулској структури и динамици.[6]
Биохемијска еволуција[уреди | уреди извор]
Блиске врсте су се развиле из заједничког претка, из чега произилази да се и сваки протеин у датој врсти морао развити из одговарајућег протеина у том претку. Протеини који у различитим организмима врше исте функције и имају заједничко порекло су хомологи протеини. Поређењем примарних структура хомологих протеина запажамо да су оне сличне, али не и идентичне. Неки аминокиселински остаци у секвенци протеина су остали у свим организмима непромењени. Такви остаци аминокиселина се називају инваријантни. У другим случајевима једна аминокиселина је замењена сличном (Asp са Glu или Lys са Arg). Ове замене се називају конзервативне. Постоје и места у секвенци на којима може да се нађе било која аминокиселина (хиперваријабилна места). На основу ових података се изводе закључци о структури и функцији протеина. Инваријантни остаци аминокиселина су изузетно важни за функцију протеина. Замена инваријантне аминокиселине изазива такве промене у тродимензионалној структури или активном месту протеина да он више не може да обавља своју функцију.[2]
Узрок измена у секвенци аминокиселина је измена у секвенци база у одговарајућем сегменту ДНК. Свака замена база у низу ДНК довешће до настајања новог пара база у том положају, што ће се одразити у новом триплету (кодону) у и-РНК (мутација у једној тачки). На основу поређења брзина еволуције протеина у разним врстама закључено је да грешке при репликацији ДНК нису главни узрок мутација.[2]
Брзина еволуције протеина је линеарна и карактеристична за сваки протеин и изражава се јединичним еволуционим периодом. Јединични еволуциони период се дефинише као време потребно за промену 1% аминокиселина у секвенци после дивергенције врста.[2]
Поређењем секвенци хомологих протеина разних врста уочено је да је број измена аминокиселина у њиховој секвенци већи уколико су врсте међусобно удаљеније. Релативно еволуционо растојање између суседних тачака гранања изражава се у PAM јединицама („Percentage of Accepted point Mutations“), што представља број измена аминокиселина на 100 аминокиселинских остатака у протеину. На овај начин сродство међу врстама се може квантитативно изразити.[2]
Еволуција протеина удвостручавањем гена[уреди | уреди извор]
Већина протеина у једном организму показује међусобне сличности у аминокиселинској секвенци. Такви протеини настају фузијом гена. После удвостручавања, ген може природном селекцијом да развије нову функцију док други ген обезбеђује синтезу првобитног протеина.[2]
Еволуција протеина може да се подели на специјацију и диференцијацију. Специјација је еволуција хомологих протеина, који у разним организмима имају исту функцију. Док је диференцијација настајање протеина са различитим функцијама из хомологих протеина унутар једног организма.[2]
Види још[уреди | уреди извор]
- Историја примарне структуре протеина
- Секундарна структура протеина
- Терцијарна структура протеина
- Кватернарна структура протеина
Референце[уреди | уреди извор]
- ^ Donald Voet; Judith G. Voet (2005). „Chapter 7. Covalent structure of proteins and nucleic acids”. Biochemistry (3 изд.). Wiley. ISBN 9780471193500.
- ^ а б в г д ђ е ж з и ј к л љ м н њ о Весна Никетић: Принцип структуре и активности протеина, Хемијски факултет-Универзитет у Београду,1995.
- ^ Ана Поповић-Бијелић : Практикум из биофизичке хемије
- ^ а б в г д ђ Јадранка М. Лазовић : Анализа односа структуре и функције протеина заснована на параметарској репрезентацији примарне структуре протеина, докторска дисертација,1995.
- ^ Горан Бачић, предавање
- ^ Слободан Мацура, Ненад Јуранић: Одређивање структуре протеина нуклеарно-тангентно-резонантном спектроскопијом




