Reakcija dehidracije
U hemiji i biološkim naukama, reakcija dehidracije, je poznata kao Cimerova hidrogeneza. Ovo je hemijska reakcija u kojoj dolazi do uklanjanja molekula vode iz reakcionog molekula. Reakcije dehidracije su podskup reakcija kondenzacije. Pošto je hidroksilna grupa (–OH) loša odlazeća grupa, obično je neophodno prisustvo Brenstedove kiseline kao katalizatora radi protonacije hidroksilne grupe, čime se formira bolja odlazeća grupa, –OH2+. Reverzna reakcija dehidracije je reakcija hidracije. Često korišteni dehidracioni agensi pri organskoj sintezi su koncentrovana sumporna kiselina, koncentrovana fosforna kiselina i topli aluminijum oksid.
Reakcije dehidracije i dehidracione sinteze imaju isto značenje. Ovi termini se često naizmenično koriste. Dva monosaharida, kao što su glukoza i fruktoza, se mogu spojiti (formirati saharozu) putem dehidracione sinteze. Novi molekul, koji se sastoji od dva monosaharida, se naziva disaharid.
Proces hidrolize je reverzibilna reakcija, što znači da se voda može rekombinovati sa dve hidroksilne grupe i disaharid može da bude revertovan u monosaharide.
U srodnoj reakciji kondenzaciji se oslobađa voda iz dva različita reaktanta.
Reakcije dehidracije[уреди | уреди извор]
U organskoj sintezi, postoji mnoštvo primera reakcija dehidracije, na primer dehidracija alkohola ili šećera.
| Reakcije dehidracije | ||
| Reakcija | Jednačina | |
|---|---|---|
| Konverzija alkohola do etara | 2 R–OH → R–O–R + H2O | |
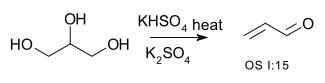
| Konverzija alkohola u alkene | R–CH2−CHOH–R → R–CH=CH–R + H2O | na primer konverzija glicerola u akrolein:[1]
ili dehidracija 2-metil-1-cikloheksanola do (uglavnom) 1-metilcikloheksena[2] |
| Konverzija karboksilnih kiselina u kisele anhidride | 2 RCOOH → (RCO)2O + H2O | |
| Konverzija amida u nitrile | RCONH2 → R–CN + H2O | |
| Dienol benzensko preuređenje | 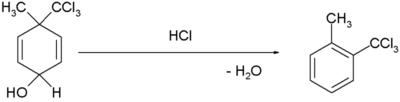 [3][4] [3][4]
| |
Neke reakcije dehidracije mogu da budu mehanistički kompleksne, na primer reakcija šećera (saharoze) sa koncentrovanom sumpornom kiselinom.[5] Pri tome se formira ugljenik kao grafitna pena, i dolazi do formiranja ugljenik-ugljenik veza.[6] Reakcija je veoma egzotermna pošto sumporna kiselina reaguje sa vodom, čime se formira hazardna para sumporne kiseline. Drugi primeri dehidracione sinteze su reakcije formiranja triglicerida iz masnih kiselina i formiranje glikozidnih veza između ugljeno hidratnih molekula, kao što je formiranje maltoze iz dva glukozna molekula.
Vidi još[уреди | уреди извор]
Reference[уреди | уреди извор]
- ^ H. Adkins; W. H. Hartung (1926). „Acrolein”. Org. Synth. 6: 1. doi:10.15227/orgsyn.006.0001.; Coll. Vol., 1, стр. 15
- ^ J. Brent Friesen; Robert Schretzman (2011). „Dehydration of 2-Methyl-1-cyclohexanol: New Findings from a Popular Undergraduate Laboratory Experiment”. J. Chem. Educ. 88 (8): 1141—1147. Bibcode:2011JChEd..88.1141F. doi:10.1021/ed900049b.
- ^ H. Plieninger; Gunda Keilich (1956). „Die Dienol-Benzol-Umlagerung” [The dienol-benzene rearrangement]. Angew. Chem. (на језику: German). 68 (19): 618. doi:10.1002/ange.19560681914.
- ^ Margaret Jevnik Gentles; Jane B. Moss; Hershel L. Herzog; E. B. Hershberg (1958). „The Dienol-Benzene Rearrangement. Some Chemistry of 1,4-Androstadiene-3,17-dione”. J. Am. Chem. Soc. 80 (14): 3702—3705. doi:10.1021/ja01547a058.
- ^ mrdan4 (31. 10. 2009). „sulphuric acid on sugar cubes chemistry experiment 8” — преко YouTube.
- ^ „sugarsulfuricacid”. www.exo.net.