Transaminaza
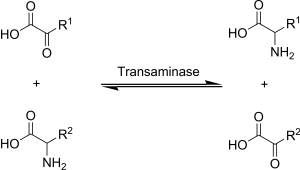
Transaminaze ili aminotransferaze su enzimi koji katalizuju reakciju transaminacije između aminokiselina i α-ketokiselina. Oni su važni za sintezu aminokiselina, iz kojih se formiraju proteini.[6]
Funkcija i mehanizam[уреди | уреди извор]
Aminokiselina sadrži amino () grupu. Keto kiselina sadrži keto () group. U transaminaciji, grupa sa jednog molekula se zamenjuje sa grupom drugog molekula. Aminokiselina postaje ketokiselina, i ketokiselina postaje aminokiselina.[7][8][9]
Većina transaminaza su proteinski enzimi. Međutim, za neke transaminacione aktivnosti ribozoma je utvrđeno da su katalizovane ribozimima (RNK enzimima). Primeri toga su hamerhed ribozim, VS ribozim i ukosnični ribozim.
Za dejstvo transaminaza je neophodan koenzim piridoksal-fosfat, koji se konvertuje u piridoksamin u prvoj fazi reakcije, kad se aminokiselina konvertuje u ketokiselinu. Piridoksamin vezan za enzime reaguje sa piruvatom, oksaloacetatom, ili alfa-ketoglutaratom, pri čemu se formira alanin, aspartična kiselina, ili glutaminska kiselina, respektivno. Mnoge reakcije transaminacije se odvijaju u tkivima posredstvom transaminaze specifične za dati amino/ketokiselinski par. Reakcije su lako reverzibilne, a smer je određen viškom prisutnog reaktanta. Specifični enzimi su imenovani po jednom od reaktanata para, npr. reakcija između glutaminske kiseline i piruvinske kiseline kojom se formira alfa-ketoglutarna kiselina i alanin je posredovana glutaminsko-piruvinskom transaminazom ili GPT skraćeno.
Aktivnosti tkivne transaminaze se mogu ispitati putem inkubacije homogenata sa raznim amino/keto parovima kiselina. Transaminacija je demonstrirana ako se korespondirajuća nova aminokiseline i ketokiselina formiraju, što se može odrediti hromatografijom na papiru. Reverzibilnost se demonstrira koristeći komplementarni par keto/aminokiseline kao početne reakctante.
Vidi još[уреди | уреди извор]
- Valproinska kiselina - inhibitor GABA transaminaze
Reference[уреди | уреди извор]
- ^ Bertland, L.H. & Kaplan, N.O. (1968). „Chicken heart soluble aspartate aminotransferase. Purification and properties”. Biochemistry. 7: 134—142. PMID 5758538.
- ^ Forest, J.C. & Wightman, F. (1973). „Amino acid metabolism in plants. III. Purification and some properties of a multispecific aminotransferase isolated from bushbean seedlings (Phaseolus vulgaris L.)”. Can. J. Biochem. 50: 813—829.
- ^ Henson, C.P. & Cleland, W.W. (1964). „Kinetic studies of glutamic oxaloacetic transaminase isozymes”. Biochemistry. 3: 338—345. PMID 14155095.
- ^ Schreiber, G.; Eckstein, M.; Oeser, A.; Holzer, H. (1964). „The concentration of aspartate aminotransferase from brewers’ yeast”. Biochem. Z. 340: 13—20. PMID 14317947.
- ^ Shrawder, E. & Martinez-Carrion, M. (1972). „Evidence of phenylalanine transaminase activity in the isoenzymes of aspartate transaminase”. J. Biol. Chem. 247: 2486—2492. PMID 4623131.
- ^ Banks, B.E.C. & Vernon, C.A. (1961). „Transamination. Part I. The isolation of the apoenzyme of glutamic-aspartic transaminase from pig heart muscle”. J. Chem. Soc. (Lond.): 1698—1705.
- ^ Jenkins, W.T.; Yphantis, D.A.; Sizer, I.W. (1959). „Glutamic aspartic transaminase. I. Assay, purification, and general properties”. J. Biol. Chem. 234: 51—57. PMID 13610891.
- ^ Lowe, P.N. & Rowe, A.F. (1985). „Aspartate: 2-oxoglutarate aminotransferase from Trichomonas vaginalis. Identity of aspartate aminotransferase and aromatic amino acid aminotransferase”. Biochem. J. 232: 689—695. PMID 3879173.
- ^ Mavrides, C. & Orr, W. (1975). „Multispecific aspartate and aromatic amino acid aminotransferases in Escherichia coli”. J. Biol. Chem. 250: 4128—4133. PMID 236311.
Literatura[уреди | уреди извор]
- Ghany, Marc & Hoofnagle, Jay H. (2005). Approach to the Patient With Liver Disease. In Dennis L. Kasper, Anthony S. Fauci, Dan L. Longo, Eugene Braunwald, Stephen L. Hauser, & J. Larry Jameson (Eds.), Harrison's Principles of Internal Medicine (16th Edition), pp. 1814–1815. New York: McGraw-Hill.
- Nelson, David L. & Cox, Michael M. (2000). Lehninger Principles of Biochemistry (3rd ed.), pp. 628–631, 634, 828–830. New York: Worth Publishers.
Spoljašnje veze[уреди | уреди извор]
- Transaminases на US National Library of Medicine Medical Subject Headings (MeSH)


