Хемијско једињење — разлика између измена
м razne ispravke |
. |
||
| Ред 1: | Ред 1: | ||
{{Infobox |
|||
'''Хемијско једињење''' је чиста сложена [[хемијска супстанца|супстанца]] која се састоји из два или више [[Хемијски елемент|елемената]].<ref>{{harvnb|Pauling|1970|pp=}}</ref><ref>{{Cite book| author=Ebbin, Darrell, D. |title=General Chemistry, 3rd Ed.|location=Boston|publisher=Houghton Mifflin Co.|year=1990|isbn=978-0-395-43302-7|pages=}}</ref><ref>{{Cite book|author=Brown, T.L. |title=Chemistry – the Central Science, 9th Ed.|location=New Jersey|publisher=Prentice Hall|year=2003|isbn=978-0-13-066997-1|pages=}}</ref><ref>{{harvnb|Chang|1998|pp=}}</ref>{{sfn|Zumdahl|1997|pp=}} Састав хемијских једињења је сталан без обзира на начин њиховог постанка. Традиционално се хемијска једињења деле на [[органска једињења|органска]] и [[Неорганска хемија|неорганска]]. Треба нагласити да ова подела није потпуно прецизна јер постоје једињења која се могу убројати у обе групе. Некада се издвајају још неке групе као што је на пример [[силикат]]на органска једињења.<ref name="Clayden1st">{{Clayden1st}}</ref><ref name="March6th">{{March6th}}</ref> |
|||
|data1 = [[File:2006-02-13 Drop-impact.jpg|200px]][[File:Water-3D-balls.png|130px]] |
|||
|data2 = На горњој слици: чиста [[вода]] (Х<sub>2</sub>О) у чаши, примјер је хемијског споја. Доље: такозвани молекулски модел "лопте и штапа" који представља да је састављена вода из два дијела [[водоник]]а (приказан бијело) и једног дијела [[кисеоник]]а (црвено) |
|||
}} |
|||
'''Хемијско једињење''' је чиста [[хемијска супстанца]] која се састоји из два или више различитих [[Хемијски елемент|хемијских елемената]]<ref name="Brown p.6" /><ref name="Hill p.6" /><ref name="Whitten p.15" />, а која се помоћу [[хемијска реакција|хемијских реакција]] може раздвојити у једноставније супстанце.<ref name="Wilbraham p.36" /> Свако хемијско једињење има јединиствену, дефиницану [[хемијска структура|хемијску структуру]]. Она се састоје од [[атом]]а у фиксном одсносу<ref name="Whitten p.15"/> који су повезани један с другим [[хемијска веза|хемијским везама]] у дефинисаном просторном распореду. Хемијска једињења могу бити [[молекул]]и који су повезана [[ковалентна веза|ковалентним везама]], [[соли]] које су настале везањем атома [[јон]]ским везама, међуметална једињења који се држе на окупу металним везама или комплекси који су повезани координатним ковалентним везама. Разлика између хемијског једињења и смесе огледа се у томе што се смеса може раставити на своје појединачне састојке физичким методама раздвајања (сепарације), попут филтрирања, седиментације, [[дестилација|дестилације]] и других. |
|||
Нека неорганска једињења су: |
|||
* [[киселина|киселине]] |
|||
Чисти хемијски елементи се не сматрају хемијским једињењима, чак и када су они састављени из молекула које садрже само једну врсту атома једног елемента (као на пример молекули [[водоник|-{H}-<sub>2</sub>]], [[Сумпор|-{S}-<sub>8</sub>]], итд.),<ref name="Halal" /> а који се називају диатомним или полиатомним молекулима. |
|||
* [[со]]ли |
|||
* [[оксид]]и |
|||
== Шире дефиниције == |
|||
* [[хидроксид]]и |
|||
Постоје одређени изузеци од горње дефиниције, јер многи чврсти хемијски материјали који су изобилни на [[Земља|Земљи]] (на пример многи [[силикатни минерали]]), немају једноставне хемијске формуле у којима су различити елементи спојени хемијским везама један с другим, другим речима они не стоје у тачној и фиксној размери. Таква кристална једињења се називају нестехиометријским. Њихов састав варира било због присуства других елемената који су ''заробљени'' унутар њихове [[кристална структура|кристалне структуре]] било да има мањка или вишка неког од њихових основних елемената. Таква нестехиометријска хемијска једињења сачињавају највећи део [[Земљина кора|Земљине коре]]. |
|||
* [[хидрид]]и |
|||
Друга једињења, за које се сматра да су хемијски идентична, могу имати различите количине тежих или лакших [[изотоп]]а својих саставних елемената, а који незнатно мењају масени однос елемената. |
|||
== Бројност и разноврсност == |
|||
У зависности од начина и врсте везе између атомима елемената од којих се састоји дато једињење, могу се разликовати четири основне врсте хемијских једињења: |
|||
* ковалентна једињења (једињења једног неметалног елемента и једног или више других неметала) |
|||
* јонска једињења (састоје се од једног [[метал (хемија)|метала]] и једног или више неметала) |
|||
* метална једињења |
|||
* комплекси (комплексна једињења, од катјона метала и јона или других молекула) |
|||
Тачнија, прецизнија категоризација молекула и њихова систематизација у неку од ова четири категорије може се начинити помоћу разлика у [[електронегативност]]и елемената који улазе у састав неког једињења. Међутим, постоје и одређени прелазни облици између четири наведена идеална типа једињења. |
|||
Данас је познато више од 80 милиона познатих хемијских једињења, јонских, тј. једињења сличних солима као и комплекса, металних и молекуларних једињења. Такође једна од основних подела је подела на [[неорганско једињење|неорганска]] и [[органско једињење|органска]] једињења, при чему се као ''органска'', уз само неколико изузетака, означавају сва једињења који садрже [[угљеник]]. Године 2002. било је познато око 16 милиона органских, три милиона неорганских једињења и око један милион полимера.<ref name="univlex" /> |
|||
=== Ковалентна једињења === |
|||
[[Молекул|Једињења]] настају од два или више атома неметала. Они су у општем случају изолатори, не проводе електричну струју, и углавном имају релативно ниску тачку кључања (осим једињења сличних дијаманту и вештачких материјала са изузетно великим молекулима). Најмањи делови ковалентно везаних једињења су неутрални спојеви атома (молекули). Они се могу састојати из два атома (као например [[угљен-моноксид]], CO), три атома (например [[угљен-диоксид]]), а неки и до неколико хиљада или десетина хиљада атома (огромни молекули, полимери, например вјештачки материјал [[полиетилен]] или молекул који преноси генетски материјал (ДНК). Атоми у молекулама су повезани путем атомских веза, тј. атоми који су међусобно повезани заједнички користе парове спољашњих [[електрон]]а. |
|||
=== Јонска једињења === |
|||
[[Datoteka:Pyrite1.jpeg|thumb|Минерал гвожђе-сулфида ([[Пирит (минерал)|пирит]]), јонско једињење гвожђаа и [[сумпор]]а]] |
|||
[[Datoteka:Selpologne.jpg|thumb|Кристали кухињске соли]] |
|||
''Јонска једињења'' ([[со]]ли) састоје се из катјона и анјона. Они су често попут соли: |
|||
* крти, |
|||
* формирају [[кристал]]е |
|||
* имају релативно високу тачку топљења и кључања, и |
|||
* проводе електричну струју само у смеши или раствору. |
|||
[[Јон]]и настају реакцијама атома метала и неметала, при чему атоми метала отпуштају [[електрон]]е (оксидирају), а те електроне примају атоми неметала (редуцирају се). Тако настали катјони метала и анјони неметала се спајају због електростатичке привлачности кристалних јона. Према врсти неметала који формирају јонске везе разликују се следећа јонска једињења: оксиди ([[кисеоник]] као анјон), сулфиди ([[сумпор]]), флуориди ([[флуор]]), хлориди, бромиди, јодиди, нитриди (са [[азот]]ом), карбиди (са [[угљеник]]ом), хидриди (са [[водоник]]ом) и други. Поред тога, у састав аниона улази и кисеоник као трећи елемент, па тако настају још и сулфати, хлорати, нитрати, карбонати итд. |
|||
Неки од примера јонских једињења су гвожђе(ИИИ) оксид (слично рђи), пирит (гвожђе-сулфид), натријум хлорид (кухињска со) и калцијум сулфат (гипс). |
|||
=== Међуметална једињења === |
|||
''Међуметална једињења'' (често у свакодневном говору позната и као [[легура|легуре]]) настају из два или више метала. Оне су: |
|||
* врло добри проводници електричне струје, |
|||
* добро се могу обликовати, |
|||
* имају метални сјај, |
|||
* добро проводе топлоту и |
|||
* на собној температури су углавном у [[чврсто агрегатно стање|чврстом стању]]. |
|||
[[Datoteka:Bronzebeile.JPG|thumb|Преисторијске секире израђене из [[бронза]]них легура. Бронза је била један од првих материјала које је израдио човек (такође погледајте чланак [[бронзано доба]]).]] |
|||
Спајање различитих метала у легуре може се вршити у произвољним размерама, нарочито када се ради о мешању два или више истопљена метала у смесу. Када се граде ''међуметална једињења'', тада су елементи које их граде садржани у њима само у тачно одређеним количинским односима (''међуметалним фазама'', стехиометријским саставима, види такођ и чланак [[стехиометрија]]) |
|||
Примери легура су [[бронза]] (од [[бакар|бакра]] и [[калај]]а), [[месинг]] (бакар са [[цинк]]ом) и бакар-никл (метал за израду кованица). Примери међуметалних једињења су једињења између [[магнезијум]]а и [[германијум]]а (формула: -{Mg<sub>2</sub>Ge}-), -{Al<sub>2</sub>Cu}-, магнезијум силицид (-{Mg<sub>2</sub>Si}-), бронза -{Cu<sub>4</sub>Sn}-, те [[цементит]] {{Fe<sub>3</sub>C}} (од гвожђа и угљеника, при чему се угљеник понаша као метал) и WC (волфрам карбид). |
|||
=== Комплекси === |
|||
[[Datoteka:Hemoglobin t-r state ani.gif|thumb|[[Хемоглобин]],<ref>{{cite journal |author=Weed, Robert I.|author2= Reed, Claude F. |author3= Berg, George |title=Is hemoglobin an essential structural component of human erythrocyte membranes? |pmc=289318|journal=J Clin Invest.|pmid=13999462 |volume=42 |issue=4 |pages=581–8 |year=1963 |doi=10.1172/JCI104747}}</ref> један од основних састојака [[крв]]и, комплекс [[гвожђе|гвожђа]] чија се структура мења примањем (оксидацијом) и отпуштањем (редукцијом) [[кисеоник]]а (реакција грађења комплекса).<ref name=Perutz1960>{{Cite journal | last1 = Perutz | first1 = M.F. | last2 = Rossmann | first2 = M.G. | last3 = Cullis | first3 = A.F. | last4 = Muirhead | first4 = H. | last5 = Will | first5 = G. | last6 = North | first6 = A.C.T. | year = 1960 | title = Structure of H | journal = Nature | volume = 185 | issue = 4711 | pages = 416–422 | doi = 10.1038/185416a0 | pmid = 18990801 }}</ref><ref name="pmid13734651">{{cite journal | author = Perutz MF | title = Structure of haemoglobin | journal = Brookhaven symposia in biology | volume = 13 | pages = 165–83 | year = 1960 | pmid = 13734651 }}</ref>]] |
|||
''Једињења вишег реда'' (комплекси) настају путем реакције грађења комплекса, већином из катјона обојених метала и молекула са слободним електронским паровима ([[лиганд]]има). Многи од комплекса су изразито обојени разним бојама. |
|||
На пример, супстанца која даје црвену боју крви, [[хемоглобин]], састоји се из јона гвожђа(-{II}-) и молекула беланчевина, те тамноплави комплекс бакар-тетрамина састављен из јона бакра(-{II}-) и [[амонијак]]а. |
|||
=== Органска једињења === |
|||
{{Glavni|Органска хемија}} |
|||
Молекуларна једињења, у којима је садржан [[угљеник]] спојен са [[водоник]]ом, означавају се као ''органским'' једињењими. Они сачињавају највећи део свих познатих хемијских једњења, а њихова разноврсност креће се од најједноставнијих попут [[гас]]а [[метан]]а из групе [[алкани|алкана]], односно уопште [[угљиководици|угљиководика]], до врло сложених једињења. Поред угљениковог скелетона (ланца), у органским једињењима често се налазе и многе друге атомске групе, које у знатној мери утичу на особине органских једињења. |
|||
Према угљиковом скелетону (ланцу), органска једињења се могу поделити на: |
|||
* алифатични угљоводоници (алифате, између осталих ацикличне угљоводонике, засићене алкане, незасићене [[алкени|алкене]] и [[алкини|алкине]], те цикличне угљоводонике. |
|||
* ароматични угљоводоници (аромате, који се даље дијеле на једноставне и кондензиране аромате), |
|||
* хетероциклична једињења, као и |
|||
* биохемијска једињења ([[алкалоид]]и, [[Аминокиселина|аминокиселине]], [[угљени хидрат]]и, [[протеин|беланчевине]], [[стероид]]е, [[терпен]]е, [[витамин]]е итд.) |
|||
Према [[Функционална група|функционалним групама]], органска једињења се могу поделити на: |
|||
* једињења кисеоника и хидрокси-једињења (алкохоле, алдехиде, естре, етре, кетоне, карбоксилне киселине итд.) |
|||
* једињења азота (амине, амиде, нитро-једињења, нитриле), |
|||
* једињења сумпора (алкантиоле, сулфиде, дисулфиде, естре сумпорне киселине, сулфоне, сулфоксиде, тионамиде, тиоестре, тио киселине итд.) |
|||
* једињења фосфора (фосфате, фосфине), |
|||
* органометална једињења. |
|||
== Основни концепти == |
|||
Карактеристичне особине једињења су: |
|||
* ''Хемијски елементи се налазе у једињењу у одређеној пропорцији'' |
|||
На пример један атом [[натријум]]а и један атом [[хлор]]а постају један молекул [[натријум-хлорид]]а (основног састојка [[со|кухињске соли]]) |
|||
* ''Једињења имају коначан скуп особина'' |
|||
Елементи из којих се састоји неко једињење, не задржавају своје првобитне особине. На пример, водоник (запаљиви гас који не подржава сагоревање) + кисеоник (незапаљиви гас који подржава сагоревање) постају вода (незапаљиви молекул који не подржава сагоревање). |
|||
[[Валенца (хемија)|Валенција]] представља број атома водоника који се могу спојити (комбиновати) са атомом неког елемента да би дали (произвели) неко хемијско једињење. |
|||
== Формула == |
|||
{{Glavni|Хемијска формула}} |
|||
[[Хемичар]]и описују једињења користећи хемијске формуле у разним форматима.<ref>{{citation | title = Nomenclature of Organic Chemistry; 1958 (A: Hydrocarbons, and B: Fundamental Heterocyclic Systems), 1965 (C: Characteristic Groups) | year =1971 | edition = 3rd | publisher = Butterworths | location = London | isbn = 0-408-70144-7}}.</ref><ref name="blue book">{{BlueBook1979}}. {{BlueBook1993}}. {{BlueBook2004}}.</ref><ref name="goldbook">''Compendium of Chemical Terminology, IMPACT Recommendations (2nd Ed.)'', Oxford:Blackwell Scientific Publications. (1997)</ref> За једињења која постоје у виду молекула, користе се формуле за молекуларне јединице. За [[полимер]]не материјале, као и минерале и многе металне оксине, обично се наводи емпиријске формула, нпр. -{NaCl}- за кухињску со. |
|||
Елементи у хемијској формули обично су наведени по одређеном реду, названом [[Хилов систем]]. У том систему, обично су прво наведени атоми [[угљеник]]а (ако их има), затим се наводе атоми водоника (ако их има), те после њих сви остали елементи по абецедном реду. Ако формула не садржи угљеник онда се сви елементи, укључујући и водоник, наводе по абецедном реду. Међутим, од тог правила постоји неколико важних изузетака. За јонска једињења, позитивни јон се готово увек наводи на првом месту, док се негативни јон наводи након њега. За оксиде, атоми кисеоника се обично наводе на крају формуле. |
|||
У општем случају, органске киселине следе нормална правила да се -{C}- и -{H}- атоми наводе први у формули. На пример, формула за трифлуороацетатну киселину обично се пише као -{C<sub>2</sub>HF<sub>3</sub>O<sub>2</sub>}-. Међутим, више структурних података могу открити описне формуле, као што је на пример формула за исту киселину у облику -{CF<sub>3</sub>CO<sub>2</sub>H}-. С друге стране, хемијске формуле за већину неорганских киселина и база су изузеци од нормалних правила. Оне се пишу у складу са правилима за јонска једињења (позитивни први, негативни други), али оне такође следе правила која наглашавају њихове Аренијусове дефиниције. Тачније, формула за већину неорганских киселина почиње са водоником, а формула за већину база завршава са хидоксидним јоном (-{OH<sup>-</sup>}-). |
|||
Формуле за неорганска једињења често не дају детаљније структурне податке о њима, као што то илустрира уобичајена употреба формуле -{H<sub>2</sub>SO<sub>4</sub>}- за молекул (сумпорне киселине) која не садржи -{H-S}- везе. Презентација која би дала много више описа и података била би -{O<sub>2</sub>S(OH)<sub>2</sub>}-, али се готово никад не пише на овај начин. |
|||
== Фазе и термалне особине == |
|||
Једињења се такође, као и хемијски елементи, могу појављивати у неколико агрегатних стања. Сва једињења се могу постојати у [[Чврсто агрегатно стање|чврстом стању]], барем на довољно ниским температурама. Молекуларна једињења такође могу да постоје и као течности, гасови, а у неким изузетним случајевима, и у виду [[плазма|плазме]]. Сва једињења се могу разложити (распасти) уколико се изложе довољно високој температури. [[Температура]] при којој се дешава таква фрагментација често се назива ''температура распадања'' (термолизе). Та тачка често није прецизно одређена и у великој мери зависи од брзине загревања. На примјер, вода се у малој мери разлаже на кисеоник и водоник при загревању на преко 2000 °C. Неки сматрају да [[угљен-диоксид]] има највишу тачку термалног распада од преко 3870 °-{C}-. |
|||
== Класе хемијских једињења == |
|||
Хемијска једињења се деле у класе: [[Неорганска једињења | неорганска]] и [[Органска једињења | органска]].<ref>Zumdahl, Steven S. Chemical Principles, Fifth Edition. New York: Houghton Mifflin, 2005. 943–946, 957. {{OCLC|77760970}}</ref> Друга класа у својој широј дефиницији укључује [[Органометална хемија|органометална једињења]], као што су [[Бор| органоборони]], [[силикон]]и, [[Органофосфор|органофосфорна једињења]] и други. |
|||
Неке врсте сложених неорганских једињења: |
|||
* [[Оксид]]и ([[Вода |-{H<sub>2</sub>O}-]], [[калцијум оксид |-{CaO}-]], [[Угљен-моноксид| -{CO<sub>2</sub>}- ]], [[фосфор(V) оксид| -{P<sub>2</sub>O<sub>5</sub>}-]] (-{P<sub>4</sub>O<sub>10</sub>}-) и сл.) |
|||
* [[Хидроксиди]] |
|||
** [[База (хемија) |базе]] ([[натријум-хидроксид |-{NaOH}-]], [[калцијум хидроксид | -{Ca(OH)<sub>2</sub>}-]], и други) |
|||
** [[Киселина|киселине]] ([[азотна киселина|-{HNO<sub>3</sub>}-]], [[сумпорна киселина | -{H<sub>2</sub>SO<sub>4</sub >}-]], [[фосфорна киселина | -{H<sub>3</sub>PO<sub>4</sub>}-]], и други). |
|||
** [[Амфотерни хидроксид]]и<ref>{{cite book |
|||
|author = Лидин Р.А. |author2= Андреева Л. Л. |author3= Молочко В. А. |
|||
|title = Константы неорганических веществ: справочник |
|||
|issue = 2-е изд., перераб. и доп |
|||
|editors = Под ред. Р. А. Лидина |
|||
|location = М. |
|||
|publisher = Дрофа |
|||
|year = 2006 |
|||
|страницы = |
|||
|pages = 685 |
|||
|isbn = 5-7107-8085-5 |
|||
}}</ref> ([[алуминијум хидроксид | -{Al(OH)<sub>3</sub>}-]], [[gvožđe(II) hidroksid |Fe(OH)<sub>2</sub>]] и сл) |
|||
* [[Киселина | неорганске киселине]] ([[Хлороводонична киселина |-{HCl}-]], [[водоник цијанид |-{HCN}-]], и други.) |
|||
* [[Нитрид]]и ([[амонијак |-{NH<sub>3</sub>}-]], [[силицијум нитрид|-{Si<sub>3</sub>N<sub>4</sub>}-]], итд .) |
|||
* [[Со]]ли ([[Натријум-хлорид | -{NaCl}-]], [[калијум нитрат | -{KNO<sub>3</sub>}-]], [[gvožđe(III) sulfat |-{Fe<sub>2</sub> (SO<sub>4</sub>)<sub>3</sub>}-]], [[литијум бромид|-{LiBr}-]], и други). |
|||
* [[Хидрат]] ([[Бакар-сулфат|-{CuSO<sub>4</sub> · 5H<sub>2</sub>O}-]], и други.) |
|||
* [[Комплексно једињење|Комплекси]] ([[Калијум ферицијанид|-{K<sub>3</sub>[Fe(CN)<sub>6</sub>}-]]],<ref>{{ cite book | author = Sharpe, A. G. | title = The Chemistry of Cyano Complexes of the Transition Metals | publisher = Academic Press | location = London | year = 1976 }}</ref> и други) |
|||
=== Органска једињења === |
|||
{{Главни |Органска једињења}} |
|||
Органска једињења или органске материје су класа хемијских једињења, која садрже [[угљеник]] (изузев [[карбид]]а, [[угљена киселина |угљене киселине]], [[карбонат]]а, [[оксиди|оксида]] угљеника и [[ цијанид]])а.<ref>Хомченко Г. П. Пособие по химии для поступающих в вузы. — 3-е изд. испр. и доп. — М.: ООО «Издательство Новая Волна», ЗАО «Издательский Дом ОНИКС», 2000. с. 334. ISBN 5-7864-0103-0, ISBN 5-249-00264-1</ref> |
|||
=== Неорганска једињења === |
|||
{{Главни |Неорганско једињење}} |
|||
Неорганско једињење је хемијско једињење које није [[Органско једињење|органско]], и.е. не садржи [[угљеник]] и (изузев [[карбид]]а, [[цијанид]]а, [[угљеник]]ових [[оксид]]а и других једињења угљеника која се традиционално називају [[неорганских једињења| неорганским]]). Неорганских једињења не поседују карактеристични угљеников костур. |
|||
== Опис главних група органских једињења == |
|||
=== Алифатична једињења === |
|||
Алифатични угљоводоници се деле у три групе [[Хомологни ред|хомологних редова]] на основу њиховог степена [[Засићеност (хемија)|засићености]]:<ref>{{GoldBookRef |title=Aliphatic compounds |file=A00217 |year=1995}}</ref> |
|||
* pарафини или [[алкан]]и су угљоводоници без двоструки или [[трострука веза|троструких веза]]<ref name="google">{{cite book|title=Hydrocarbons (Alkanes, Alkenes And Alkynes)|author=Arora, A.|date=2006|publisher=Discovery Publishing House Pvt. Limited|isbn=9788183561426|url=http://books.google.com.pk/books?id=_4vfMv7aP3EC}}</ref> |
|||
* олефини или [[алкен]]и садрже једну или више двоструких веза, нпр. диолефини (диени) или полиолефини |
|||
* [[алкин]]и садрже једну или више троструке везе. |
|||
Остатак групе се класификује на основу функционалних група. Таква једињења могу да имају прав ланац, разгранат ланац или да буду циклична. |
|||
Циклична једињења могу да буду засићена и незасићена. Најстабилнији прстени садрже пет или шест атома угљеника, мада су велики прстени (макроциклична једињења) и мањи прстени често срећу. Најмања циклоалканска фамилија је трочлани [[циклопропан]] (-{(CH<sub>2</sub>)<sub>3</sub>}-). Засићена циклична једињења ([[циклоалкан]]и) садрже само једноструке везе. [[Циклоалкен]]и и [[циклоалкин]]и садрже двоструке и троструке везе, респективно.<ref>{{March6th}}</ref> |
|||
=== Ароматична једињења === |
|||
[[Ароматичност|Ароматични]] угљоводоници садрже [[Коњуговани систем|коњуговане]] двоструке везе. Најважнији пример је [[бензен]]. Нјегову структуру је формулисао [[Фридрих Кекуле|Кекуле]] који је први предложио принцип [[Делокализација електрона|делокализације]] или [[Резонанција (хемија)|резонанције]] ради објашњавања структуре. За „конвенционална“ циклична једињења, ароматичност је одређена присуством -{4n + 2}- делокализована пи електрона, где је -{n}- цео број. Посебну нестабилност ([[антиароматичност]]) манифестују једињења са -{4n}- коњугована пи електрона.<ref>{{cite journal | last1 = Schleyer | first1 = Paul von Ragué | title = Introduction: Aromaticity | journal = Chemical Reviews | volume = 101 | issue = 5 | pages = 1115 | year = 2001 | pmid = 11749368 | doi = 10.1021/cr0103221 }}</ref><ref>{{cite journal | doi = 10.1021/cr0300946 | author = A. T. Balaban |author2= P. v. R. Schleyer |author3= H. S. Rzepa | title = Crocker, Not Armit and Robinson, Begat the Six Aromatic Electrons | journal = Chemical Reviews | year = 2005 | volume = 105 | pages = 3436–3447 }}</ref><ref>{{cite journal | last1 = Schleyer | first1 = Paul von Ragué | title = Introduction: DelocalizationPi and Sigma | journal = Chemical Reviews | volume = 105 | pages = 3433 | year = 2005 | doi = 10.1021/cr030095y}}</ref> |
|||
== ЦАС број == |
|||
За сваку познату супстанцу, укључујући и све хемијске спојеве, додијељен је јединствени [[ЦАС регистарски број]], по којима их научници и истраживачи могу једнозначно распознати. |
|||
== Види још == |
== Види још == |
||
| Ред 14: | Ред 159: | ||
== Референце == |
== Референце == |
||
{{reflist |
{{reflist|2|refs= |
||
<ref name="univlex">[http://universal_lexikon.deacademic.com/140288/chemische_Verbindung „chemische Verbindung“ im Universal-Lexikon.] Pristupljeno 8. augusta 2012.</ref> |
|||
<ref name="Halal">{{Cite book| last = Halal| first = John| title = Milady's Hair Structure and Chemistry Simplified| publisher = Milady Publishing| year = 2008| edition =5.izd.| chapter = Chapter 8: General Chemistry| url = http://www.wadsworthmedia.com/marketing/sample_chapters/156253629X_ch08.pdf| pages = str. 96–98}} ISBN 1-4283-3558-7</ref> |
|||
<ref name="Whitten p.15">{{Cite book| last = Whitten| first = Kenneth W.; Davis Raymond E.; Peck M. Larry| title = General Chemistry| location = Fort Worth, TX | publisher = Saunders College Publishing/Harcourt College Publishers| year = 2000| edition = 6.izd.| pages = str. 15}} ISBN 978-0-03-072373-5</ref> |
|||
<ref name="Brown p.6">{{Cite book| last = Brown| first = Theodore L.; LeMay H. Eugene; Bursten Bruce E. ''et.al''|title = Chemistry: The Central Science, AP Edition|location = Upper Saddle River, NJ|publisher = Pearson/Prentice Hall| year = 2009|edition = 11.izd.|pages = str.5–6|url = http://www.pearsonschool.com/index.cfm?locator=PSZ16f&PMDBSUBCATEGORYID=&PMDBSITEID=2781&PMDBSUBSOLUTIONID=&PMDBSOLUTIONID=6724&PMDBSUBJECTAREAID=&PMDBCATEGORYID=814&PMDbProgramId=52962}} ISBN 0-13-236489-1</ref> |
|||
<ref name="Wilbraham p.36">{{Cite book|last = Wilbraham|first = Antony; Matta Michael; Staley Dennis; Waterman Edward|title = Chemistry|location = Upper Saddle River, NJ|publisher = Pearson/Prentice Hall|year = 2002|edition = 1.izd.|page = str.36}} ISBN 0-13-251210-6</ref> |
|||
<ref name="Hill p.6">{{Cite book|last = Hill|first = John W.; Petrucci Ralph H.; McCreary Terry W. ''et.al.''|title = General Chemistry|location= Upper Saddle River, NJ|publisher = Pearson/Prentice Hall|year = 2005|edition = 4.izd.|pages = str.6|url = http://www.pearsonhighered.com/educator/academic/product/0,3110,0131402838,00.html}} ISBN 978-0-13-140283-6</ref> |
|||
}} |
|||
== Литература == |
== Литература == |
||
{{refbegin|2}} |
{{refbegin|2}} |
||
* {{Cite book|author=Robert Siegfried|title=From elements to atoms: a history of chemical composition|year=2002|publisher=American Philosophical Society}} ISBN 978-0-87169-924-4 |
|||
* {{Cite book |ref= harv|last=Pauling|first=Linus|title=General Chemistry|location=New York|publisher=Dover Publications, Inc.|year=1970|isbn=978-0-486-65622-9}} |
* {{Cite book |ref= harv|last=Pauling|first=Linus|title=General Chemistry|location=New York|publisher=Dover Publications, Inc.|year=1970|isbn=978-0-486-65622-9}} |
||
* {{Cite book |ref= harv|author=Ebbin, Darrell, D. |title=General Chemistry, 3rd Ed.|location=Boston|publisher=Houghton Mifflin Co.|year=1990|isbn=978-0-395-43302-7}} |
* {{Cite book |ref= harv|author=Ebbin, Darrell, D. |title=General Chemistry, 3rd Ed.|location=Boston|publisher=Houghton Mifflin Co.|year=1990|isbn=978-0-395-43302-7}} |
||
| Ред 23: | Ред 176: | ||
* {{Cite book |ref= harv|last=Chang|first=Raymond|title=Chemistry, 6th Ed.|location=New York|publisher=McGraw Hill|year=1998|isbn=978-0-07-115221-1}} |
* {{Cite book |ref= harv|last=Chang|first=Raymond|title=Chemistry, 6th Ed.|location=New York|publisher=McGraw Hill|year=1998|isbn=978-0-07-115221-1}} |
||
* {{Cite book |ref= harv|last= Zumdahl|first= Steven S. |title= Chemistry, 4th ed.|location= Boston |publisher= Houghton Mifflin|year= 1997|isbn=978-0-669-41794-4}} |
* {{Cite book |ref= harv|last= Zumdahl|first= Steven S. |title= Chemistry, 4th ed.|location= Boston |publisher= Houghton Mifflin|year= 1997|isbn=978-0-669-41794-4}} |
||
* {{cite book|author=Robert Siegfried|title=From elements to atoms: a history of chemical composition|year=2002|publisher=American Philosophical Society|isbn=978-0-87169-924-4}} |
|||
* Silberberg, Martin. Chemistry: The Molecular Nature Of Matter and Change. New York: McGraw-Hill Companies, 2004. ISBN 0-07-310169-9 |
|||
* {{cite book |
|||
|title = Высшие жирные спирты (области применения, методы производства, физико-химические свойства) |
|||
|editor = Под редакцией С. М. Локтева |
|||
|location = М. |
|||
|publisher = «Химия» |
|||
|year = 1970 |
|||
|страниц = 329 |
|||
}} |
|||
* {{cite web |
|||
| author = Курц А. Л. |author2= Брусова Г. П. |author3= Демьянович В. М. |
|||
| authorlink = |
|||
| datepublished = 1999 |
|||
| url = http://www.chem.msu.ru/rus/teaching/brusova/welcome.html |
|||
| title = Одно- и двухатомные спирты, простые эфиры и их сернистые аналоги |
|||
| work = Учебные материалы. Органическая химия |
|||
| publisher = ChemNet. Химический факультет МГУ |
|||
| accessdate = 2010-07-10 |
|||
| archiveurl = http://www.webcitation.org/616PBP7xo |
|||
| archivedate = 2011-08-21 |
|||
}} |
|||
* {{cite book |author = Маркизова Н. Ф. |author2= Гребенюк А. Н. |author3= Башарин В. А. |author4= Бонитенко Е. Ю. |
|||
|title = Спирты |
|||
|location = СПб. |
|||
|publisher = «Фолиант» |
|||
|year = 2004 |
|||
|pages = 112 |
|||
|volume = Токсикология для врачей |
|||
|isbn = 5-93929-089-2 |
|||
|тираж = |
|||
}} |
|||
* {{cite book |author =Реутов О. А. |author2= Курц А. Л. |author3= Бутин К. П.|заглавие=Органическая химия|издание=3-е изд.|место=М|издательство=Бином. Лаборатория знаний|год=2010|том=2|isbn=978-5-94774-614-9|ref=Реутов и др.}} |
|||
* {{cite web |
|||
| url = http://base.safework.ru/iloenc?d&nd=857300029&prevDoc=857300029&spack=110LogLength%3D0%26LogNumDoc%3D857300024%26listid%3D010000000100%26listpos%3D3%26lsz%3D40%26nd%3D857300024%26nh%3D1%26 |
|||
| title = Спирты |
|||
| work = Энциклопедия по охране и безопасности труда. Том IV. Раздел XVIII. Справочники. Обзор химических соединений |
|||
| publisher = Институт промышленной безопасности, охраны труда и социального партнерства |
|||
| accessdate = 2010-12-27 |
|||
| archiveurl = http://www.webcitation.org/616PCBm5B |
|||
| archivedate = 2011-08-21 |
|||
}} |
|||
* Химия. Справочное руководство. Пер. с нем. Л., Химия 1975, сс. 240—242. |
|||
* Химическая Энциклопедия в 5 томах. ред. И. Л. Кнунянц. 5 том. |
|||
* {{cite book |author = Кнунянц И. Л.|chapter = т.1 А-Дарзана|title = Химическая энциклопедия|оригинал = |ссылка = |ответственный = |издание = |location = М.|publisher = Советская энциклопедия |year = 1988 |volume = |страницы = |pages = 623|серия = |isbn = |тираж = 100 000}} |
|||
* Сайкс П. Механизмы реакций в органической химии. М.: Химия. 1991 |
|||
* Адамс М. Карбоновые кислоты в органике. М.: Химия. 1990 |
|||
* Дж. Роберт, М.Касерио "Основы органической химии" т. 1 Издание 2-е, дополненное. 1978 |
|||
* {{cite book |author = Кнунянц И. Л. |chapter = т.1 А-Дарзана|title = Химическая энциклопедия|оригинал = |ссылка = |ответственный = |издание = |место = М.|publisher = Советская энциклопедия |year = 1988|volume = |страницы = |pages = 623|серия = |isbn = |тираж = 100 000}} |
|||
* Carl Schorlemmer: ''Ursprung und Entwicklung der organischen Chemie'', Akademische Verlagsgesellschaft Geest & Portig, Leipzig, 1984. |
|||
* H. Hart, L.E. Craine, D. J. Hart, C. M. Hadad, N. Kindler: ''Organische Chemie''. 3. izd. Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8. |
|||
* Kurt Peter C. Vollhardt i N.E. Schore: ''Organische Chemie''. 4. izd, Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31380-8. |
|||
* Heinz A. Staab: ''Hundert Jahre organische Strukturchemie.'' Angewandte Chemie 70(2), str. 37–41 (1958), {{doi|10.1002/ange.19580700202}} |
|||
* Joachim Buddrus: ''Grundlagen der Organischen Chemie'', Walter de Gruyter, Berlin – New York, 3. izd. 2003, ISBN 978-3-11-014683-7. |
|||
* Hartmut Laatsch: ''Die Technik der organischen Trennungsanalyse'', Georg Thieme Verlag Stuttgart/New York 1988, ISBN 3-13-722801-8. |
|||
* dtv-atlas Chemie (Hans Breuer): ''Band 2: Organische Chemie und Kunststoffe'', 9. izd. 2006, Deutscher Taschenbuch Verlag, ISBN 3-423-03218-9. |
|||
* R. L. Shriner, R. C. Fuson, D. Y. Curtin, T. C. Morrill: ''The Systematic Identification of Organic Compounds – a laboratory manual'' 6. izd., John Wiley & Sons New York/Chichester/Brisbane/Toronto 1980, ISBN 0-471-78874-0. |
|||
{{refend}} |
{{refend}} |
||
== Спољашње везе == |
== Спољашње везе == |
||
{{Commonscat|Chemical compounds}} |
{{Commonscat|Chemical compounds}} |
||
* [http://www.3dchem.com/table.asp Brojni hemijski elementi razvrstani po svojim glavnim elementima (engl.)] |
|||
{{клица-хемија}} |
|||
[[Категорија:Хемијска једињења|*]] |
[[Категорија:Хемијска једињења|*]] |
||
Верзија на датум 13. фебруар 2017. у 00:32
 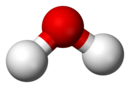 | |
| На горњој слици: чиста вода (Х2О) у чаши, примјер је хемијског споја. Доље: такозвани молекулски модел "лопте и штапа" који представља да је састављена вода из два дијела водоника (приказан бијело) и једног дијела кисеоника (црвено) |
Хемијско једињење је чиста хемијска супстанца која се састоји из два или више различитих хемијских елемената[1][2][3], а која се помоћу хемијских реакција може раздвојити у једноставније супстанце.[4] Свако хемијско једињење има јединиствену, дефиницану хемијску структуру. Она се састоје од атома у фиксном одсносу[3] који су повезани један с другим хемијским везама у дефинисаном просторном распореду. Хемијска једињења могу бити молекули који су повезана ковалентним везама, соли које су настале везањем атома јонским везама, међуметална једињења који се држе на окупу металним везама или комплекси који су повезани координатним ковалентним везама. Разлика између хемијског једињења и смесе огледа се у томе што се смеса може раставити на своје појединачне састојке физичким методама раздвајања (сепарације), попут филтрирања, седиментације, дестилације и других.
Чисти хемијски елементи се не сматрају хемијским једињењима, чак и када су они састављени из молекула које садрже само једну врсту атома једног елемента (као на пример молекули H2, S8, итд.),[5] а који се називају диатомним или полиатомним молекулима.
Шире дефиниције
Постоје одређени изузеци од горње дефиниције, јер многи чврсти хемијски материјали који су изобилни на Земљи (на пример многи силикатни минерали), немају једноставне хемијске формуле у којима су различити елементи спојени хемијским везама један с другим, другим речима они не стоје у тачној и фиксној размери. Таква кристална једињења се називају нестехиометријским. Њихов састав варира било због присуства других елемената који су заробљени унутар њихове кристалне структуре било да има мањка или вишка неког од њихових основних елемената. Таква нестехиометријска хемијска једињења сачињавају највећи део Земљине коре.
Друга једињења, за које се сматра да су хемијски идентична, могу имати различите количине тежих или лакших изотопа својих саставних елемената, а који незнатно мењају масени однос елемената.
Бројност и разноврсност
У зависности од начина и врсте везе између атомима елемената од којих се састоји дато једињење, могу се разликовати четири основне врсте хемијских једињења:
- ковалентна једињења (једињења једног неметалног елемента и једног или више других неметала)
- јонска једињења (састоје се од једног метала и једног или више неметала)
- метална једињења
- комплекси (комплексна једињења, од катјона метала и јона или других молекула)
Тачнија, прецизнија категоризација молекула и њихова систематизација у неку од ова четири категорије може се начинити помоћу разлика у електронегативности елемената који улазе у састав неког једињења. Међутим, постоје и одређени прелазни облици између четири наведена идеална типа једињења.
Данас је познато више од 80 милиона познатих хемијских једињења, јонских, тј. једињења сличних солима као и комплекса, металних и молекуларних једињења. Такође једна од основних подела је подела на неорганска и органска једињења, при чему се као органска, уз само неколико изузетака, означавају сва једињења који садрже угљеник. Године 2002. било је познато око 16 милиона органских, три милиона неорганских једињења и око један милион полимера.[6]
Ковалентна једињења
Једињења настају од два или више атома неметала. Они су у општем случају изолатори, не проводе електричну струју, и углавном имају релативно ниску тачку кључања (осим једињења сличних дијаманту и вештачких материјала са изузетно великим молекулима). Најмањи делови ковалентно везаних једињења су неутрални спојеви атома (молекули). Они се могу састојати из два атома (као например угљен-моноксид, CO), три атома (например угљен-диоксид), а неки и до неколико хиљада или десетина хиљада атома (огромни молекули, полимери, например вјештачки материјал полиетилен или молекул који преноси генетски материјал (ДНК). Атоми у молекулама су повезани путем атомских веза, тј. атоми који су међусобно повезани заједнички користе парове спољашњих електрона.
Јонска једињења


Јонска једињења (соли) састоје се из катјона и анјона. Они су често попут соли:
- крти,
- формирају кристале
- имају релативно високу тачку топљења и кључања, и
- проводе електричну струју само у смеши или раствору.
Јони настају реакцијама атома метала и неметала, при чему атоми метала отпуштају електроне (оксидирају), а те електроне примају атоми неметала (редуцирају се). Тако настали катјони метала и анјони неметала се спајају због електростатичке привлачности кристалних јона. Према врсти неметала који формирају јонске везе разликују се следећа јонска једињења: оксиди (кисеоник као анјон), сулфиди (сумпор), флуориди (флуор), хлориди, бромиди, јодиди, нитриди (са азотом), карбиди (са угљеником), хидриди (са водоником) и други. Поред тога, у састав аниона улази и кисеоник као трећи елемент, па тако настају још и сулфати, хлорати, нитрати, карбонати итд.
Неки од примера јонских једињења су гвожђе(ИИИ) оксид (слично рђи), пирит (гвожђе-сулфид), натријум хлорид (кухињска со) и калцијум сулфат (гипс).
Међуметална једињења
Међуметална једињења (често у свакодневном говору позната и као легуре) настају из два или више метала. Оне су:
- врло добри проводници електричне струје,
- добро се могу обликовати,
- имају метални сјај,
- добро проводе топлоту и
- на собној температури су углавном у чврстом стању.

Спајање различитих метала у легуре може се вршити у произвољним размерама, нарочито када се ради о мешању два или више истопљена метала у смесу. Када се граде међуметална једињења, тада су елементи које их граде садржани у њима само у тачно одређеним количинским односима (међуметалним фазама, стехиометријским саставима, види такођ и чланак стехиометрија)
Примери легура су бронза (од бакра и калаја), месинг (бакар са цинком) и бакар-никл (метал за израду кованица). Примери међуметалних једињења су једињења између магнезијума и германијума (формула: Mg2Ge), Al2Cu, магнезијум силицид (Mg2Si), бронза Cu4Sn, те цементит {{Fe3C}} (од гвожђа и угљеника, при чему се угљеник понаша као метал) и WC (волфрам карбид).
Комплекси

Једињења вишег реда (комплекси) настају путем реакције грађења комплекса, већином из катјона обојених метала и молекула са слободним електронским паровима (лигандима). Многи од комплекса су изразито обојени разним бојама.
На пример, супстанца која даје црвену боју крви, хемоглобин, састоји се из јона гвожђа(II) и молекула беланчевина, те тамноплави комплекс бакар-тетрамина састављен из јона бакра(II) и амонијака.
Органска једињења
Молекуларна једињења, у којима је садржан угљеник спојен са водоником, означавају се као органским једињењими. Они сачињавају највећи део свих познатих хемијских једњења, а њихова разноврсност креће се од најједноставнијих попут гаса метана из групе алкана, односно уопште угљиководика, до врло сложених једињења. Поред угљениковог скелетона (ланца), у органским једињењима често се налазе и многе друге атомске групе, које у знатној мери утичу на особине органских једињења.
Према угљиковом скелетону (ланцу), органска једињења се могу поделити на:
- алифатични угљоводоници (алифате, између осталих ацикличне угљоводонике, засићене алкане, незасићене алкене и алкине, те цикличне угљоводонике.
- ароматични угљоводоници (аромате, који се даље дијеле на једноставне и кондензиране аромате),
- хетероциклична једињења, као и
- биохемијска једињења (алкалоиди, аминокиселине, угљени хидрати, беланчевине, стероиде, терпене, витамине итд.)
Према функционалним групама, органска једињења се могу поделити на:
- једињења кисеоника и хидрокси-једињења (алкохоле, алдехиде, естре, етре, кетоне, карбоксилне киселине итд.)
- једињења азота (амине, амиде, нитро-једињења, нитриле),
- једињења сумпора (алкантиоле, сулфиде, дисулфиде, естре сумпорне киселине, сулфоне, сулфоксиде, тионамиде, тиоестре, тио киселине итд.)
- једињења фосфора (фосфате, фосфине),
- органометална једињења.
Основни концепти
Карактеристичне особине једињења су:
- Хемијски елементи се налазе у једињењу у одређеној пропорцији
На пример један атом натријума и један атом хлора постају један молекул натријум-хлорида (основног састојка кухињске соли)
- Једињења имају коначан скуп особина
Елементи из којих се састоји неко једињење, не задржавају своје првобитне особине. На пример, водоник (запаљиви гас који не подржава сагоревање) + кисеоник (незапаљиви гас који подржава сагоревање) постају вода (незапаљиви молекул који не подржава сагоревање).
Валенција представља број атома водоника који се могу спојити (комбиновати) са атомом неког елемента да би дали (произвели) неко хемијско једињење.
Формула
Хемичари описују једињења користећи хемијске формуле у разним форматима.[10][11][12] За једињења која постоје у виду молекула, користе се формуле за молекуларне јединице. За полимерне материјале, као и минерале и многе металне оксине, обично се наводи емпиријске формула, нпр. NaCl за кухињску со.
Елементи у хемијској формули обично су наведени по одређеном реду, названом Хилов систем. У том систему, обично су прво наведени атоми угљеника (ако их има), затим се наводе атоми водоника (ако их има), те после њих сви остали елементи по абецедном реду. Ако формула не садржи угљеник онда се сви елементи, укључујући и водоник, наводе по абецедном реду. Међутим, од тог правила постоји неколико важних изузетака. За јонска једињења, позитивни јон се готово увек наводи на првом месту, док се негативни јон наводи након њега. За оксиде, атоми кисеоника се обично наводе на крају формуле.
У општем случају, органске киселине следе нормална правила да се C и H атоми наводе први у формули. На пример, формула за трифлуороацетатну киселину обично се пише као C2HF3O2. Међутим, више структурних података могу открити описне формуле, као што је на пример формула за исту киселину у облику CF3CO2H. С друге стране, хемијске формуле за већину неорганских киселина и база су изузеци од нормалних правила. Оне се пишу у складу са правилима за јонска једињења (позитивни први, негативни други), али оне такође следе правила која наглашавају њихове Аренијусове дефиниције. Тачније, формула за већину неорганских киселина почиње са водоником, а формула за већину база завршава са хидоксидним јоном (OH-).
Формуле за неорганска једињења често не дају детаљније структурне податке о њима, као што то илустрира уобичајена употреба формуле H2SO4 за молекул (сумпорне киселине) која не садржи H-S везе. Презентација која би дала много више описа и података била би O2S(OH)2, али се готово никад не пише на овај начин.
Фазе и термалне особине
Једињења се такође, као и хемијски елементи, могу појављивати у неколико агрегатних стања. Сва једињења се могу постојати у чврстом стању, барем на довољно ниским температурама. Молекуларна једињења такође могу да постоје и као течности, гасови, а у неким изузетним случајевима, и у виду плазме. Сва једињења се могу разложити (распасти) уколико се изложе довољно високој температури. Температура при којој се дешава таква фрагментација често се назива температура распадања (термолизе). Та тачка често није прецизно одређена и у великој мери зависи од брзине загревања. На примјер, вода се у малој мери разлаже на кисеоник и водоник при загревању на преко 2000 °C. Неки сматрају да угљен-диоксид има највишу тачку термалног распада од преко 3870 °C.
Класе хемијских једињења
Хемијска једињења се деле у класе: неорганска и органска.[13] Друга класа у својој широј дефиницији укључује органометална једињења, као што су органоборони, силикони, органофосфорна једињења и други.
Неке врсте сложених неорганских једињења:
- Оксиди (H2O, CaO, CO2 , P2O5 (P4O10) и сл.)
- Хидроксиди
- неорганске киселине (HCl, HCN, и други.)
- Нитриди (NH3, Si3N4, итд .)
- Соли ( NaCl, KNO3, Fe2 (SO4)3, LiBr, и други).
- Хидрат (CuSO4 · 5H2O, и други.)
- Комплекси (K3[Fe(CN)6],[15] и други)
Органска једињења
Органска једињења или органске материје су класа хемијских једињења, која садрже угљеник (изузев карбида, угљене киселине, карбоната, оксида угљеника и цијанид)а.[16]
Неорганска једињења
Неорганско једињење је хемијско једињење које није органско, и.е. не садржи угљеник и (изузев карбида, цијанида, угљеникових оксида и других једињења угљеника која се традиционално називају неорганским). Неорганских једињења не поседују карактеристични угљеников костур.
Опис главних група органских једињења
Алифатична једињења
Алифатични угљоводоници се деле у три групе хомологних редова на основу њиховог степена засићености:[17]
- pарафини или алкани су угљоводоници без двоструки или троструких веза[18]
- олефини или алкени садрже једну или више двоструких веза, нпр. диолефини (диени) или полиолефини
- алкини садрже једну или више троструке везе.
Остатак групе се класификује на основу функционалних група. Таква једињења могу да имају прав ланац, разгранат ланац или да буду циклична.
Циклична једињења могу да буду засићена и незасићена. Најстабилнији прстени садрже пет или шест атома угљеника, мада су велики прстени (макроциклична једињења) и мањи прстени често срећу. Најмања циклоалканска фамилија је трочлани циклопропан ((CH2)3). Засићена циклична једињења (циклоалкани) садрже само једноструке везе. Циклоалкени и циклоалкини садрже двоструке и троструке везе, респективно.[19]
Ароматична једињења
Ароматични угљоводоници садрже коњуговане двоструке везе. Најважнији пример је бензен. Нјегову структуру је формулисао Кекуле који је први предложио принцип делокализације или резонанције ради објашњавања структуре. За „конвенционална“ циклична једињења, ароматичност је одређена присуством 4n + 2 делокализована пи електрона, где је n цео број. Посебну нестабилност (антиароматичност) манифестују једињења са 4n коњугована пи електрона.[20][21][22]
ЦАС број
За сваку познату супстанцу, укључујући и све хемијске спојеве, додијељен је јединствени ЦАС регистарски број, по којима их научници и истраживачи могу једнозначно распознати.
Види још
Референце
- ^ Brown, Theodore L.; LeMay H. Eugene; Bursten Bruce E. et.al (2009). Chemistry: The Central Science, AP Edition (11.izd. изд.). Upper Saddle River, NJ: Pearson/Prentice Hall. стр. str.5—6. ISBN 0-13-236489-1
- ^ Hill, John W.; Petrucci Ralph H.; McCreary Terry W. et.al. (2005). General Chemistry (4.izd. изд.). Upper Saddle River, NJ: Pearson/Prentice Hall. стр. str.6. ISBN 978-0-13-140283-6
- ^ а б Whitten, Kenneth W.; Davis Raymond E.; Peck M. Larry (2000). General Chemistry (6.izd. изд.). Fort Worth, TX: Saunders College Publishing/Harcourt College Publishers. стр. str. 15. ISBN 978-0-03-072373-5
- ^ Wilbraham, Antony; Matta Michael; Staley Dennis; Waterman Edward (2002). Chemistry (1.izd. изд.). Upper Saddle River, NJ: Pearson/Prentice Hall. стр. str.36. ISBN 0-13-251210-6
- ^ Halal, John (2008). „Chapter 8: General Chemistry”. Milady's Hair Structure and Chemistry Simplified (PDF) (5.izd. изд.). Milady Publishing. стр. str. 96—98. ISBN 1-4283-3558-7
- ^ „chemische Verbindung“ im Universal-Lexikon. Pristupljeno 8. augusta 2012.
- ^ Weed, Robert I.; Reed, Claude F.; Berg, George (1963). „Is hemoglobin an essential structural component of human erythrocyte membranes?”. J Clin Invest. 42 (4): 581—8. PMC 289318
 . PMID 13999462. doi:10.1172/JCI104747.
. PMID 13999462. doi:10.1172/JCI104747.
- ^ Perutz, M.F.; Rossmann, M.G.; Cullis, A.F.; Muirhead, H.; Will, G.; North, A.C.T. (1960). „Structure of H”. Nature. 185 (4711): 416—422. PMID 18990801. doi:10.1038/185416a0.
- ^ Perutz MF (1960). „Structure of haemoglobin”. Brookhaven symposia in biology. 13: 165—83. PMID 13734651.
- ^ Nomenclature of Organic Chemistry; 1958 (A: Hydrocarbons, and B: Fundamental Heterocyclic Systems), 1965 (C: Characteristic Groups) (3rd изд.), London: Butterworths, 1971, ISBN 0-408-70144-7.
- ^ Rigaudy, J.; Klesney, S. P., ур. (1979). Nomenclature of Organic Chemistry. IUPAC/Pergamon Press. ISBN 0-08022-3699.. IUPAC, A Guide to IUPAC Nomenclature of Organic Compounds (the Blue Book); Oxford: Blackwell Science (1993). ISBN 0-632-03488-2. Online edition: [1]. . IUPAC, Chemical Nomenclature and Structure Representation Division (27. 10. 2004). Nomenclature of Organic Chemistry (Provisional Recommendations). IUPAC..
- ^ Compendium of Chemical Terminology, IMPACT Recommendations (2nd Ed.), Oxford:Blackwell Scientific Publications. (1997)
- ^ Zumdahl, Steven S. Chemical Principles, Fifth Edition. New York: Houghton Mifflin, 2005. 943–946, 957. OCLC 77760970
- ^ Лидин Р.А.; Андреева Л. Л.; Молочко В. А. (2006). Под ред. Р. А. Лидина, ур. Константы неорганических веществ: справочник. М.: Дрофа. стр. 685. ISBN 5-7107-8085-5.
- ^ Sharpe, A. G. (1976). The Chemistry of Cyano Complexes of the Transition Metals. London: Academic Press.
- ^ Хомченко Г. П. Пособие по химии для поступающих в вузы. — 3-е изд. испр. и доп. — М.: ООО «Издательство Новая Волна», ЗАО «Издательский Дом ОНИКС», 2000. с. 334. ISBN 5-7864-0103-0, ISBN 5-249-00264-1
- ^ IUPAC (1995). „Aliphatic compounds”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Arora, A. (2006). Hydrocarbons (Alkanes, Alkenes And Alkynes). Discovery Publishing House Pvt. Limited. ISBN 9788183561426.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ Schleyer, Paul von Ragué (2001). „Introduction: Aromaticity”. Chemical Reviews. 101 (5): 1115. PMID 11749368. doi:10.1021/cr0103221.
- ^ A. T. Balaban; P. v. R. Schleyer; H. S. Rzepa (2005). „Crocker, Not Armit and Robinson, Begat the Six Aromatic Electrons”. Chemical Reviews. 105: 3436—3447. doi:10.1021/cr0300946.
- ^ Schleyer, Paul von Ragué (2005). „Introduction: DelocalizationPi and Sigma”. Chemical Reviews. 105: 3433. doi:10.1021/cr030095y.
Литература
- Robert Siegfried (2002). From elements to atoms: a history of chemical composition. American Philosophical Society. ISBN 978-0-87169-924-4
- Pauling, Linus (1970). General Chemistry. New York: Dover Publications, Inc. ISBN 978-0-486-65622-9.
- Ebbin, Darrell, D. (1990). General Chemistry, 3rd Ed. Boston: Houghton Mifflin Co. ISBN 978-0-395-43302-7.
- Brown, T.L. (2003). Chemistry – the Central Science, 9th Ed. New Jersey: Prentice Hall. ISBN 978-0-13-066997-1.
- Chang, Raymond (1998). Chemistry, 6th Ed. New York: McGraw Hill. ISBN 978-0-07-115221-1.
- Zumdahl, Steven S. (1997). Chemistry, 4th ed. Boston: Houghton Mifflin. ISBN 978-0-669-41794-4.
- Robert Siegfried (2002). From elements to atoms: a history of chemical composition. American Philosophical Society. ISBN 978-0-87169-924-4.
- Silberberg, Martin. Chemistry: The Molecular Nature Of Matter and Change. New York: McGraw-Hill Companies, 2004. ISBN 0-07-310169-9
- Под редакцией С. М. Локтева, ур. (1970). Высшие жирные спирты (области применения, методы производства, физико-химические свойства). М.: «Химия». Непознати параметар
|страниц=игнорисан (помоћ) - Курц А. Л.; Брусова Г. П.; Демьянович В. М. „Одно- и двухатомные спирты, простые эфиры и их сернистые аналоги”. Учебные материалы. Органическая химия. ChemNet. Химический факультет МГУ. Архивирано из оригинала 2011-08-21. г. Приступљено 2010-07-10. Непознати параметар
|datepublished=игнорисан (помоћ) - Маркизова Н. Ф.; Гребенюк А. Н.; Башарин В. А.; Бонитенко Е. Ю. (2004). Спирты. Токсикология для врачей. СПб.: «Фолиант». стр. 112. ISBN 5-93929-089-2.
- Реутов О. А.; Курц А. Л.; Бутин К. П. М. ISBN 978-5-94774-614-9 Проверите вредност параметра
|isbn=: checksum (помоћ). Непознати параметар|издание=игнорисан (помоћ); Непознати параметар|том=игнорисан (помоћ); Непознати параметар|год=игнорисан (помоћ); Непознати параметар|издательство=игнорисан (помоћ); Непознати параметар|заглавие=игнорисан (помоћ); Недостаје или је празан параметар|title=(помоћ) - „Спирты”. Энциклопедия по охране и безопасности труда. Том IV. Раздел XVIII. Справочники. Обзор химических соединений. Институт промышленной безопасности, охраны труда и социального партнерства. Архивирано из оригинала 2011-08-21. г. Приступљено 2010-12-27.
- Химия. Справочное руководство. Пер. с нем. Л., Химия 1975, сс. 240—242.
- Химическая Энциклопедия в 5 томах. ред. И. Л. Кнунянц. 5 том.
- Кнунянц И. Л. (1988). „т.1 А-Дарзана”. Химическая энциклопедия. М.: Советская энциклопедия. стр. 623. Непознати параметар
|тираж=игнорисан (помоћ) - Сайкс П. Механизмы реакций в органической химии. М.: Химия. 1991
- Адамс М. Карбоновые кислоты в органике. М.: Химия. 1990
- Дж. Роберт, М.Касерио "Основы органической химии" т. 1 Издание 2-е, дополненное. 1978
- Кнунянц И. Л. (1988). „т.1 А-Дарзана”. Химическая энциклопедия. М.: Советская энциклопедия. стр. 623. Непознати параметар
|тираж=игнорисан (помоћ)
- Carl Schorlemmer: Ursprung und Entwicklung der organischen Chemie, Akademische Verlagsgesellschaft Geest & Portig, Leipzig, 1984.
- H. Hart, L.E. Craine, D. J. Hart, C. M. Hadad, N. Kindler: Organische Chemie. 3. izd. Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8.
- Kurt Peter C. Vollhardt i N.E. Schore: Organische Chemie. 4. izd, Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31380-8.
- Heinz A. Staab: Hundert Jahre organische Strukturchemie. Angewandte Chemie 70(2), str. 37–41 (1958), doi:10.1002/ange.19580700202
- Joachim Buddrus: Grundlagen der Organischen Chemie, Walter de Gruyter, Berlin – New York, 3. izd. 2003, ISBN 978-3-11-014683-7.
- Hartmut Laatsch: Die Technik der organischen Trennungsanalyse, Georg Thieme Verlag Stuttgart/New York 1988, ISBN 3-13-722801-8.
- dtv-atlas Chemie (Hans Breuer): Band 2: Organische Chemie und Kunststoffe, 9. izd. 2006, Deutscher Taschenbuch Verlag, ISBN 3-423-03218-9.
- R. L. Shriner, R. C. Fuson, D. Y. Curtin, T. C. Morrill: The Systematic Identification of Organic Compounds – a laboratory manual 6. izd., John Wiley & Sons New York/Chichester/Brisbane/Toronto 1980, ISBN 0-471-78874-0.
