Катализа — разлика између измена
м pravljenje sablona Cite book |
м pravljenje sablona Cite book |
||
| Ред 1: | Ред 1: | ||
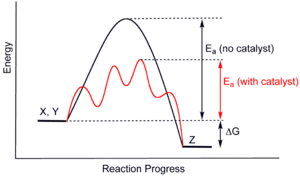
[[Датотека:CatalysisScheme.png|мини|300п| Дијаграм генерисане потенцијалне енергије који показује утицај катализатора на хипотетичку екзотермну реакцију]] |
[[Датотека:CatalysisScheme.png|мини|300п| Дијаграм генерисане потенцијалне енергије који показује утицај катализатора на хипотетичку екзотермну реакцију]] |
||
{{drugo značenje|automobilski "katalizator"|[[Katalitički konvertor]]}} |
{{drugo značenje|automobilski "katalizator"|[[Katalitički konvertor]]}} |
||
Катализатор је [[хемија|хемијска]] [[хемијска супстанца|супстанција]], која се додаје реакционом систему да би убрзала [[хемијска реакција|реакцију]].<ref>{{Cite book |title=Principles of Chemical Kinetics, Second Edition |last= House|first=James E.|publisher: Academic Press |edition=2. edition |year=September 13, 2007 |isbn=978-0-12-356787-1|pages=}}</ref><ref>{{Cite book |title=Chemical Kinetics and Dynamics |edition=2nd Edition |author1=Jeffrey I. Steinfeld |author2=Joseph S. Francisco |author3=William L. Hase |publisher=Prentice Hall |year=August 20, 1998 |isbn=978-0-13-737123-5|pages=}}</ref><ref>Masel, Richard I. “Chemical Kinetics and Catalysis” Wiley-Interscience, New York, |
Катализатор је [[хемија|хемијска]] [[хемијска супстанца|супстанција]], која се додаје реакционом систему да би убрзала [[хемијска реакција|реакцију]].<ref>{{Cite book |title=Principles of Chemical Kinetics, Second Edition |last= House|first=James E.|publisher: Academic Press |edition=2. edition |year=September 13, 2007 |isbn=978-0-12-356787-1|pages=}}</ref><ref>{{Cite book |title=Chemical Kinetics and Dynamics |edition=2nd Edition |author1=Jeffrey I. Steinfeld |author2=Joseph S. Francisco |author3=William L. Hase |publisher=Prentice Hall |year=August 20, 1998 |isbn=978-0-13-737123-5|pages=}}</ref><ref>Masel, Richard I. “Chemical Kinetics and Catalysis” Wiley-Interscience, New York,. {{page|year=2001|isbn=978-0-471-24197-3|pages=}}</ref> |
||
;Пример |
;Пример |
||
Верзија на датум 2. јун 2019. у 03:35
Катализатор је хемијска супстанција, која се додаје реакционом систему да би убрзала реакцију.[1][2][3]
- Пример
Реакција без катализатора:
- A + B --> AB
Реакција са катализатором:
- A + B + K --> [ABK]
- [ABK] --> AB + K
Механизам деловања катализатора је такав да он смањује енергију активације (енергију потребну довести споља систему да би дошло де реакције) градећи са реактантима прелазни комплекс (у датом примеру то би био нестабилни [ABK] комплекс) мањег енергетског садржаја него што је он за прелазни комплекс реактаната без везаног катализатора. Како је пут криве на одговарајућем енергетском дијаграму краћи и сама реакција је бржа иако ће енергија коначних производа бити иста за катализовану и за некатализовану реакцију.
Катализатор не утиче на положај повратне реакције, јер у истом степену убрзава реакцију у оба смера. Катализатор само убрзава постизање термодинамичке равнотеже. Катализатор може да повећа селективност реакције уколико убрзава стварање главног продукта, а не убрзава (или мање убрзава) споредне реакције. Иако учествује у хемијској реакцији, катализатор после завршене реакције остаје хемијки непромењен, али може доћи до физичке промене (нпр. промена агрегатног стања).
Посебно важна група катализатора су биокатализатори односно ензими које катализују биохемијске реакције у организмима. Ензими су посебно ефикасни катализатори специфичног дејства. То значи да делују на тачно одређену супстанцу (супстрат), катализујући тачно одређену реакцију коју убрзавају и неколико хиљада пута.
Тврдња која се јавља у неким школским уџбеницима да катализатор нема удео у хемијској реакцији је потпуно нетачна.
Извори
- ^ House, James E. (13. 9. 2007). Principles of Chemical Kinetics, Second Edition (2. edition изд.). ISBN 978-0-12-356787-1. Текст „publisher: Academic Press ” игнорисан (помоћ)
- ^ Jeffrey I. Steinfeld; Joseph S. Francisco; William L. Hase (20. 8. 1998). Chemical Kinetics and Dynamics (2nd Edition изд.). Prentice Hall. ISBN 978-0-13-737123-5.
- ^ Masel, Richard I. “Chemical Kinetics and Catalysis” Wiley-Interscience, New York,. 2001. ISBN 978-0-471-24197-3.
Литература
- House, James E. (13. 9. 2007). Principles of Chemical Kinetics, Second Edition (2. edition изд.). ISBN 978-0-12-356787-1. Текст „publisher: Academic Press ” игнорисан (помоћ)
- Jeffrey I. Steinfeld; Joseph S. Francisco; William L. Hase (20. 8. 1998). Chemical Kinetics and Dynamics (2nd Edition изд.). Prentice Hall. ISBN 978-0-13-737123-5.
