Бензалдехид
| |||
| Називи | |||
|---|---|---|---|
| Други називи
Фенилметанал
Бензенкарбоксалдехид Бензоински алдехид | |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.002.601 | ||
| КЕГГ[1] | |||
| УНИИ | |||
| |||
| Својства | |||
| C7H6O | |||
| Моларна маса | 106,12 g·mol−1 | ||
| Агрегатно стање | безбојна течност | ||
| Густина | 1,0415 g/ml, tečnost | ||
| Тачка топљења | −26°C | ||
| Тачка кључања | 178.1°C | ||
| 0.6 g/100 ml (20°C) | |||
| Вискозност | 1.4 cP (25°Ц) | ||
| Термохемија | |||
Стд енталпија
формирања (ΔfH⦵298) |
−36.8 kJ/mol | ||
| Стд енталпија сагоревања ΔcH |
−3525.1 kJ/mol | ||
| Опасности | |||
| Безбедност приликом руковања | J. T. Baker | ||
ЕУ класификација (ДСД)
|
Штетан (Xn) | ||
| R-oznake | R22 | ||
| S-oznake | (S2), S24 | ||
| NFPA 704 | |||
| Tačka paljenja | 63°C | ||
| Srodna jedinjenja | |||
Srodna jedinjenja
|
Benzil alkohol Benzojeva kiselina | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Референце инфокутије | |||
Бензалдехид (C6H5CHO) је органско једињење које се састоји од бензенског прстена са формил супституентом. Он је најједноставнији ароматични алдехид и један од најкориснијих у погледу индустријске примене. Ова безбојна течност има карактеристичан пријатан бадему сличан мирис. Бензалдехид је примарна компонента горког бадемовог уља и може се екстраховати из бројних других природних извора.[4]
Производња[уреди | уреди извор]
Бензалдехид се моше добити на више начина. Процењује се да је током 1980-тхи 18 милиона килограма произведено годишње у Јапану, Европи, и Северној Америци, и очекује се да ће се тај ниво производење наставити. Тренутно су хлоринација у течној фази и оксидација толуена главни начини добијања. Бројне друге методе су биле развијене, као што је парцијална оксидација бензил алкохола, алкална хидролиза бензал хлорида, и карбонилација бензена.[5]
Реакције[уреди | уреди извор]
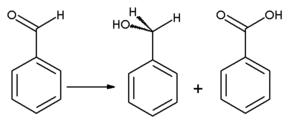
Оксидацијом се бензалдехид конвертује у безмирисну бензојеву киселину, која је честа нечистоћа у лабораторијским узорцима. Бензил алкохол се може формирати из бензалдехида хидрогенацијом. Реакција бензалдехида са безводним натријум ацетатом и ацетатним анхидридом производи цинаминску киселину, док се алкохолни калијум цијанид може користити за катализу кондензације бензалдехида у бензоин. Бензалдехид подлеже диспропорционацији при третману са концентрованим алкалијама (Канизарова реакција): један молекул алдехида се редукује у кореспондирајући алкохол, а други молекул се истовремено оксидује у натријум бензоат.
Употреба[уреди | уреди извор]
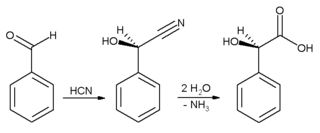
Он се често користи за давање бадемовог укуса. Бензалдехид се користи првенствено као прекурзор за друга органска једињење, од лекова до пластичних адитива. Анилинска боја малахитно зелено се припрема из бензалдехид и диметиланилина. Он је такође прекурзор појединих акридинских боја. Путем алдолне кондензације, бензалдехид се конвертује у деривате цинамалдехида и стирена. Синтеза манделинске киселине почиње од бензалдехида:
Прво се дода хидроцијанатна киселина бензалдехиду, и резултујући нитрил се накнадно хидролизује до манделинске киселине. Горња реакција приказује само један од два формирана енантиомера.
Референце[уреди | уреди извор]
- ^ Јоанне Wиxон; Доуглас Келл (2000). „Wебсите Ревиеw: Тхе Кyото Енцyцлопедиа оф Генес анд Геномес — КЕГГ”. Yеаст. 17 (1): 48—55. дои:10.1002/(СИЦИ)1097-0061(200004)17:1<48::АИД-YЕА2>3.0.ЦО;2-Х.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ „United States Patent 1416128 - Process of treating nut kernels to produce food ingredients.” (PDF).
- ^ Friedrich Brühne and Elaine Wright “Benzaldehyde” in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. . дои:10.1002/14356007.а03_463. Недостаје или је празан параметар
|титле=(помоћ)