Дужина хемијске везе
Дужина хемијске везе или дистанца везе у молекулској геометрији је просечно (физичко) растојање између језгара два везана атома у молекулу. Она је преносиви својство везе између повезаних атома, које је релативно независно од остатка молекула.
Опис[уреди | уреди извор]
Дужина везе се односи на ред везе: када у њеном формирању суделује више електрона, она је краћа. Дужина везе је такође обрнуто пропорционална снази везе и енергији дисоцијације веза: ако је све остало једнако, а јаче везе су краће. У вези између два идентична атома, половина њене дужине једнака је ковалентном радијусу.
Дужине везе се мере у чврстој фази помоћу дифракције X-зрака, или у гасовитој фази приближно се процењују помоћу микроталасне спектроскопије. Веза између одређеног пара атома може се разликовати између различитих молекула. На пример, угљеник у водоничној вези метана је другачији од оног у метил хлориду. Међутим, када је структура иста, могуће је направити и одређена уопштења.
Дужина везе угљеника с другим елементима[уреди | уреди извор]
Следи табела са експерименталним једноструким везама угљеника и других елемената. Дужине веза су дате у пикометрима (pm). При апроксимацији дужине веза између два различита атома узет је збир појединачних ковалентних радијуса (наведени су чланци за сваки хемијски елемент). Као општи тренд, дужина везе пада преко реда у периодном систему и повећава се испод група у систему. Овај тренд је идентичан оном код атомског радијуса.
| Везани елементи | Дужина везе (пм) |
Група |
| H | 106 - 112 | Група 1 |
| Be | 193 | Група 2 |
| Mg | 207 | Група 2 |
| B | 156 | Група13 |
| Al | 224 | Група 13 |
| In | 216 | Група 13 |
| C | 120 - 154 | Група 14 |
| Si | 186 | Група 14 |
| Sn | 214 | Група 14 |
| Pb | 229 | Група 14 |
| N | 147 - 210 | Група 15 |
| P | 187 | Група 15 |
| As | 198 | Група 15 |
| Sb | 220 | Група 15 |
| Bi | 230 | Група 15 |
| O | 143 - 215 | Група 16 |
| S | 181 - 255 | Група 16 |
| Cr | 192 | Група 16 |
| Se | 198 - 271 | Група 16 |
| Te | 205 | Група 16 |
| Mo | 208 | Група 16 |
| W | 206 | Група 16 |
| F | 134 | Група 17 |
| Cl | 176 | Група 17 |
| Br | 193 | Група 17 |
| I | 213 | Група 17 |
Дужине везе органских једињења[уреди | уреди извор]
Дужина везу између два атома у молекулу не зависи само од атома, већ и фактора као што су орбитална хибридизација и електронска и стерна природа супституента. У вези угљеник–угљеник (C-C) дужина у дијаманту је 154 pm, што је уједно и највећа дужина везе која постоји за обичне угљеникове ковалентне везе.
Постоје и неуобичајено дуге везе. У једињењу трициклобутабензену, дужина везе 160 pm. Садашњи рекордер је још један циклобутабензен, дужине 174 pm, на основу кристалографије X-зрацима. У овој врсти једињења са циклобутанским прстеном, величина углова од 90° на атому угљеника, повезана је са бензенским прстеном, где обично имају углове од 120°.[2] У овом типу једињења циклобутански прстен условљава углове од 90° на угљеничним атомима везаним за бензенски прстен где су углови обично 120°.
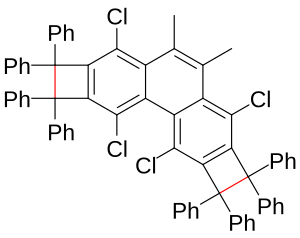
Сматра се да се веће дужине везе C-C веза, до 290 pm, јављају у димеру два тетрацијаноетиленска диањона, што се односи и на везе 2-електрон-4-центра.[3][4] Овај начин везања је такође уочен у димеру неутралног феналена. Дужина таквих веза[5] је до око 305 pm.
Могуће су и потпросечне дужине C-C везе: алкени и алкини имају дужине веза од 133 pm и 120 pm, због повећаног s-карактера сигма веза. У бензену, све везе имају исте дужине: 139 pm. У централној једнострукој угљеник–угљеник вези, такође је значајан пораст s-карактера диацетилена (137 pm), као и код одређених тетрахедранских димера (144 pm).
У пропионитрилу, цијано група повлачи електроне, што резултира смањењем дужине веза (144 pm). Најмања теоријска дужина једноструке C-C везе за тетраедранске деривате у овом истраживању је била 131 pm. Постоји необично органско једињење под називом лн-метилциклофан, са метил групом која је смештена између триптицена и фенил групе, а врло малом дужином веза, од 147 pm.[6] У ин силицо експериментима, нађене дужине хемијских веза су 136 pm, процењене за неопентан који је затворен у фулерену[7] У истим истраживањима, процењено је да истезање или сабијање C-C везе у молекулу етана за 5 pm одговара 2,8 или 3, 5 kJ/мола, а процена за 15 pm износи 21,9 или 37,7 kJ/mol.
| C–H | Дужина (pm) |
C–C | Дужина (pm) |
Вишеструке везе | Дужина (pm) |
| sp3–H | 110 | sp3–sp3 | 154 | Бензен | 140 |
| sp2–H | 109 | sp3–sp2 | 150 | Алкен | 134 |
| sp–H | 108 | sp2–sp2 | 147 | Алкин | 120 |
| sp3–sp | 146 | Ален | 130 | ||
| sp2–sp | 143 | ||||
| sp–sp | 137 |
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ Хандбоок оф Цхемистрy & Пхyсицс (65тх изд.). ЦРЦ Пресс. 1984. ИСБН 978-0-8493-0465-1.
- ^ Тода, Фумио (април 2000). „Напхтхоцyцлобутенес анд Бензодицyцлобутадиенес: Сyнтхесис ин тхе Солид Стате анд Аномалиес ин тхе Бонд Ленгтхс”. Еуропеан Јоурнал оф Органиц Цхемистрy. 2000 (8): 1377—1386. дои:10.1002/(СИЦИ)1099-0690(200004)2000:8<1377::АИД-ЕЈОЦ1377>3.0.ЦО;2-I. Архивирано из оригинала 29. 06. 2012. г. Приступљено 01. 03. 2018.
- ^ Новоа ЈЈ, Лафуенте П, Дел Сесто РЕ, Миллер ЈС (2. 7. 2001). „Еxцептионаллy Лонг (2.9 Å) C-C Бондс бетwеен [ТЦНЕ]- Ионс: Тwо-Елецтрон, Фоур-Центер *-* C-C Бондинг ин -[ТЦНЕ]22-”. Ангеwандте Цхемие Интернатионал Едитион. 40 (13): 2540—2545. дои:10.1002/1521-3773(20010702)40:13<2540::АИД-АНИЕ2540>3.0.ЦО;2-О. Архивирано из оригинала 29. 06. 2012. г. Приступљено 01. 03. 2018.
- ^ Лü ЈМ, Росокха СВ, Коцхи ЈК (2003). „Стабле (Лонг-Бондед) Димерс виа тхе Qуантитативе Селф-Ассоциатион оф Дифферент Цатиониц, Аниониц, анд Унцхаргед -Радицалс: Струцтурес, Енергетицс, анд Оптицал Транситионс”. Ј. Ам. Цхем. Соц. 125 (40): 12161—12171. дои:10.1021/ја0364928.
- ^ Сузуки С, Морита Y, Фукуи К, Сато К, Схиоми D, Такуи Т, Накасуји К (2006). „Ароматицитy он тхе Панцаке-Бондед Димер оф Неутрал Пхеналенyл Радицал ас Студиед бy МС анд НМР Спецтросцопиес анд НИЦС Аналyсис”. Ј. Ам. Цхем. Соц. 128 (8): 2530—2531. дои:10.1021/ја058387з.
- ^ Хунтлеy ДР, Маркопоулос Г, Донован ПМ, Сцотт ЛТ, Хоффманн Р (2005). „Сqуеезинг CC Бондс”. Ангеwандте Цхемие Интернатионал Едитион. 44 (46): 7549—7553. ПМИД 16259033. дои:10.1002/ание.200502721.
- ^ Мартинез-Гуајардо Г, Доналд КЈ, Wиттмаацк БК, Вазqуез МА, Мерино Г (2010). „Схортер Стилл: Цомпресинг C-C Сингле Бондс”. Органиц Леттерс, АСАП. 12 (18): 4058. дои:10.1021/ол101671м.
- ^ Фоx МА, Wхитеселл ЈК (1995). Органисцхе Цхемие: Грундлаген, Мецханисмен, Биоорганисцхе Анwендунген. Спрингер. ИСБН 978-3-86025-249-9.
- ^ Проф Цхао-Јун Ли, Пх.D. ин лецтуре, Марцх 2009}}
Литература[уреди | уреди извор]
- Фоx МА, Wхитеселл ЈК (1995). Органисцхе Цхемие: Грундлаген, Мецханисмен, Биоорганисцхе Анwендунген. Спрингер. ИСБН 978-3-86025-249-9.
- Хандбоок оф Цхемистрy & Пхyсицс (65тх изд.). ЦРЦ Пресс. 1984. ИСБН 978-0-8493-0465-1.
