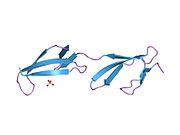
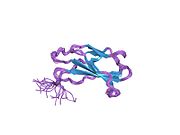
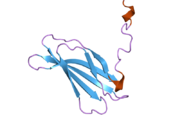
Фибронектин
Фибронектин је гликопротеин екстрацелуларног матрикса високе молекулске тежине који се везује за протеинске рецепторе интегрине који премоштавају мембране.[1] Поред интегрина, фибронектин се исто везује за компоненте екстрацелуларног матрикса као што су колаген[2], фибрин и хепаран сулфате протеоглукани (е.г. синдекани). Фибронектин протеин је кодиран једним геном, али алтернативно сплајсовање његове пре-иРНК доводи до креирања неколико протеинских изоформи.
Две врсте фибронектина су присутне у кичмењацима:[1]
- растворљиви плазма фибронектин (раније познат као хладно-нерастворљиви глобулин, или Цлг) је једна од главних протеинских компоненти крвне плазме (300 μg/ml). Он се још производи у јетри и у хепатоцитима.
- нерастворљиви ћелијски фибронектин је значајна компонента екстрацелуларног матрикса. Она се излучује ис различитих ћелија, а примарно из фибробласта, као растворљиви димер, и потом се сакупља као нерастворни екстрацелуларни матрикс у комплексном ћелијски-посредованим процесу.
Фибронектин игра важну улогу у ћелијској адхезији, миграцији, и диференцијацији. Он је важан у процесима зарастања рана и ембрионског развоја.[1] Неправилно експресија, дегенерација, и организација фибронектин гена су били повезани са бројним патолошким околностима, укључујући рак и фиброзу.[3]
Структура[уреди | уреди извор]
Фибронектин постоји као димер, који се састоји од два скоро идентична мономера повезаних паром дисулфидних веза.[1][4] Сваки фибронектински мономер има молекулску тежину од 230-250 кДа, и садржи три типа протеинских модула: тип I, II, и III. Сва три модула се састоје оф две антипаралелне β-плоче; међутим, тип I и тип II су стабилизовани интра-ланчаним дисулфидним мостовима, док тип III модул не садржи дисулфидне мостове. Одсуство дисулфидних интра-ланаца у типу III модулима дозвољава им да се делимично развију под утицајем силе.[5]
Три региона променљивог РНК сједињавања се јављају дуж фибронектин мономера.[4] Један или оба "екстра" типа III модула (ЕИИИА и ЕИИИБ) могу бити присутна у ћелијском фибронектину, али они нису никад присутни у фибронектину из крвне плазме. Променљиви V-регион постоји између III14-15 (14тог и 15тог типа III модула). V-регион структуре је различит оф типа I, II, и III модула, а његово присуство и дужина могу варирати. V-регион садржи везујуће место за α4β1 интегрине. Оно је присутно у већини ћелијских фибронектина, али само једна оф две под-јединице фибронектин димера плазме садржи V-регион секвенцу.
Модули су аранжирани у неколико функционалних и протеин-везујућих домена дуж фибронектин мономера. Постоје четири фибронектин-везујућа домена, што дозвољава фибронектину да се асоцира са другим фибронектин молекулима.[4] Један оф тих фибронектин-везујућих домена, I1-5, се назива "саборни домен", и он је неопходан за иницијацију фибронектин матрикс конструкције. Модули III9-10 су "ћелијски везујући домени" фибронектина. РГД секвенца (Arg-Gly-Asp) је лоцирана III10 и оне је место ћелијског припајања путем αВβ1 и αВβ3 интегрина на ћелијској површини. "Место сједињавања" је на III9 и има улогу у модулацији фибронектинове асоцијације са αВβ1 интегринима.[6] Фибронектин исто садржи домене за фибрин-везивање (I1-5, I10-12), колаген-везивање (I6-9), фибулин-1-везивање (III13-14), и синдекан-везивање (III12-14).[4]

Функција[уреди | уреди извор]
Фибронектин има бројне функције које осигуравају нормално функционисање кичмењачких организама.[1] Он је посредује ћелијску адхезију, раст, миграцију и диференцијацију. Ћелијски фибронектин је конструисан у екстра-ћелијском матриксу, једној нерастворној мрежи која одваја и подржава органе и ткива организма.
Фибронектин игра пресудну улогу у лечењу рана.[7] Заједно са фибрином, плазма фибронектин се депонује на месту повреде, формирајући крвну грудву која зауставља крварење и заштићује потпорно ткиво. Док се поправка ткива наставља, фибробласти и макрофаге почињу да преуређују површину, деградирајући протеине који формирају привремени матрикс крвне грудве и замењујући их са матриксом који више подсећа нормалном окружујећем ткиву. Фибробласти излучују протеазе, укључујући матрикс металопротеазе, које сварују фибронектин ис плазме, и потом фибробласти излучују ћелијски фибронектин и склапају га у нерастворни матрикс. Фрагментација фибронектина протеазама је била предложена да промовише контракцију ране, што је критичан корак у зарастању ране. Фрагментација фибронектина исто тако излаже његов V-регион, који садржи место за везивање α4β1 интегрина. Ти фрагменти фибронектина се верује да увећавају везивање ћелија које изражавају α4β1 интегрин, што им дозвољава да се приљубе и контрактују окружујући матрикс.
Фибронектин је неопходан за ембриогенезу, и инактивирање гена фибронектина узрокује рану ембрионску леталност.[8] Фибронектин је важан у управљању ћелијском адхезијом и миграцијом у току ембрионског развоја. У развоју сисара, одсуство фибронектина доводи до дефеката мезодерма, и нервне цеви, и васкуларног развоја.
Фибронектин се исто налази у нормалној људског пљувачки, што помаже спречавању колонизације усне шупљине и грла потенцијално патогеним бактеријама.[9]
Матрикс конструкција[уреди | уреди извор]
Ћелијски фибронектин формира нерастворни фибриларни матрикс у комплексном ћелијски-поседованом процесу.[10] Формирање фибронектин матрикса почиње кад се растворљиви, компактни фибронектин димери излуче ис ћелија, обично фибробласта. Ти растворљиви димери се вежу за α5β1 интегрин рецепторе на ћелијској површини и помажу у груписању интегрина. Локална концентрација интегрин-везаног фибронектина се повећава, дозвољавајући везаним фибронектин молекулима да лакше узајамно делују. У даљем прогресу формирања фибронектина, растворљиви филаменти се претварају у веће нерастворне филаменте који сачињавају екстра ћелијски матрикс.
Промена фибронектина од растворне у нерастворне филаменте се одвија кад су прикривена фибронектин-везујућа места изложена дуж везаних фибронектин молекула. Верује се да ћелије растежу фибронектин повлачењем њихових фибронектин-везаних интегрин рецепторима. Та сила делимично развија фибронектин лиганд, откривајући скривена фибронектин-везујућа места и дозвољавајући оближњим фибронектин молекулима да се вежу. Та фибронектин-фибронектин интеракција омогућава растворљивом, ћелијски-асоцираним филаментима да се гранају и стабилизују у нерастворни фибронектин матрикс.
Улога у раку[уреди | уреди извор]
Неколико морфолошких промена примећених у туморима и тумор-изведеним ћелијским линијама је приписано смањеној фибронектин експресији, повећаној фибронектин деградацији, и смањеној експресији фибронектин-везујућег рецептора, као што су α5β1 интегрини.[11] Фибронектин је имплициран у развоју карцинома.[12] У карциному плућима, фибронектин експресија је повећана, посебно у плућном карциному не-малих ћелија.
Интеракције[уреди | уреди извор]
Показано је да фибронектин ступа у интеракције са колагеном, тип VII, алфа 1,[13][14] ТРИБ3,[15] липопротеином (а),[16] Тенасцин C,[17] ЦД44[18] и ИГФБП3.[19][20]
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ а б в г д Панков Р, Yамада КМ (2002). „Фибронецтин ат а гланце”. Јоурнал оф целл сциенце. 115 (Пт 20): 3861—3. ПМИД 12244123. дои:10.1242/јцс.00059.
- ^ Доналд Воет; Јудитх Г. Воет (2005). Биоцхемистрy (3 изд.). Wилеy. стр. 233—240. ИСБН 9780471193500.
- ^ Wиллиамс CM, Енглер АЈ, Слоне РД, Галанте ЛЛ, Сцхwарзбауер ЈЕ (2008). „Фибронецтин еxпрессион модулатес маммарy епитхелиал целл пролифератион дуринг ацинар дифферентиатион”. Цанцер ресеарцх. 68 (9): 3185—92. ПМЦ 2748963
 . ПМИД 18451144. дои:10.1158/0008-5472.ЦАН-07-2673.
. ПМИД 18451144. дои:10.1158/0008-5472.ЦАН-07-2673.
- ^ а б в г Мао Y, Сцхwарзбауер ЈЕ (2005). „Фибронецтин фибриллогенесис, а целл-медиатед матриx ассемблy процесс”. Матриx биологy : јоурнал оф тхе Интернатионал Социетy фор Матриx Биологy. 24 (6): 389—99. ПМИД 16061370. дои:10.1016/ј.матбио.2005.06.008.
- ^ Ерицксон, Х. П. (2002). „Стретцхинг фибронецтин”. Јоурнал оф мусцле ресеарцх анд целл мотилитy. 23 (5-6): 575—80. ПМИД 12785106. дои:10.1023/А:1023427026818.
- ^ Сецхлер ЈЛ, Цорбетт СА, Сцхwарзбауер ЈЕ (1997). „Модулаторy ролес фор интегрин ацтиватион анд тхе сyнергy сите оф фибронецтин дуринг матриx ассемблy”. Молецулар биологy оф тхе целл. 8 (12): 2563—73. ПМЦ 25728
 . ПМИД 9398676.
. ПМИД 9398676.
- ^ Валеницк LV, Хсиа ХЦ, Сцхwарзбауер ЈЕ (2005). „Фибронецтин фрагментатион промотес алпха4бета1 интегрин-медиатед цонтрацтион оф а фибрин-фибронецтин провисионал матриx”. Еxпериментал целл ресеарцх. 309 (1): 48—55. ПМИД 15992798. дои:10.1016/ј.yеxцр.2005.05.024.
- ^ Георге ЕЛ, Георгес-Лабоуессе ЕН, Пател-Кинг РС, Раyбурн Х, Хyнес РО (1993). „Дефецтс ин месодерм, неурал тубе анд васцулар девелопмент ин моусе ембрyос лацкинг фибронецтин”. Девелопмент (Цамбридге, Енгланд). 119 (4): 1079—91. ПМИД 8306876.
- ^ Хастy DL, Симпсон WА (1987). „Еффецтс оф фибронецтин анд отхер саливарy мацромолецулес он тхе адхеренце оф Есцхерицхиа цоли то буццал епитхелиал целлс”. Инфецтион анд иммунитy. 55 (9): 2103—9. ПМЦ 260663
 . ПМИД 3305363. Архивирано из оригинала 08. 03. 2009. г. Приступљено 13. 03. 2010.
. ПМИД 3305363. Архивирано из оригинала 08. 03. 2009. г. Приступљено 13. 03. 2010.
- ^ Wиерзбицка-Патyноwски I, Сцхwарзбауер ЈЕ (2003). „Тхе инс анд оутс оф фибронецтин матриx ассемблy”. Јоурнал оф целл сциенце. 116 (Пт 16): 3269—76. ПМИД 12857786. дои:10.1242/јцс.00670.
- ^ Хyнес, Рицхард О. (1990). Фибронецтинс. Берлин: Спрингер-Верлаг. ИСБН 978-0-387-97050-9.
- ^ Хан С, Кхури ФР, Роман Ј (2006). „Фибронецтин стимулатес нон-смалл целл лунг царцинома целл гроwтх тхроугх ацтиватион оф Акт/маммалиан таргет оф рапамyцин/С6 кинасе анд инацтиватион оф ЛКБ1/АМП-ацтиватед протеин кинасе сигнал патхwаyс”. Цанцер ресеарцх. 66 (1): 315—23. ПМИД 16397245. дои:10.1158/0008-5472.ЦАН-05-2367.
- ^ Лапиере ЈЦ, Цхен ЈД, Иwасаки Т, Ху L, Уитто Ј, Wоодлеy ДТ (1994). „Тyпе VII цоллаген специфицаллy биндс фибронецтин виа а униqуе субдомаин wитхин тхе цоллагеноус трипле хелиx”. Ј. Инвест. Дерматол. УНИТЕД СТАТЕС. 103 (5): 637—41. ИССН 0022-202X. ПМИД 7963647. дои:10.1111/1523-1747.еп12398270.
- ^ Цхен M, Маринковицх МП, Веис А, Цаи X, Рао ЦН, О'Тооле ЕА, Wоодлеy ДТ (1997). „Интерацтионс оф тхе амино-терминал нонцоллагеноус (НЦ1) домаин оф тyпе VII цоллаген wитх еxтрацеллулар матриx цомпонентс. А потентиал роле ин епидермал-дермал адхеренце ин хуман скин”. Ј. Биол. Цхем. УНИТЕД СТАТЕС. 272 (23): 14516—22. ИССН 0021-9258. ПМИД 9169408. дои:10.1074/јбц.272.23.14516.
- ^ Зхоу, Yинг; Лу, Ли; et al. (2008). „Е3 убиqуитин лигасе СИАХ1 медиатес убиqуитинатион анд деградатион оф ТРБ3”. Целл. Сигнал. Енгланд. 20 (5): 942—8. ИССН 0898-6568. ПМИД 18276110. дои:10.1016/ј.целлсиг.2008.01.010.
- ^ Салонен, Е M; Јаухиаинен, M.; et al. (1989). „Липопротеин(а) биндс то фибронецтин анд хас серине протеинасе ацтивитy цапабле оф цлеавинг ит”. ЕМБО Ј. ЕНГЛАНД. 8 (13): 4035—40. ИССН 0261-4189. ПМЦ 401578
 . ПМИД 2531657.
. ПМИД 2531657.
- ^ Цхунг, C Y; Зарди, L.; Ерицксон Х П (1995). „Биндинг оф тенасцин-C то солубле фибронецтин анд матриx фибрилс”. Ј. Биол. Цхем. УНИТЕД СТАТЕС. 270 (48): 29012—7. ИССН 0021-9258. ПМИД 7499434. дои:10.1074/јбц.270.48.29012.
- ^ Јалканен, С; Јалканен, M. (1992). „Лyмпхоцyте ЦД44 биндс тхе ЦООХ-терминал хепарин-биндинг домаин оф фибронецтин”. Ј. Целл Биол. УНИТЕД СТАТЕС. 116 (3): 817—25. ИССН 0021-9525. ПМЦ 2289325
 . ПМИД 1730778. дои:10.1083/јцб.116.3.817.
. ПМИД 1730778. дои:10.1083/јцб.116.3.817.
- ^ Мартин, Ј А; Миллер Б А; et al. (2002). „Цо-лоцализатион оф инсулин-лике гроwтх фацтор биндинг протеин 3 анд фибронецтин ин хуман артицулар цартилаге”. Остеоартхр. Цартил. Енгланд. 10 (7): 556—63. ИССН 1063-4584. ПМИД 12127836. дои:10.1053/јоца.2002.0791.
- ^ Гуи, Y; Мурпхy L Ј (2001). „Инсулин-лике гроwтх фацтор (ИГФ)-биндинг протеин-3 (ИГФБП-3) биндс то фибронецтин (ФН): демонстратион оф ИГФ-I/ИГФБП-3/фн тернарy цомплеxес ин хуман пласма”. Ј. Цлин. Ендоцринол. Метаб. Унитед Статес. 86 (5): 2104—10. ИССН 0021-972X. ПМИД 11344214. дои:10.1210/јц.86.5.2104.
Литература[уреди | уреди извор]
Додатни извори[уреди | уреди извор]
- ффренцх-Цонстант C (1996). „Алтернативе сплицинг оф фибронецтин--манy дифферент протеинс бут феw дифферент фунцтионс.”. Еxп. Целл Рес. 221 (2): 261—71. ПМИД 7493623. дои:10.1006/еxцр.1995.1374.
- Снáсел Ј, Пицховá I (1997). „Тхе цлеаваге оф хост целл протеинс бy ХИВ-1 протеасе.”. Фолиа Биол. (Праха). 42 (5): 227—30. ПМИД 8997639. дои:10.1007/БФ02818986.
- Сцхор СЛ, Сцхор АМ (2003). „Пхенотyпиц анд генетиц алтератионс ин маммарy строма: имплицатионс фор тумоур прогрессион.”. Бреаст Цанцер Рес. 3 (6): 373—9. ПМЦ 138703
 . ПМИД 11737888. дои:10.1186/бцр325.
. ПМИД 11737888. дои:10.1186/бцр325. - Прзyбyсз M, Катник-Прастоwска I (2002). „[Мултифунцтион оф фибронецтин]” [Мултифунцтион оф фибронецтин]. Постȩпy хигиенy и медyцyнy доśwиадцзалнеј (на језику: Полисх). 55 (5): 699—713. ПМИД 11795204.
- Рамесхwар, П.; Ох, Х. С.; Yоок, C.; et al. (2003). „Субстанце п-фибронецтин-цyтокине интерацтионс ин мyелопролиферативе дисордерс wитх боне марроw фибросис.”. Ацта Хаематол. 109 (1): 1—10. ПМИД 12486316. дои:10.1159/000067268.
- Цхо Ј, Мосхер ДФ (2006). „Роле оф фибронецтин ассемблy ин плателет тхромбус форматион.”. Ј. Тхромб. Хаемост. 4 (7): 1461—9. ПМИД 16839338. дои:10.1111/ј.1538-7836.2006.01943.x.
- Сцхмидт ДР, Као WЈ (2007). „Тхе интеррелатед роле оф фибронецтин анд интерлеукин-1 ин биоматериал-модулатед мацропхаге фунцтион.”. Биоматериалс. 28 (3): 371—82. ПМИД 16978691. дои:10.1016/ј.биоматериалс.2006.08.041.
- Даллас СЛ, Цхен Q, Сивакумар П (2006). „Дyнамицс оф ассемблy анд реорганизатион оф еxтрацеллулар матриx протеинс.”. Цурр. Топ. Дев. Биол. 75: 1—24. ПМИД 16984808. дои:10.1016/С0070-2153(06)75001-3.
- Хyнес, Рицхард О. (1990). Фибронецтинс. Берлин: Спрингер-Верлаг.
Спољашње везе[уреди | уреди извор]
- [3]
- Фибронектин протеин
- Фибронецтин на US National Library of Medicine Medical Subject Headings (MeSH)
- Молекулске интеракције фибронектина
![]() Медији везани за чланак Фибронектин на Викимедијиној остави
Медији везани за чланак Фибронектин на Викимедијиној остави