Радикал (хемија)

Радикали (слободни радикали) су атоми, молекули, или јони са неспареним електронима у спољашњој љуски.[1][2][3] Слободни радикали могу да буду позитивни, негативни, или без наелектрисања. Неспарени електрони дају радикалима хемијску реактивност. Сматра се да су слободни радикали у телу један од узрока дегенеративних болести, старења и канцера.
Слободни радикали су значајни за сагоревање, атмосферску хемију, полимеризацију, хемију плазме, биохемију, и многе друге хемијске процесе. У хемијској биологији, супероксид и азот-моноксид регулишу мноштво процеса, као што је контрола васкуларног тона. Радикали могу да буду и гласници посредством феномена званог редокс сигнализација. Радикал може да буде заробљен унутар кавеза растварача, или да буду на неки други начин везани.
Хемијске реакције[уреди | уреди извор]
У хемијским једначинама, слободни радикали се често означавају тачком стављеном непосредно иза симбола атома:
- Гасовити хлор се може разложити ултравиолетном светлошћу чиме се формирају радикали хлора.
Реакциони механизми радикала користе једнострану стрелу за приказивање кретања електрона:

Хомолитичко раскидање везе се приказује стрелом која наликује куки за рибу, да би се направила разлика од уобичајеног кретања два електрона, што се приказује стандардном закривљеном стрелом. Треба напоменути да се други електрон раскидајуће везе такође помера да формира пар са нападујићем електроном радикала; то није експлицитно приказано у овом случају.
Слободни радикали узимају учешћа у адицији и супституцији радикала као реактивни интермедијари. Ланчане реакције у којима учествују слободни радикали се обично деле у три процеса.
- Реакције иницијације резултују у повећању броја слободних радикала.
- Реакције пропагације су реакције у којима се тотални број слободних радикала не мења.
- Реакције терминације доводе до умањења броја слободних радикала. Типично два слободна радикала формирају стабилније врсте, нпр.: 2Cl·→ Cl2
Настајање[уреди | уреди извор]

Радикали настају деловањем:
- високе температуре (термолитичко распадање веза)
- ултраљубичастог зрачења, које делује тако што се ковалентне везе хомолитички распадају (фотолиза)
- рендгенским и другим јонизујућим зрачењем
- електрохемијски путем оксидације односно редукције
За иницирање реакције радикализације при хемијским синтезама често се у реакциону смесу додаје „стартер радикал”. При томе се ради о молекулу који се нарочито лахко цепа на радикале, на пример када се осветли ултраљубичастим светлом. Примери таквих једињења су: азобисизобутиронитрил, дибензоилпероксид, дилауроилпероксид, ди-терт-бутилпероксид, диизопропилпероксидикарбонат и калијум пероксодисулфат.[4]

Радикали су или (1) настали од спин-упарених молекула или (2) од других радикала. Радикали настају од спин-упарених молекула хомолизом слабих веза или преносом електрона, такође познатим као редукција. Радикали настају од осталих радикала реакцијама супституције, адиције и елиминације.
Формирање радикала од спин-упарених молекула[уреди | уреди извор]
Хомолиза[уреди | уреди извор]

Хомолиза ствара два нова радикала од спин-упареног молекула раскидајући ковалентну везу, остављајући сваки од фрагмената са једним од електрона у вези.[5] Будући да је за прекид хемијске везе потребна енергија, хомолиза се јавља при додатку топлоте или светлости. Енергија дисоцијације веза повезана са хомолизом зависи од стабилности датог једињења, и неке слабе везе могу да се хомолизују на релативно нижим температурама.
Неке реакције хомолизе су посебно важне јер служе као иницијатор за друге реакције радикала. Један такав пример је хомолиза халогена, која се јавља под светлошћу и служи као покретачка снага реакција радикалне халогенизације.
Још једна запажена реакција је хомолиза дибензоил пероксида, која резултира стварањем два бензоилокси радикала и делује као иницијатор многих радикалних реакција.[6]
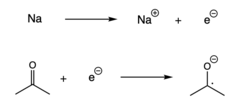
Редукција[уреди | уреди извор]
Радикали се такође могу формирати када се један електрон дода спин-упарени молекул, што резултира преносом електрона.[7] Ова реакција, која се назива и редукција, обично се одвија када алкални метал донира електрон другом спин-упареном молекулу.
Формирање радикала од других радикала[уреди | уреди извор]
Апстрајција[уреди | уреди извор]


Апстракција водоника описује реакцију у којој се атом водоника са својим једним електроном уклања са водоник донирајућег молекулом (нпр. калај или силицијум хидрид).[8] Апстракција производи нови радикал и нови спин-упарени молекул. Ово се разликује од хомолизе, која резултира у два радикала из једног спин-упареног молекула и не укључује радикал као реактант. Водонична апстракција је фундаментални процес у хемији радикала, јер служи као завршни корак ширења у многим хемијским реакцијама, претварајући радикале угљеника у стабилне молекуле. Слика десно приказује апстракцију радикала између бензоилокси радикала и молекула водоник бромида, што резултира производњом молекула бензојеве киселине и радика брома.
Адиција[уреди | уреди извор]
Радикална адиција описује реакцију када се радикалу дода спин-упарени молекул да би се формирао нови радикал.[9] Слика десно приказује додавање радикла брома у алкен. Радикално додавање следи антимарковниковљево правило, где се супституент додаје мање супституисаном атому угљеника.
Елиминација[уреди | уреди извор]

Елиминација радикала се може посматрати као реверзна радикалној адицији. У елиминацији радикала, нестабилно радикално једињење се распада у спин-упарени молекул и ново радикално једињење. Испод је приказан пример реакције елиминације радикала, где се бензоилокси радикал распада на фенилни радикал и молекул угљен диоксида.[10]
Реактивност[уреди | уреди извор]
Реактивни радикали[уреди | уреди извор]
Већина радикала реагује егзергоно. Они су изразито реактивни и као такви врло кратко „живе” (краће од једне секунде). Неупарени електрони обично се при том налазе на атомима угљеника, азота, кисеоника и живе или на халогеним елементима.
Нереактивни радикали[уреди | уреди извор]

Познати су такође и радикали који не реагују одмах при настанку те могу постојати током одређеног временског периода па чак се могу и изоловати као засебне супстанце. Један од таквих „стабилних” радикала јесте трифенилметил радикал. Као и други нереактивни радикали, и он се са својим димером у раствору налази у равнотежи. Димер трифенилметил радикала није хексафенилетан, као што је Гомберг мислио,[11] већ 3-дифенилметилен-6-трифенилметил-циклохекса-1,4-диен.[12] Фактори који воде до стабилних радикала су, према неким теоријама резонантна стабилизација (мезомерија), а према другим „застој” у димеризацији, на пример путем стеричних, софистицираних супституената. Стабилни радикали пронађени су и у природи. Тако на пример ензим рибонуклеотидредуктаза садржи тирозил радикал чије време полураспада износи око четири дана.
Угљеникови радикали[уреди | уреди извор]
Радикали у чијем средишту се налази атом угљеника показују повећање стабилности следећим редом: примарни C атом < секундарни < терцијарни, што је последица индуктивног ефекта и хиперкоњугације. Осим тога угљеников радикал са sp³ хибридизованом орбиталом стабилни је од радикалног центра, у којем је угљеник исказује sp² или sp хибридизацију. Арил или алил групе такође стабилизују радикале.
Примери[уреди | уреди извор]
- Молекуларни кисеоник O2 – ова молекула кисеоника садржи два неспарена електрона (бирадикал •O-O•; према Луисовој формули O=O даје ситуацију везивања која није потпуна нити је у потпуности тачна) а настаје у магнетном пољу као парамагнетни триплет. Иако су могућности реаговања овог бирадикала ограничене, јер по принципу одржања спина при хемијским реакцијама у већини случајева је потребно да се претходно побуде до синглета кисеоника.
- Азот моноксид •NO – радикал познат као супстанца за пренос сигнала у организму. Азот моноксид је саставни део нитрозних гасова.
- Хидроксил радикал •OH – један од најреактивнијих и најзначајнијих радикала у атмосфери (важан при разградњи супстанци које загађују атмосферу)
- Радикали хлора Cl• – настају хомолитичким распадом везе између два атома у молекуларном хлору (Cl2) и веома су реактивни међупроизвод при фотохлорисању алкана као и хлорисању бочних ланаца ароматских једињења са супституисаним алкил групама. Ови радикали се отпуштају и деловањем светлости на хлорофлуороугљенике и учествују у разарању озонског омотача.
- Радикали брома Br• – настају хомолитичким распадом веза између два атома у молекуларном брому (Br2) и веома су реактивни међупроизвод при фотобромирању алкана као и бромирању бочних ланаца ароматских једињења са супституисаним алкил групама
- ТЕМПО – стабилни органски радикал, који се између осталог користи и као оксидационо средство
У биологији[уреди | уреди извор]
Радикали, тачније реактиве врсте кисеоника, играју важну улогу у бројним биолошким процесима, а неки од њих могу и изазвати оштећења ћелија, што између осталог може довести и до развоја канцерогених обољења. Оксидативни процеси разних супстанци у организму, који се одвијају под утицајем слободних радикала, по многим мишљењима одговорни су за настанак артеросклерозе, Алцхајмерове болести, оштећења јетре изазване уносом алкохола у организам као и емфизем због кориштења дуванских производа. Од унутарћелијских сигналних путева, који се активирају слободним радикалима, сигнални пут НФ-κБ је један од најзначајнијих.
Заштита од деловања радикала је од животне важности за организам, па због тога тело садржи врло ефикасне одбрамбене механизме и механизме које му омогућавају поправак у облику ензима, хормона и других супстанци, које умањују и спречавају штетно деловање радикала. Међу тим одбрамбеним механизмима су антиоксиданси попут епигалокатехин галата, супероксид дисмутазе, витамина А, C и Е; коензима Q10; флавоноида попут таксифолина[13] и антоцијанина. Осим ових, сматра се да билирубин и мокраћна киселина такође могу неутрализовати слободне радикале. Хормон мелатонин важи за супстанцу која „хвата” радикале одговорне за оксидативни стрес. Један од најснажнијих познатих антиоксиданса, хидридни јон H−, игра важну улогу у циклусу лимунске киселине као и у многим метаболичким редокс-реакцијама.
У оквирима „теорије старења”, слободни радикали играју улогу у процесима старења организма. Према тој теорији,[14] радикали се проучавају као делујуће супстанце против оксидативног стреса „одговорног” за старење. Истраживања су показала да су ћелије птица значајно отпорније на деловање слободних радикала. Међутим, пошто је проучаван само утицај синтетичких антиоксиданаса, не би требало изводити закључке о могућим ефектима конзумирања воћа и поврћа. Године 2007. уредништво Журнала Америчког медицинског друштва (АМА) позвало је на даљња испитивања деловања радикала како би се утврдили ефекти витамина C и селена на старење.[15] Веома детаљна и неколико пута ажурирана анализа британског удружења Кокран (2007–2012) могла би пружити коначан доказ да нема позитивних ефеката прехрамбених додатака (суплемената) који садрже витамин C; чак супротно, смртност у проучаваној групи особа била је незнатно већа од смртности контролне групе.[16]
Референце[уреди | уреди извор]
- ^ Цлаyден, Јонатхан; Греевес, Ницк; Wаррен, Стуарт; Wотхерс, Петер (2001). Органиц Цхемистрy (I изд.). Оxфорд Университy Пресс. ИСБН 978-0-19-850346-0.
- ^ Моррисон Роберт Тхорнтон; Боyд Роберт Неилсон (2006). Органиц цхемистрy. Енгелwоод Цлиффс, Неw Јерсеy: Прентице Халл. ИСБН 8120307658.
- ^ Смитх, Мицхаел Б.; Марцх, Јеррy (2007). Адванцед Органиц Цхемистрy: Реацтионс, Мецханисмс, анд Струцтуре (6тх изд.). Неw Yорк: Wилеy-Интерсциенце. ИСБН 0-471-72091-7.
- ^ M. D. Лецхнер; К. Гехрке; Е. Х. Нордмеиер (2009). Макромолекуларе Цхемие (на језику: немачки) (4 изд.). Биркхäусер Верлаг. стр. 54. ИСБН 978-3-7643-8890-4.
- ^ Цлаyден, Јонатхан. (2012). Органиц цхемистрy. Греевес, Ницк., Wаррен, Стуарт Г. (2нд изд.). Оxфорд: Оxфорд Университy Пресс. ИСБН 978-0-19-927029-3. ОЦЛЦ 761379371.
- ^ „Диацyл Пероxидес”. полyмердатабасе.цом. Приступљено 2020-12-08.
- ^ „ИВ. Нонцхаин Реацтионс: Радицал Форматион бy Елецтрон Трансфер”. Цхемистрy ЛибреТеxтс (на језику: енглески). 2015-01-21. Приступљено 2020-12-08.
- ^ „ИИ. Атом Абстрацтион”. Цхемистрy ЛибреТеxтс (на језику: енглески). 2015-01-11. Приступљено 2020-12-08.
- ^ „Радицал Аддитионс: Анти-Марковников Продуцт Форматион”. Цхемистрy ЛибреТеxтс (на језику: енглески). 2013-10-02. Приступљено 2020-12-08.
- ^ Су, Wеи-Фанг (2013), Су, Wеи-Фанг, ур., „Радицал Цхаин Полyмеризатион”, Принциплес оф Полyмер Десигн анд Сyнтхесис, Лецтуре Нотес ин Цхемистрy (на језику: енглески), Берлин, Хеиделберг: Спрингер, 82, стр. 137—183, ИСБН 978-3-642-38730-2, дои:10.1007/978-3-642-38730-2_7

- ^ Гомберг M. (1. 7. 1901). „Он Тривалент Царбон.”. Јоурнал оф тхе Америцан Цхемицал Социетy (на језику: енглески). 23 (7): 496—502. дои:10.1021/ја02033а015.
- ^ Сиегфриед Хауптманн (1985). Органисцхе Цхемие (2 изд.). Леипзиг: ВЕБ Деутсцхер Верлаг фüр Грундстоффиндустрие. стр. 281. ИСБН 3-342-00280-8.
- ^ Yу. А. Владимиров; Е. V. Проскурнина; Е. M. Демин; Н. С. Матвеева; О. Б. Лубитскиy; А. А. Новиков; D. Yу. Измаилов; А. Н. Осипов; V. П. Тикхонов; V. Е. Каган (2009). „Дихyдроqуерцетин (таxифолин) анд отхер флавоноидс ас инхибиторс оф фрее радицал форматион ат кеy стагес оф апоптосис”. Биоцхемистрy (Москва). 74 (3): 301—307. ПМИД 19364325. дои:10.1134/С0006297909030092.
- ^ Кеннетх Б. Бецкманн; Бруце Н. Амес (1. 4. 1998). „Тхе Фрее Радицал Тхеорy оф Агинг Матурес”. Пхyс. Рев. 78 (2): 547—581. дои:10.1152/пхyсрев.1998.78.2.547.
- ^ Горан Бјелаковиц; Димитринка Николова; Лисе Лотте Глууд; Роса Г. Симонетти; Цхристиан Глууд (28. 1. 2007). „Морталитy ин Рандомизед Триалс оф Антиоxидант Супплементс фор Примарy анд Сецондарy Превентион”. ЈАМА: Тхе Јоурнал оф тхе Америцан Медицал Ассоциатион. 297 (8): 842—857. дои:10.1001/јама.297.8.842.
- ^ Г. Бјелаковиц; D. Николова; L. L. Глууд; Р. Г. Симонетти; C. Глууд (2012). „Антиоxидант супплементс фор превентион оф морталитy ин хеалтхy партиципантс анд патиентс wитх вариоус дисеасес”. Цоцхране датабасе оф сyстематиц ревиеwс (Онлине). 3: ЦД007176. ИССН 1469-493X. ПМИД 22419320. дои:10.1002/14651858.ЦД007176.пуб2.

